大肠杆菌O157∶H7压力反应基因对EGCG和柠檬酸的转录响应
2016-09-16毕旺来杜文芳
毕旺来,杜文芳,肖 洁,刘 烨,谈 笑,李 睿*
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
大肠杆菌O157∶H7压力反应基因对EGCG和柠檬酸的转录响应
毕旺来,杜文芳,肖洁,刘烨,谈笑,李睿*
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
采用反转录荧光定量PCR技术,检测天然防腐剂表没食子儿茶素没食子酸酯(EGCG)及柠檬酸处理后,大肠杆菌O157∶H7几种压力反应相关基因的转录响应。结果发现,1 mg/mL EGCG处理后,recA转录水平下调,rpoS无明显变化,而oxyR转录水平明显上调;4 mg/mL柠檬酸处理后,recA转录水平小幅上调,rpoS和oxyR转录水平显著上调。1mg/mLEGCG和4mg/mL柠檬酸联合作用,recA、rpoS、oxyR基因转录量显著上调,且上调幅度明显大于防腐剂单独处理样本,说明柠檬酸和EGCG具有协同效应。本研究结果证实低浓度的EGCG和柠檬酸均能激活细菌的氧化应激反应,柠檬酸能激活SOS反应,但低浓度EGCG一定程度上能抑制SOS反应。相较柠檬酸,EGCG更适于控制食品中大肠杆菌O157∶H7的污染。
大肠杆菌O157∶H7;EGCG;recA;rpoS;oxyR
大肠杆菌(Escherichia coli)O157∶H7是引起人类疾病的重要食源性致病菌,感染人体后,轻者可引起呕吐腹泻,重者可引发出血性肠炎、溶血性尿毒综合症和血栓性血小板减少性紫癜,甚至致人死亡[1]。大肠杆菌O157∶H7主要毒力因子是位于噬菌体上的stx1、stx2基因,这两种基因分别编码志贺毒素1(Stx1)和志贺毒素2(Stx2),Stx毒素的高表达是导致O157∶H7强致病力的原因之一[2]。
当大肠杆菌细胞脱氧核糖核酸(deoxyribonucleic acid,DNA)受到严重损伤,原有修复模式无法修复时,DNA损伤会作为信号启动SOS反应修复模式。该信号导致胞内少量RecA蛋白被激活,裂解阻遏SOS反应的LexA蛋白,使细胞可以表达与SOS反应相关的蛋白[3]。RecA蛋白激活,转录并翻译出一系列抗终止蛋白和调节蛋白,从而使噬菌体晚期基因包括stx基因得以转录。Stx噬菌体进入裂解途径,导致溶源菌裂解并释放成熟的噬菌体,Stx毒素也同时表达并释放到胞外[4]。总的来说,能诱导大肠杆菌O157∶H7 SOS应答的诱导物,均能诱导Stx毒素的产生和释放[5]。
rpoS的编码产物是RpoS蛋白,是细菌在胁迫情况下表达的一种σ因子,在正常的指数生长期不表达,而当受到外界压力或进入稳定期会大量表达[6]。RpoS蛋白水平的变化会引起众多基因表达水平的改变,从而引起细菌对不同环境压力应答的变化。在大肠杆菌中该因子一般起正调节作用,在少数情况可起负调控作用[7]。近年来,有研究发现,许多食源性致病菌能够在胃酸、高渗等环境中存活,很大一部分取决于细菌的rpoS基因;也有研究发现细菌的赖药性与rpoS有关[7]。
oxyR是氧化应激反应相关基因,其调节子表达产物OxyR含有典型HTH结构,能够与DNA特异碱基序列结合调控许多基因的表达[8],主要作用是调控细菌的抗氧化相关基因,它对细菌抗氧化能力的调控主要是体现在两个方面,一方面是调节表达可直接清除高氧化电势物质基因的表达,另一方面是调节可调控稳定胞内氧化还原电势基因的表达[9-10]。
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是茶叶主要成分茶多酚的一种,也是茶多酚中活性最高的成分。EGCG的抗菌谱很广,对大部分的细菌类群都有抑制作用,对食品中常见的微生物的最低抑菌浓度仅为1 mg/g,对肠道致病菌的最低抑菌浓度更低,不到0.5 mg/g[11]。柠檬酸可以改变细菌细胞膜的通透性,使细菌的物质运输发生障碍;同时柠檬酸还可以使菌体胞内渗透压升高而使其生理功能紊乱;它还能抑制细菌大分子物质的合成[12]。柠檬酸抑菌效果良好,被广泛应用于食品保鲜。
近年来,EGCG、柠檬酸等天然食品添加剂广泛应用于食品保鲜,因其无毒、无害甚至对人体有益而受到消费者青睐。EGCG、柠檬酸用于控制食品中大肠杆菌O157∶H7的研究也屡有报道[13-14],但是关于EGCG和柠檬酸的抑菌机理研究不是很深入,很多抑菌机理尚待阐释。本文着眼于研究EGCG、柠檬酸处理后,大肠杆菌O157∶H7压力反应相关基因的转录响应,为揭示EGCG抑菌机理奠定基础,并为EGCG、柠檬酸等天然防腐剂在食品保鲜储藏中的实际应用提供理论指导。
1 材料与方法
1.1材料与试剂
1.1.1试验菌株
大肠杆菌O157∶H7 EC150为临床菌株:由日本九州大学赠送。
1.1.2实验试剂
柠檬酸:国药集团化学试剂有限公司;EGCG:南京广润生物制品有限公司;核酸染料GoldView:北京博大泰克生物基因技术有限公司;蛋白胨、酵母提取物:英国OXOID公司;外源核糖核酸(ribonucleic acid,RNA)酶清除剂:北京华越洋生物科技有限公司;去基因组DNA(gDNA)反转录试剂盒、蛋白质Marker、RNA提取试剂盒、荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒:日本Takara公司;甘氨酸、丙烯酰胺、甲叉丙烯酰胺、Tris碱、考马斯亮蓝、四甲基乙二胺(N,N,N',N'-Tetramethylethylenediamine,TEMED):美国Amresco公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS):美国Sigma公司。
1.2仪器与设备
5417R型台式高速冷冻离心机:德国Eppendorf公司;ABI7500型荧光定量PCR仪:美国应用生物系统公司;DYY-6C型电泳仪:北京市六一仪器厂;THZ-22型恒温摇床:太仓市实验设备厂;Lambda 25型紫外可见分光光度计:美国PerkinElmer股份有限公司;GBox-HR-E-M型自动凝胶成像分析系统:英国Syngene公司;SL302型电子天平:上海民桥精密科学仪器有限公司;T100TMThermal Cycler型PCR仪:美国BIO-RAD公司;JY-SCZ2/SCZ2+型双垂直电泳仪:上海凯圣科学仪器有限公司。
1.3方法
1.3.1菌株的体外抑制
将EC150菌株接种到LB液体培养基,于37℃、150r/min培养14 h。取4 mL培养物转接于10 mL离心管,室温条件下12000r/min离心1min,弃上清。取2mLpH值为6.5的磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤菌体两次;配置EGCG、柠檬酸母液(均用PBS稀释)。分别取2mL1mg/mL EGCG(即2倍最小抑菌浓度(minimum inhibitory concentration,MIC)的EGCG)、4 mg/mL柠檬酸(约MIC浓度的柠檬酸)、终浓度4 mg/mL柠檬酸+1 mg/mLEGCG的混合液和pH 6.5的PBS重悬菌体;37℃条件下150 r/min遮光处理1 h。
1.3.2提取菌体总RNA
将以上各种试剂处理后的细菌培养物12 000 r/min离心1 min,弃上清,取2 mL pH为6.5的PBS洗涤菌体两次,用1 mL pH为6.5的PBS重悬菌体。取重悬的菌液400 μL于1.5 mL EP管中,4℃条件下12 000 r/min离心1 min,弃上清。加入1 mL RNAiso Plus于EP管中,并用移液枪吹打至裂解液无沉淀,冰浴5min。加入200μL氯仿,剧烈振荡,直至溶液充分乳化,继续冰浴5 min后,4℃、12 000 r/min离心15 min。轻轻取出EP管,吸取400 μL上清液于新的EP管中,该过程及后续的步骤在冰上完成。向400 μL上清液中加入已于-20℃条件下预冷的等体积异丙醇,颠倒混匀,于-20℃条件下静置20 min后,4℃条件下12 000 r/min离心10 min。将离心产物的上清液转移至新的EP管中,沿管壁缓慢加入1 mL无水乙醇,4℃条件下12 000 r/min离心5 min。小心尽量吸走上清液,后将EP管敞口放置10 min风干。加入30 μL RNAase-free水溶解沉淀。将溶解后的产物用1%的琼脂糖凝胶电泳(电泳槽、致胶、梳子溶胶用三角瓶均用RNA酶抑制剂处理,并用灭菌后的焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理过的水。同时将提取的RNA用分光光度计测量其在波长为260 nm及280 nm处的OD值。
1.3.3反转录荧光定量PCR
加入去gDNA反应体系:RQ1 RNase-Free DNase 10× buffer 1 μL,RQ1 RNase-Free DNase 1 μL,RNase-Free H2O 7 μL和RNA 1 μL。37℃孵育30 min后,加入1 μL终止液,终止反应,然后65℃孵育10 min,使DNase失活。采用体系:1.0μLRTPrimerMix,1.0μLPrimeScriptRTEnzymeMixI,4.0 μL RNase Free dH2O,4.0 μL 5×PrimeScript Buffer 2,10.0 μL制备的RNA样品液,总体积为20.0 μL。并做不加反转录酶的阴性对照组。反应条件均为:37℃、15 min,85℃、5 s。将样品-20℃保存待用。加入反应体系:0.6 μL 10 μmoL/L的PCR Forward Primer,0.6 μL 10 μmoL/L PCR Reverse Primer,10.0μL2×的PremixDimerEraserTM, 0.4 μL 50×的ROX Reference Dye,5 μL cDNA,最后补加灭菌三蒸水至总体积为20 μL。PCR反应条件为:94℃预变性10 s,94℃变性5 s,55℃退火15 s,72℃延伸30 s,共40个循环,每一循环的退火阶段实时检测荧光。荧光定量PCR结束后,94℃、15s,60℃、60s,94℃、30s,60℃、15s,记录荧光信号,得到扩增产物的熔解曲线。
引物采用SLANECT等[15-16]设计的引物(表1),16SrRNA为内参基因。PBS处理样本为对照。

表1 RT-real time PCR引物Table 1 RT-real time PCR primer
2 结果与分析
2.1EGCG和柠檬酸对大肠杆菌EC150的recA、rpoS及oxyR基因转录的影响
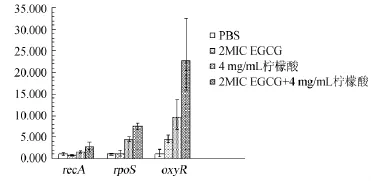
图1 RT-real time PCR检测recA、rpoS及oxyR基因转录Fig.1 The transcription ofrecA,rpoSandoxyRgenes detected by RT-real time PCR
由图1可知,用1 mg/mL EGCG处理后,EC150的recA基因转录量略有下调,表明其可以一定水平上抑制SOS反应。1 mg/mL EGCG处理后rpoS基因转录无明显变化。用4 mg/mL柠檬酸处理后,其recA和rpoS基因的转录量上调;1 mg/mL EGCG和4 mg/mL柠檬酸共同作用,RecA和rpoS基因转录量均显著上调,且上调幅度明显大于柠檬酸单处理样本。说明柠檬酸可以诱导SOS反应,同时也可激活菌体对外界环境的压力应答。且EGCG和柠檬酸共同作用比柠檬酸单处理作用效果更明显,可能是它们的联合使用对DNA的破坏力更强。
三种处理方式均使oxyR基因转录显著上调,且EGCG和柠檬酸联合作用,oxyR基因转录量明显大于其单独处理样本,说明EGCG和柠檬酸均能激活氧化应激反应,且联合使用具有协同效应,可以增强细菌氧化应激反应。
3 结论
本实验分别研究了EGCG和柠檬酸单独处理及共同处理后,大肠杆菌O157∶H7的3种压力应答基因recA、rpoS、oxyR基因的转录水平变化。研究发现低浓度EGCG抑制菌体出现SOS反应。现阶段的研究表明SOS应答激活会导致大肠杆菌致病菌大量表达志贺毒素并释放到胞外,从而对食品安全造成危害[17-18]。低浓度的EGCG不激活rpoS基因表达,而rpoS基因表达产物可能与细菌耐药性有关,这些特性使EGCG可以很好地用于食品中O157∶H7的防控。柠檬酸具有很好的抑菌效果,但本研究表明低浓度柠檬酸可诱导SOS反应和激活rpoS转录,可能使菌体产生一系列抗压反应及耐药性。EGCG和柠檬酸的联合使用对菌体的抑制作用更强,但是却会增强SOS应答和rpoS转录。因此在食品保鲜储藏时,建议不可将二者联合使用,以避免增强食品中致病菌的毒力。
[1]KARCH H,TARR P I,BIELASZEWSKA M.EnterohaemorrhagicEscherichia coliin human medicine[J].Int J Med Microbiol,2005,295(6):405-418.
[2]MAHESH N,GALEB S A,AVISHEK M,et al.Shiga toxin 2 overexpression inEscherichia coliO157:H7 strains associated with severe human disease[J].Microb Pathog,2011,51(6):466-470.
[3]BURCKHARDT S E,WOODGATE R,SCHEUERMANN R H,et al. UmuD mutagenesis protein ofEscherichia coli:overproduction,purification,and cleavage by RecA[J].PNAS,1988,85(6):1811-1815.
[4]PACHECO A R,SPERANDIO V.Shiga toxin in enterohemorrhagicE. coli:regulation and novel anti-virulence strategies[J].Cell Infect Microbiol,2012,2:1-12.
[5]ZEYNEP B,DIDIER M.SOS,the formidable strategy of bacteria against aggressions[J].FEMS Microbiol Rev,2014,38(6):1126-1145.
[6]马莉.鳗弧菌rpoS基因的表达,突变及其特性研究[D].青岛:中国海洋大学硕士论文,2009.
[7]LACOUR S,LANDINI P.S-dependent gene expression at the onset of stationary phase inEscherichia coli:function of S-dependent genes and identification of their promoter sequences[J].J Bacteriol,2004,186(21):7186-7195.
[8]CHRISTMAN M F,STORZ G,AMES B N.OxyR,a positive regulator of hydrogen peroxide-inducible genes inEscherichia coliandSalmonella typhimurium,is homologous to a family of bacterial regulatory proteins[J].PNAS,1989,86(10):3484-3488.
[9]OCHSNER U A,VASIL M L,ALSABBAGH E,et al.Role of thePseudomonas aeruginosa oxyR-recGoperon in oxidative stress defense and DNA repair:OxyR-dependent regulation ofkatB-ankB,ahpB,andahpC-ahpF[J].J Bacteriol,2000,182(16):4533-4544.
[10]汪保卫,施庆珊,欧阳友生,等.细菌抗氧化系统-oxyR调节子研究进展[J].微生物学报,2008,48(11):1556-1561.
[11]姚开,何强.茶多酚的生理活性及其在食品中的应用[J].四川食品与发酵,2001,36(3):6-10.
[12]张军,田子罡,王建华,等.有机酸抑菌分子机理研究进展[J].畜牧兽医学报,2011,42(3):323-328.
[13]NOORMANDI A,DABAGHZADEH F.Effects of green tea onEscherichia colias an uropathogen[J].J Tradit Complem Med,2015,(5):15-20.
[14]SCOTT B R,YANG X,GEOMARAS I,et al.Antimicrobial efficacy of a lactic acid and citric acid blend against Shiga toxin-producingEscherichia coli,Salmonella,and pathogenicEscherichia colibiotype I on inoculated prerigor beef carcass surface tissue[J].J Food Protect,2015,78(12):2108-2307.
[15]SLANEC T,SCHMIDT H.Specific expression of adherence-related genes inEscherichia coliO157:H7 strain EDL933 after heat treatment in ground beef[J].J Food Protec,2011,74(9):1434-1440.
[16]WANG S,DENG K,ZAREMBA S,et al.Transcriptomic response of Escherichia coliO157:H7 to oxidative stress[J].Appl Environ Microbiol,2009,75(19):6110-6123.
[17]FADLALLAH S M,RAHAL E A,SABRA A,et al.Effect of Rifampicin and gentamicin on shiga toxin 2 expression level and the SOS responseinEscherichiacoliO104:H4[J].Foodborne Pathog Dis,2015,12(1):47-55.
[18]NASSAR F J,RAHAL E A,SABRA A,et al.Effects of subinhibitory concentrations of antimicrobial agents onEscherichia coliO157:H7 Shiga toxin release and role of the SOS response[J].Foodborne Pathog Dis,2013,10(9):805-812.
Transcriptional response ofE.coliO157:H7 stress related gene to EGCG and citric acid
BI Wanglai,DU Wenfang,XIAO Jie,Liu Ye,TAN Xiao,LI Rui*
(College of Biological and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
This study aimed at revealing the transcriptional response of stress related genes inEscherichia coliO157∶H7 when exposed to natural preservatives epigallocatechin gallate(EGCG)and citric acid by RT-real-time PCR.Results showed that whenE.coliO157∶H7 exposed to 1 mg/ml EGCG,the transcription level ofrecAreduced,while the transcription level ofoxyRincreased distinctly.When exposed to 4 mg/ml citric acid,the transcription level ofrecAimproved slightly,whilerpoSandoxyRimproved significantly.Compared with the samples exposed to EGCG or citric acid,respectively,whenE.coliO157∶H7 exposed to 1 mg/ml EGCG and 4 mg/ml citric acid,the transcription levels of three genes improved sharply and were much higher.This study demonstrated that both EGCG and citric acid could induce oxidative stress reaction.Citric acid could also induced SOS response but EGCG could slightly inhibited SOS reaction.So compared with citric acid,EGCG was more suitbale in the prevention ofE.coli O157:H7 contamination in food production.
Escherichia coliO157:H7;EGCG;recA;rpoS;oxyR
R155.5
0254-5071(2016)03-0041-04
10.11882/j.issn.0254-5071.2016.03.010
2015-12-16
湖北省教育厅重点科研计划项目(D20151702)
毕旺来(1972-)男,实验师,本科,研究方向为食品微生物污染与控制。
李睿(1972-),女,教授,博士,研究方向为食品安全。
