我国黄酒酿造微生物的研究进展
2016-09-14刘程,谢广发,孙剑秋等
我国黄酒酿造微生物的研究进展
刘 程1,谢广发2,3,孙剑秋1,*,邹慧君2,3,王睿麒1,3,钱 斌2,3,臧 威1,周建弟2,3,寿凰蓉1,白逢彦4(1.绍兴文理学院生命科学学院,浙江绍兴312000;2.国家黄酒工程技术研究中心,浙江绍兴312000;3.浙江古越龙山绍兴酒股份有限公司,浙江绍兴312000;4.中国科学院微生物研究所真菌学国家重点实验室,北京100101)
对黄酒的浸米浆水、酒药、酒母、酒曲、酒醪中微生物资源和其他米酒微生物资源的研究进展进行综述,并总结了黄酒微生物育种技术的发展成果。基于我国黄酒微生物的研究现状,利用现代生物技术提升黄酒微生物的研究水平,全面、深入和系统地研究黄酒微生物资源、多样性、系统发育、生态分布、酿造功能、菌种选育及其环境微生物对黄酒生产的影响等诸多课题,对于我国黄酒产业健康发展具有重要理论意义和应用价值。
黄酒,微生物,育种
黄酒(Chinese rice wine)是源于中国的世界三大著名古酒之一[1],具有酒精度低、酒性醇厚、营养丰富、风味独特、品种多样等特点[2]。我国的黄酒生产主要集中在江浙沪地区,尤其以糯米为主要原料、用鉴湖水酿造的优质绍兴酒,最能够代表现代黄酒工业的发展水平。
黄酒采用边糖化边发酵的“双边发酵”技术生产,在酿造过程中淀粉酶的糖化功能与酵母菌的发酵特性平衡作用,保证了糖化与发酵两个过程相互协调、同时进行[3-4]。“双边发酵”过程,就是由各种微生物完成的生物化学反应过程。在微生物酶的催化下,酿酒原料被降解并转化形成酒精及其他各种风味成分,微生物酶的生物催化功能在黄酒生产中具有极其重要的作用,直接关系到酿酒的产量和质量[5]。黄酒酿造过程中复杂的物质变化,几乎都是在不同微生物产生的各种酶系作用下完成。黄酒酿造与许多其他传统酿造食品一样都属于开放式发酵[6],即使接种纯种微生物,在发酵过程中也不可避免的会有
外来微生物侵入,因此多种微生物混菌发酵是黄酒酿造微生物作用的基本特点。可是就整个生产过程来说,其中一些主要微生物类群发挥主导作用。
追根溯源,我国黄酒酿造技术拥有5000年以上悠久发展史[7],但是关于黄酒的科学认知仅有近50年的时间[1]。黄酒酿造技术基础理论研究的不足,困扰着我国黄酒工业生产水平的提升。本文对我国黄酒微生物方面的现有研究成果进行综述,对进一步深入开展黄酒微生物的基础研究具有积极意义。
1 与黄酒有关的微生物
1.1 浸米浆水中的微生物
黄酒酿造包括筛米、浸米、蒸饭、落缸、前酵、后酵、压榨、煎酒和贮存等诸多环节[8],其中浸米是黄酒正式发酵前的重要步骤。通过浸米,可以使大米吸水膨胀以利于蒸煮,并获得酸性米浆水[9]。在传统绍兴酒工艺中,米浆水作为投料用水被回收用于黄酒酿造[10]。一般认为,米浆水中氨基酸、维生素等可以被酵母菌细胞利用,而其中多种有机酸使发酵在最初阶段即具有一定的原始酸度,可以抑制杂菌生长,保证酵母菌的正常发酵。毛青钟等[11]发现,米浆水内微生物种类极其丰富,包括细菌、酵母菌和霉菌等类群;浆水中的有机酸(绝大部分是乳酸)主要是由乳酸杆菌发酵产生[12]。如果浆水中优势细菌的种类发生变化,可能对黄酒发酵过程产生影响[13]。
1.2 黄酒酒药中的微生物
传统黄酒酒药又称小曲、白药、酒饼,是以籼米等作为主要原料,在适宜的条件下培养后自然发酵而成的黄酒酿造用糖化发酵剂,具有糖化发酵力强、用药量少、方法简单、易于保存、使用方便等优点。比较有代表性的酒药,包括绍兴酒药、宁波酒药、苏州甜酒药、上海崇明“八二曲”、常州曲药等[14]。在我国南方的一些小型黄酒企业或农村,通常使用传统酒药酿制黄酒[5]。酒药内蕴含的丰富菌种资源(表1)主要源于陈药粉接种,保证优良菌株代代相传[15]。本课题组曾对浙江绍兴的古越龙山、会稽山、塔牌、沈永和、女儿红及鉴湖等六个品牌酒药样本内酵母菌资源进行系统研究,结果发现扣囊复膜孢酵母(Saccharomycopsis fibuligera)在六个品牌黄酒酒药内的分布占有绝对优势[16]。
1.3 黄酒酒母中的微生物
黄酒是一种含有酒精的发酵酒,需要大量酵母菌的参与来完成酿造过程,酵母菌的数量和质量对于黄酒酿造特别重要[18]。酒母,即“黄酒之母”,是由少量酵母菌逐渐扩大培养后制成的酵母醪液,可以为黄酒酿造提供所需要的大量酵母菌细胞的发酵剂。酒母在黄酒发酵醪液内繁殖的过程中,产生酒精并可以形成一些影响黄酒质量的风味物质,所以说没有酒母就没有黄酒。淋饭酒母是绍兴黄酒生产中非常重要的酒母类型,淋饭酒母制作过程中微生物变化复杂[19],主要涉及酵母菌、乳酸菌和一些霉菌(表2)。
1.4 黄酒酒曲中的微生物
酒曲是以小麦、大米等粮食或麸皮等粮食副产物作为主要原料,在适当的水份和温度条件下培养后,制成的含有大量具有糖化和发酵功能的各种微生物及其有关活性酶的糖化发酵剂。在黄酒酿造过程中,酒曲内的微生物或活性酶主要发挥糖化功能,将酿酒原料中的淀粉分解为葡萄糖,供酵母菌发酵利用而产生酒精;在制曲过程中形成的曲香及其积累的代谢产物,对于黄酒风格的形成起着十分重要的作用[5]。自然培养的酒曲内种类丰富,其中的真菌类群对于酒曲的糖化功能至关重要,所以近年来人们比较重视酒曲内真菌多样性的研究(表3)。江南大学陆健研究组采用传统分离培养方法和RISA、DNA序列分析等技术,对绍兴黄酒麦曲中的真菌组成进行了比较深入的分析[20-24];于丽娟等[25]研究了南通白蒲黄酒麦曲中真菌群落结构,结果发现与绍兴黄酒麦曲中真菌种群差异较大。据此,也可推测,不同地域生产的麦曲生产特性可能存在差异,进而影响黄酒的酿造质量与产品风格。

表1 黄酒酒药中的微生物Table1 The microorganisms in the xiaoqu of ricewine

表2 黄酒酒母中的微生物Table2 The microorganisms in the yeast starter of ricewine

表3 黄酒酒曲中的微生物Table3 The microorganisms in the jiuqu of ricewine
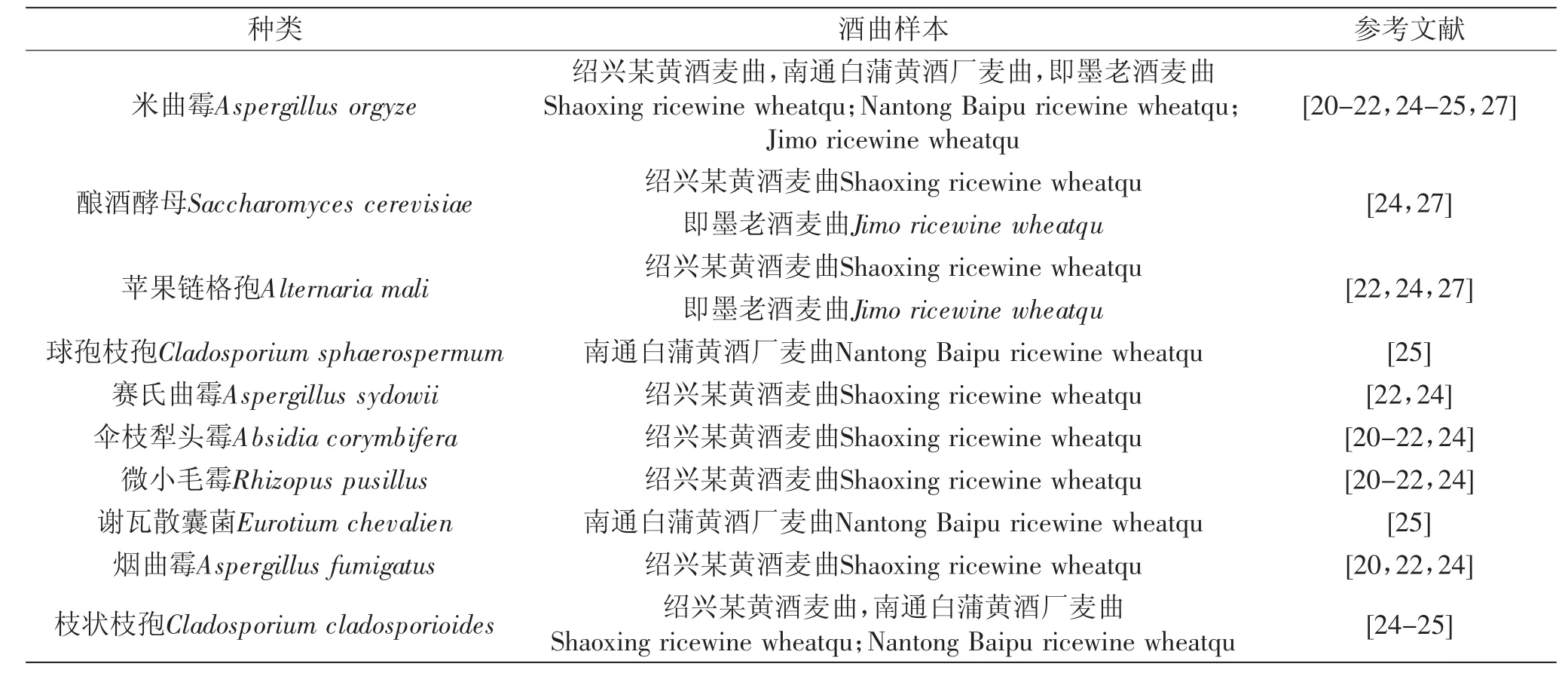
续表
1.5 黄酒醪液中的微生物
我国黄酒酿造技术具有悠久的发展历史,不同地区的黄酒生产形成了各自的酿造方法和独特风格[3]。黄酒酿造属于开放式发酵,主要源于酒曲、酒母及其他生产环境或工具设备的各种微生物类群存在于醪液内(表4),主导完成糖化和发酵过程中发生的极其复杂的物质变化。一般认为,酒曲提供的霉菌主要发挥糖化作用,源于酒母的酵母菌具有重要的发酵活性,但是近年来关于黄酒微生物的研究结果表明,黄酒醪液内细菌尤其是乳酸菌类群可能对黄酒生产的顺利进行具有重要影响,而且对黄酒风味的形成也起到一定作用[28-30]。

表4 黄酒醪液中的微生物Table4 The microorganisms in the mash of ricewine

续表
1.6 米酒中的微生物
米酒又称甜酒,一般以优质米为主要原料,经过微生物的酸化、糖化、酒化和酯化等一系列生化过程及其代谢的协调作用酿制而成,营养丰富、风味独特、甘饴可口[36]。米酒作为我国古老的酒种之一,在我国南北方均有酿造,尤其以湖北孝感等地的米酒最为有名。基于米酒的酿制工艺与产品特性等,各地的米酒均应该属于传统发酵型黄酒范畴[37]。向文良等[36]利用AFLP指纹图谱技术对四川传统米酒发酵过程中原核微生物演替规律进行研究,结果发现随着酒曲的接入米酒醅中原核微生物伴随米酒理化因子的动态变化而发生群落演替。各种有益微生物是米酒酿造的决定因素,酒香主要来源于各种微生物的混合发酵,菌种(表5)间的相互作用、组成比例及其代谢关系、代谢产物等,对米酒的质量和风味都有着直接影响[38]。
2 黄酒微生物选育
微生物育种技术是提高产品质量和产量、增加产品类型的重要手段[41],我国的黄酒企业及相关技术人员一直重视黄酒微生物的选育工作。黄酒生产用微生物菌株与其他工业微生物一样,主要有两个来源,从酿酒样本中分离筛选得到即选种或者对保藏菌株进行遗传改良获得即育种。
由于黄酒企业的研发基础比较薄弱,通过对研发条件要求较低的传统分离筛选方法获得优良生产菌株的菌种选育技术,是企业人员优先考虑的技术方向。谢广发等[42]采用TTC法、CO2失重法并结合酿酒实验,从淋饭酒母中分离筛选到快速发酵的酿酒酵母GY-9,用于机械化黄酒生产能够提高成品酒的酒精度、缩短发酵周期。高永强等[43]将分离自会稽山的香雪酒中酵母菌,经过酵母水实验、锥型瓶发酵、耐酒精、耐高温、速酿酒母制作和锥型瓶模拟大缸发酵实验等,筛选到了耐高酒精度、耐高浓度糖的酵母菌株。糖化菌对于黄酒酿造原料的生物转化非常重要,为丰富纯种麦曲糖化菌种资源,从绍兴多个黄酒企业的生麦曲中分离筛选到几株米曲霉SJM-1、SJM-2、SJM-3、SJM-4,与普遍应用的苏-16相比较,糖化力和液化力更高、酿酒性能更好[44]。由于传统分离筛选方法操作简单、易于应用,企业外的研究人员对这项技术也比较关注。张建炜等[45]通过不同单倍体菌株耐受能力比较和黄酒发酵酒样中残糖、酒精度及乙酸乙酯和异戊醇含量分析,筛选出了优良的黄酒酵母遗传育种单倍体。杨鲁君等[46]从古越龙山麦曲、酒药、发酵醪中分离到52株真菌,通过比较菌株的耐乙醇和渗透压能力,筛选出抗逆性强的酿酒酵母F-18,该菌株起酵速度快,对糖的转化利用能力高,而总酸、高级醇等含量适中。从古越龙山浆水、酒药和酒曲内分离筛选出一株植物乳杆菌,能快速提高米浆水酸度,缩短浸米时间并抑制杂菌生长,而且可以有效地降低浸米水中生物胺含量[47]。
基于自发突变原理,从酿酒样本中可以分离筛选得到优良菌株。但是,诱变育种却可以使黄酒微生物的突变频率以几何级数增加。诱变育种技术若与高效的筛选技术结合,可以大大提高育种工作效率。以不产生毒素的黄曲霉为原始菌株,经过紫外线与LiC1复合诱变、碳酸钡诱发及自然分离方法选育到一株突变株,糖化酶和液化酶活力分别比亲株提高103.46%和65.08%,酿酒性能更好,而且生产性状能够稳定遗传[48]。潘丽军等[49]对黑曲霉出发菌株进行紫外诱变、紫外线与LiC1复合诱变处理,筛选到一株高产糖化酶的正向突变株,产酶活力提高73.63%,而且该菌株的耐酸、耐酒精性能良好;连续传代8次后,产酶活力没有显著差异,具有良好的酶活稳定性。可以应用于黄酒微生物诱变的理化因素很多,但是因为紫外线(UV)等可以引起染色体畸变的诱变剂不易回复突变[50],安全简便,是工业微生物诱变育种的最常用方法。

表5 米酒中的微生物Table5 The microorganisms in ricewine
近年来,黄酒研究人员已经认识到,传统分离筛选方法的选种效率低,而诱变的育种劳动强度大,现代生物技术的迅速发展可能明显提升我国黄酒微生物育种的研究水平。赵然然等[51]采用长侧翼同源PCR法(LFH-PCR)构建基因敲除组件,然后把敲除组件转入黄酒酵母细胞中,利用同源重组机制精确敲除精氨酸酶基因(CAR1)构建黄酒酵母工程菌株,敲除CAR1基因工程菌酒液中尿素含量降低72%,氨基甲酸乙酯含量降低了38%,并且该菌株的遗传稳定性好,发酵性能与出发菌株基本一致。根据申超等[52]报道,采用融合PCR技术,将DUR3基因置于强启动子PGKlp后构建过表达组件“URA3-PGKlp-DUR3-PGK1t-URA3”,转化工业黄酒酵母单倍体Na(MATa),获得单倍体工程菌所酿黄酒发酵液中尿素含量降低了55%,氨基甲酸乙酯含量降低10.9%。基因工程技术在减低黄酒中氨基甲酸乙酯产生,构建尿素吸收型工业黄酒酵母工程菌方面已经取得一定成绩。但是,考虑到食品安全问题,以基因工程为代表的现代生物育种手段可能会在黄酒微生物选育工作中受到限制和制约[1],适应进化(Adaptive evolution)策略是黄酒生产菌株育种的重要发展方向[53]。
3 总结与展望
关于我国黄酒微生物的研究已经取得一定成绩,可是与白酒等其他饮料酒微生物研究相比较,还存在明显差距[54]。许多关于黄酒微生物的研究结果还不够深入,或者由于技术方法比较落后而直接导致研究结果可能存在偏差甚至错误,目前的研究成果远不能满足黄酒行业跨越发展对科技进步的需求。尽管RISA、DNA序列分析及其基因敲除等分子生物学技术已经开始运用于黄酒微生物的研究中[23-24,51],但是利用现代生物技术,提升黄酒微生物的研究水平,全面、深入和系统地研究黄酒微生物资源、多样性、系统发育、生态分布、酿造功能、菌种选育及其环境微生物对黄酒生产的影响等诸多课题,对于我国黄酒产业健康发展仍然具有重要理论意义和应用价值。
[1]徐岩,陈双,王栋,等.中国黄酒技术研究新进展[J].酿酒科技,2013(12):1-8.
[2]黄亚东主编.实用酿酒技术[M].北京:科学出版社,2011.
[3]顾国贤主编.酿造酒工艺学(第二版)[M].北京:中国轻工业出版社,1996.
[4]杨国军编著.绍兴黄酒酿制技艺[M].杭州:浙江摄影出版社,2009.
[5]谢广发编著.黄酒酿造技术[M].北京:中国轻工业出版社,2010.
[6]胡志明,谢广发主编.黄酒[M].杭州:浙江科学技术出版社,2008.
[7]朱宝镛,章克昌主编.中国酒经[M].上海:上海文化出版社,2000.
[8]傅祖康,杨国军编著.黄酒生产200问[M].北京:化学工业出版社,2010.
[9]李海霞,何国庆,楼凤鸣,等.黄酒酿造中浸米浆水有机物组成及其微生物富集的研究[J].中国食品学报,2011,11(8):168-174.
[10]康明官编著.黄酒和清酒生产问答[M].北京:中国轻工业出版社,2003.
[11]毛青钟,陈细丹.黄酒浸米浆水表面微生物的研究[J].江苏调味副食品,2009,26(3):19-21.
[12]毛青钟.黄酒浸米浆水及其微生物变化和作用[J].酿酒科技,2004b(3):73-76.
[13]毛青钟,俞关松.黄酒浸米浆水中优势细菌的不同对发酵的影响[J].酿酒,2010,37(5):69-73.
[14]杜士良.漫谈黄酒专用小曲[J].酿酒科技,2003(4):40-42.
[15]毛青钟,俞关松,陈郛.传统黄酒小曲制作过程微生物及产香的变化[J].中国酿造,2006(6):55-57.
[16]臧威,谢广发,孙剑秋,等.绍兴黄酒酒药中酵母菌的物种资源[J].菌物学报,2015,34(6):1078-1084.
[17]刘振民,骆承庠.江米酒微生物研究[J].农牧产品开发,2000(3):14-16.
[18]胡普信主编.黄酒酿造技术[M].北京:中国轻工业出版社,2014.
[19]毛青钟.传统黄酒淋饭酒母制作过程微生物的变化和作用[J].酿酒科技,2004a(6):79-82.
[20]方华,曹钰,陆健,等.黄酒麦曲中主要霉菌的分子鉴定及分类[J].酿酒科技,2006(3):45-47.
[21]曹钰,陈建尧,谢广发,等.黄酒麦曲天然发酵中真菌群落的成因初探[J].食品与生物技术学报,2008a,27(5):95-101.
[22]曹钰,陆健,方华,等.绍兴黄酒麦曲中真菌多样性的研究[J].食品科学,2008b,29(3):277-282.
[23]陈建尧,曹钰,谢广发,等.黄酒机械成型麦曲制曲过程中真菌动态变化的研究[J].食品与发酵工业,2008,34(8):42-47.
[24]陆健,曹钰,方华,等.绍兴黄酒麦曲中真菌的初步研究[J].食品与生物技术学报,2008,27(2):78-83.
[25]于丽娟,丁斐,叶辉.南通白蒲黄酒麦曲真菌群落结构研究[J].中国酿造,2012,31(7):100-103.
[26]梁香,吴天祥,敖锐,等.黄酒优良糖化菌株的筛选及其酶活性能的研究[J].酿酒科技,2015(3):12-15.
[27]谭婷婷,王家林,桑戈,等.北方黄酒麦曲中真菌的筛选、鉴定及系统发育分析[J].安徽农业科学,2015,43(17):15-16,71.
[28]胡志明,谢广发,吴春,等.黄酒大罐发酵醪液中原核微生物的初步研究[J].酿酒科技,2009(8):58-61.
[29]冯浩,毛健,黄桂东,等.黄酒发酵过程中乳酸菌的分离、鉴定及生物学特性研究[J].食品工业科技,2013(16):224-228.
[30]Ke LQ,Wang LL,Li HB,et al.Molecular identification of lactic acid bacteria in Chinese rice wine using species specific multiplex PCR[J].Eur Food Res Technol,2014,239:59-65.
[31]栾同青,李志军,钟其顶,等.黄酒酿造过程细菌群落结构变化初步研究[J].食品工业科技,2013,34(12):177-180.
[32]张凤杰,褚小米,薛洁,等.黄酒酿造过程中细菌群落组成及发酵特性研究[J].酿酒科技,2013(12):32-35.
[33]周韩玲,杜丽平,孟镇,等.黄酒发酵液中产生物胺乳酸菌的分离鉴定与评价[J].食品与发酵工业,2011,37(8):47-50.
[34]曹钰,谢广发,陈建尧,等.加饭酒大罐发酵过程中真菌群落的动力学研究[J].食品与发酵工业,2008c,34(11):15-20.
[35]杨静静,孟镇,钟其顶,等.黄酒生产中酵母菌多相鉴定技术研究[J].中国酿造,2011(8):53-56.
[36]向文良,罗海,梁华忠,等.基于16S 23S rRNA ITS AFLP对米酒发酵过程中原核微生物的演替分析[J].酿酒科技,2010 (2):43-46.
[37]黄继红,张新武,杨公明,等.客家糯米酒高产菌株筛选及鉴定研究[J].农产品加工,2011(2):19-22.
[38]郝莹,王卫卫,王莉娟,等.陕北传统米酒曲中优势菌种的分离、纯化及鉴定[J].检验检疫学刊,2010,20(2):44-47,20.
[39]徐本刚,母应春,陈虹文,等.贵州黑糯米酒曲优良酵母茵分离筛选与鉴定[J].中国酿造,2012,31(4):62-67.
[40]李福荣.信阳米酒微生物群落组成[J].信阳师范学院学报,2005,18(1):52-53,70.
[41]傅金泉主编.中国酿酒微生物研究与应用[M].北京:中国轻工业出版社,2008.
[42]谢广发,郑志强,马晋,等.快速发酵黄酒酵母菌的筛选[J].中国酿造,2010(8):12-14.
[43]高永强,边佳娜.香雪酒中的黄酒酵母选育[J].江苏调味副食品,2008,25(1):29-32.
[44]胡志明,丁美珍,谢广发.黄酒糖化菌的筛选[J].酿酒科技,2003(3):39-40.
[45]张建炜,肖冬光,张翠英.优良黄酒酵母单倍体的分离筛选[J].酿酒科技,2010(5):36-38,41.
[46]杨鲁君,蒋予箭,李余动.黄酒酵母优良抗逆菌株的筛选、鉴定及发酵特性研究[J].中国食品学报,2013,13(9):71-77.
[47]程斐,周高峰,谢广发,等.适用于黄酒生物酸化浸米的乳酸菌筛选[J].食品与生物技术学报,2013,32(10):1079-1084.
[48]夏艳秋,朱强,汪志君.高产糖化酶黄曲霉菌的选育及初步应用[J].微生物学通报,2009,36(10):1542-1546.
[49]潘丽军,梁铁艳,刘德扬,等.优良黄酒糖化菌株的选育[J].包装与食品机械,2007,25(6):34-37.
[50]Kole MM,Altosaar I.Increased chitinase production by a non-pigmented mutant of Serratia marcescens[J].FEMS Microbiol Letters,1985,26(3):265-269.
[51]赵然然,陆健,谢广发.基于PCR方法敲除黄酒酵母精氨酸酶基因的工程菌构建[J].食品工业科技,2012,33(17):159-162.
[52]申超,吴殿辉,李晓敏,等.尿素吸收型工业黄酒酵母单倍体工程菌的构建[J].食品与发酵工业,2014,40(3):25-29.
[53]Chen S,Xu Y.Adaptive Evolution of Saccharomyces cerevisiae with Enhanced Ethanol Tolerance for Chinese Rice Wine Fermentation[J].Appl Biochem Biotechnol,2014,173:1940-1954.
[54]刘雯雯,孙剑秋,平文祥,等.中国白酒窖池真菌的研究进展[J].中国酿造,2012,31(6):1-6.
Research progress on the microorganisms of Chinese ricewine
LIU Cheng1,XIE Guang-fa2,3,SUN Jian-qiu1,*,ZOU Hui-jun2,3,WANG Rui-qi1,3,QIAN Bin2,3,ZANG Wei1,ZHOU Jian-di2,3,SHOU Huang-rong1,BAI Feng-yan4
(1.College of Life Sciences,Shaoxing University,Shaoxing 312000,China;2.National Engineering Research Center for Chinese Rice Wine,Shaoxing 312000,China;3.Zhejiang Guyuelongshan Shaoxing Rice Wine Co.,Ltd.,Shaoxing 312000,China;4.State Key Laboratory of Mycology,Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China)
The research progresses of microbial resources in seriflux,xiaoqu,yeast starter,jiuqu,fermentation broth of Chinese ricewine and other ricewines were reviewed and the development results of microbial breeding technology in Chinese ricewine were concluded.In order to enhance the research level of microbiologies in Chinese ricewine,using modern biotechnologies to study the microbial resources,diversity,phylogenesis,ecological distribution,brewing function and breeding in Chinese ricewine and other environmental microbiologies which should have an impact on Chinese ricewine production.The study must be comprehensive,in-depth and systematical.It had important theoretical significance and application value on healthy development of Chinese ricewine industry.
Chinese ricewine;microorganism;breeding
TS201.1
A
1002-0306(2016)08-0374-07
10.13386/j.issn1002-0306.2016.08.070
2015-10-08
刘程(1993-),男,大学本科,研究方向:环境微生物技术,E-mail:185819840@qq.com。
*通讯作者:孙剑秋(1969-),男,博士,教授,研究方向:酿酒微生物技术,E-mail:jianqius@163.com。
国家自然科学基金青年基金项目(31500020);中国科学院微生物研究所真菌学国家重点实验室开放课题(SKLMKF201307);浙江省重大科技专项(2013C02006-1);浙江省大学生科技创新活动计划暨新苗人才计划(2015R428006);绍兴市公益性技术应用研究计划项目(2014B70042)。
