大孔树脂分离纯化文冠果落果总黄酮的工艺研究
2016-09-14石光波杨素芝李正娟孙宜君李青叶赵肖荣李博生北京林业大学生物科学与技术学院北京10008北京林业大学林业食品加工与安全北京市重点实验室北京10008赤峰市林业科学研究院内蒙古赤峰100024北京林业大学螺旋藻研究所北京10008
石光波,杨素芝,李正娟,孙宜君,李青叶,赵肖荣,李博生(1.北京林业大学生物科学与技术学院,北京10008;2.北京林业大学林业食品加工与安全北京市重点实验室,北京10008;.赤峰市林业科学研究院,内蒙古赤峰100024;4.北京林业大学螺旋藻研究所,北京10008)
大孔树脂分离纯化文冠果落果总黄酮的工艺研究
石光波1,2,杨素芝3,李正娟1,2,孙宜君1,2,李青叶1,2,赵肖荣1,2,李博生2,4,*
(1.北京林业大学生物科学与技术学院,北京100083;2.北京林业大学林业食品加工与安全北京市重点实验室,北京100083;3.赤峰市林业科学研究院,内蒙古赤峰100024;4.北京林业大学螺旋藻研究所,北京100083)
以总黄酮吸附量为考察指标,采用分光光度法进行测定,先从D101、AB-8、HPD-400、D001、X-5五种不同类型大孔树脂中筛选出静态分离纯化文冠果落果总黄酮的最佳树脂,再对该树脂进行动态吸附工艺参数研究,以确定其对文冠果落果总黄酮的最优纯化方案。结果表明,HPD-400型大孔树脂对文冠果落果总黄酮分离纯化效果最好,优选工艺条件:上样液浓度0.53 mg/mL,上样液pH3.0,上样体积为1.5 BV,上样流速为3 BV/h;洗脱流速为2 BV/h,去离子水除杂体积2 BV,40%乙醇洗脱液3 BV,产物中总黄酮纯度45.79%。上述采用HPD-400型树脂分离纯化文冠果落果总黄酮效果最好,且具有工艺稳定性。
文冠果落果,总黄酮,大孔树脂,静态吸附,动态吸附
文冠果(Xanthoceras sorbifolia Bunge)隶属无患子科(Sapindaceae)文冠果属(Xanthoceras Bunge)[1],又名文官果,是我国特有的木本油料树种,主要分布于北方山西、陕西、内蒙古、辽宁等省份[2]。近年来倍受关注并广泛种植,现全国有成林约25万公顷[3]。文冠果全身都是宝,对文冠果的研究目前主要集中于
种仁榨油[4];种皮香豆素等活性物质提取[5-6];果壳皂苷生物活性物质研究[7];树枝木材的中蒙医药开发利用[8]等方面。然而文冠果“千花一果”,座果率极低,落果是导致座果率低的重要原因之一。据笔者在赤峰地区采样统计,五月末至六月中旬集中有两次落果,落果率高达90%以上[9]。该部分落果资源量大,且亦是植物有效光合作用产物,对其合理开发利用可极大推动文冠果产业的发展,然而至今对文冠果落果的研究尚未见报道。经前期实验研究发现,文冠果落果含多糖、多酚、黄酮等生物活性物质,其中黄酮类物质含量高达58.69 mg/g,是沙棘叶黄酮22 mg/g[10]的2.5倍。黄酮类物质是植物的次级代谢产物,具有较高的生物活性如抗氧化、抗肿瘤、治疗阿兹海默症等[11-12],是部分药品及保健品的核心成分。目前针对黄酮类物质的纯化主要应用高速逆流色谱,聚酰胺树脂和大孔树脂等方法,其中大孔树脂因其高效、稳定、经济可重复利用等优势,在总黄酮分离纯化中应用最为广泛,如分离纯化刺梨、山香圆叶、鹰嘴豆、肺形草总黄酮等[13-16]。但如何应用大孔树脂对文冠果落果总黄酮进行分离纯化,尚属该领域研究空白。本研究通过对大孔树脂类型选择的探索及最佳工艺参数的设定,旨在为应用大孔树脂对文冠果落果总黄酮分离纯化提供有效方案,亦在为文冠果落果资源的利用开辟一条新途径,以期提高文冠果综合开发经济价值,从而推动文冠果研究与生产的发展。
1 材料与方法
1.1 材料与仪器
文冠果落果 收集于赤峰市林科院苗圃;芦丁标准品 纯度>98%,东京化成工业株式会社;大孔树脂D101、AB-8、HPD-400、D001、X-5 北京科百奥生物技术有限公司;亚硝酸钠、氢氧化钠、氯 均为分析纯,天津津科精细化工研究所;无水乙醇 分析纯,北京化工厂。
CP214电子天平 上海奥豪斯仪器有限公司;722型分光光度计 上海舜宇恒平仪器有限公司;TD5A台式低速离心机 湖南赫西仪器装备有限公司;SHZ-Ⅲ循环水式多用真空泵 上海知信实验仪器技术有限公司;SHA-BA水浴恒温振荡器 金坛市荣华仪器制造有限公司;BT-100恒流泵、BS-100A自动部分收集器 上海沪西分析仪器厂有限公司。
1.2 实验方法
1.2.1 文冠果落果粗黄酮提取液的制备 将收集来的文冠果落果清水冲洗去沙土等杂质,烘箱内60℃烘干。粉碎机磨粉,过60目筛,制成文冠果落果粉。称取一定量文冠果落果粉,按料液比1∶40(g/mL)加入体积分数40%的乙醇水溶液,80℃水浴热回流提取3 h。将提取液在4000 r/min离心15 min,弃去不溶物。滤液减压蒸发浓缩(蒸至无醇味浸膏状),加少量去离子水溶解,作为原液保存备用。
1.2.2 芦丁标准曲线的制备 精密称取10 mg芦丁置于100 mL容量瓶中用去离子水定容,配成浓度为0.1 mg/mL芦丁标准溶液。分别取0.2、0.6、1.0、1.5、2 mL芦丁标准溶液,加入0.3 mL质量分数5%亚硝酸钠溶液,摇匀静置6 min,加入0.3 mL质量分数10%氯化铝溶液,摇匀静置6 min,加入2 mL质量分数4%氢氧化钠溶液,定容至10 mL,摇匀后静置15 min,在510 nm处测其吸光值[17]。以芦丁浓度为横坐标,溶液吸光值为纵坐标绘制曲线并进行线性回归,得回归方程Y=0.9587X+0.0001(R2=0.9999),在0.01~0.1 mg/mL范围内线性关系良好。
1.2.3 大孔树脂的预处理 分别取一定量的D101、AB-8、HPD-400、D001、X-5型大孔树脂,置于锥形瓶内。加入95%乙醇浸泡24 h,充分溶胀后,用去离子水清洗至无醇味,除去破碎及细小树脂。再用3%盐酸溶液浸泡3 h,去离子水洗至中性。最后用4%氢氧化钠溶液浸泡3 h,去离子水洗至中性并浸泡备用。
1.2.4 大孔树脂的筛选 按照大孔树脂不同极性及吸附特性,选择D101、AB-8、HPD-400、D001、X-5五种类型大孔树脂进行静态吸附及洗脱实验,以筛选出最适于文冠果落果黄酮吸附分离纯化的大孔树脂类型。精密称取预处理好的D101、AB-8、HPD-400、D001、X-5型湿树脂(滤纸吸干表面水分)各1.0 g,置于50 mL具塞锥形瓶内,加入浓度为2.64 mg/mL文冠果总黄酮提取液20 mL,置于25℃水浴摇床中,振荡摇匀吸附10 h。用适量去离子水清洗大孔树脂表面未吸附黄酮至无色,合并滤液并测定其吸光值,计算得出各类型树脂的静态饱和吸附量、吸附率。
大孔树脂静态饱和吸附量及吸附率计算公式:
饱和吸附量(mg/g)=(上样液总黄酮浓度×上样液体积-滤液总黄酮浓度×滤液体积)/大孔树脂质量
吸附率(%)=(1-滤液中总黄酮浓度×滤液体积/上样液总黄酮浓度×上样液体积)×100
将上述已达饱和吸附的不同类型大孔树脂分别置于50 mL具塞锥形瓶内,加入40 mL体积分数为60%的乙醇水溶液,在25℃水浴摇床内静态洗脱,振荡摇匀解吸附10 h。测定滤液中总黄酮的浓度,计算得出各类型树脂的解吸率。
不同类型大孔树脂解吸率计算公式:
解吸率(%)=洗脱液总黄酮浓度×洗脱液体积/静态饱和吸附量×100
1.2.5 文冠果落果总黄酮吸附纯化条件的优化
1.2.5.1 最适上样液pH的确定 取一定量HPD-400湿树脂吸干表面水分后,精密称取2.0 g每份,共5份,分别至于50 mL具塞磨口锥形瓶内,精确加入浓度为2.64 mg/mL文冠果总黄酮原液各20 mL,用盐酸调节pH至2.0、3.0、4.0、5.0、6.27(原液pH)置于25℃恒温水浴振荡器中,振荡摇匀吸附10 h。过滤,用去离子水冲洗至溶液无颜色。向吸附后大孔树脂中加入40 mL体积分数为60%的乙醇水溶液,于25℃水浴摇床内静态洗脱,振荡摇匀10 h。测定滤液中总黄酮的浓度,计算其吸附率。
1.2.5.2 最适上样液浓度的确定 将预处理好的HPD-400型大孔树脂湿法装柱,层析柱规格20 cm×φ10 mm。将浓度为2.64 mg/mL原液分别稀释成浓度为:0.26、0.53、1.06、2.18、2.64 mg/mL的溶液,各取20 mL,调节pH为3.0,上样流速为2 BV/h,以同样流
速用2 BV去离子水清洗除杂,再用4 BV体积分数40%乙醇溶液洗脱,测定洗脱液中总黄酮的浓度,计算对上样液中总黄酮的吸附率,得出最适上样液浓度。
1.2.5.3 最适上样流速的确定 将20 mL浓度0.53 mg/mL黄酮溶液,调节pH为3.0,分别设置流速为1、2、3、4、5 BV/h进行上样,以2 BV/h的流速用2 BV去离子水清洗除杂,再用4 BV体积分数40%乙醇溶液洗脱,测定其洗脱液浓度,计算对上样液中总黄酮吸附率,得出最适上样流速。
1.2.5.4 黄酮上样量穿透实验 将浓度为0.53 mg/mL黄酮溶液,pH调节至3.0进行上样,流速为2 BV/h,滤液按每管5 mL进行分段收集,测其吸光值,绘制出黄酮泄漏曲线,并计算得出大孔树脂饱和吸附量。
1.2.5.5 乙醇梯度洗脱实验 将浓度为0.53 mg/mL黄酮溶液,pH调节至3.0取25 mL进行上样,上样流速为2 BV/h,以2 BV去离子水清洗除杂,流速同为2 BV/h,再分别用体积分数为20%、40%、60%、80%、95%乙醇溶液各50 mL进行洗脱,分段收集洗脱液测定吸光值,计算得出各洗脱液中总黄酮的含量百分比。
洗脱液中总黄酮含量百分比计算公式:
总黄酮含量百分比(%)=洗脱液体积×洗脱液中总黄酮浓度/(上样液总黄酮浓度×上样液体积-滤液总黄酮浓度×滤液体积)×100
1.2.5.6 乙醇洗脱液浓度的确定 取浓度为体积分数20%、30%、40%、50%、60%的乙醇溶液按1.2.5.5实验条件再次进行洗脱实验,并最终确定最适乙醇洗脱液浓度。
1.2.5.7 乙醇洗脱液用量的确定 将浓度为0.53 mg/mL黄酮溶液,pH调节至3.0进行上样,流速为2 BV/h,以2 BV去离子水清洗除杂,流速同为2 BV/h,用40%乙醇溶液进行洗脱,洗脱流速不宜过快,应使被吸附的黄酮在大孔树脂内部充分解吸出来,使洗脱干净彻底,参照文献报道[18-21],确定为2 BV/h。每管5 mL收集洗脱液,分别测其吸光值,计算总黄酮含量,绘制不同体积洗脱曲线,确定洗脱液用量。
1.3 数据处理
应用SPSS 18.0进行实验数据处理。
2 结果与分析
2.1 不同类型大孔树脂对总黄酮吸附和解吸的影响
不同类型大孔树脂对总黄酮的吸附量,吸附率及解吸率具有一定差异,结果如表1所示,HPD-400型大孔树脂分离纯化黄酮,吸附率及解吸率均高于其他类型。其吸附率高于AB-8型约10%,解吸率是D001型的1.46倍,综合考虑5种树脂的吸附与解吸性能,选择HPD-400型树脂为研究对象,进一步优化其对文冠果落果总黄酮的纯化工艺。而在大孔树脂的极性上分析,不同极性代表不同的表面电性,即对被吸附物质的氢键作用力不同,具有相似相吸原理。强极性树脂从非极性溶液中吸附极性物质,中等极性树脂从溶液中吸附极性与非极性物质,而非极性或弱极性树脂从极性溶液中吸附非极性物质。因此可以初步判断,文冠果落果总黄酮类物质既有极性类,又有非极性类,推测黄酮及黄酮醇类物质含量较多。

表1 大孔树脂不同类型筛选实验结果Table1 Experimental results of different types of macroporous resins
2.2 不同上样液pH对总黄酮吸附率的影响
随着上样液pH的升高,HPD-400大孔树脂对总黄酮吸附率呈下降趋势,吸附率变动范围为80.29%~67.28%,pH为2.0~3.0时,吸附率下降趋势缓慢,只下降了1.46%,而pH3.0~6.27时吸附率下降较明显,累计下降了11.55%。而目标pH越低,盐酸添加量越多,考虑到扩大化生产时盐酸添加量较大等因素,选择最适上样液pH为3.0。

图1 不同上样液pH对吸附率的影响Fig.1 Effect of sample pH on adsorption capacity of HPD-400 resin
2.3 不同上样液浓度对总黄酮吸附率的影响
总黄酮吸附率随着上样液浓度的升高而降低,实验结果如图2所示。分析原因,可能是由于高浓度黄酮溶液堵塞了大孔树脂颗粒中的液体通路,导致吸附不完全,使得吸附率下降。但上样液浓度为0.26 mg/mL与0.53 mg/mL时无显著差异(p>0.05),考虑
到上样液浓度越小即原液稀释倍数越大,上样量总体积也越大,实验所需的时间越长,为提升实验效率选择0.53 mg/mL为最佳上样浓度,进行后续实验研究。

图2 不同上样液浓度吸附率图Fig.2 Effect of different sample concentration on adsorption capacity of HPD-400 resin Results of
2.4 不同上样流速对总黄酮吸附率的影响
总黄酮吸附率随上样流速增大总体呈下降趋势,结果如图3所示,吸附率依次由89.89%降至85.34%。1~3 BV/h时下降趋势平缓,而3~4 BV/h时吸附率下降趋势明显。通常情况下,被吸附物质通过树脂柱速度越慢,越能和树脂充分接触,从而更好地被吸附。流速过大时,冲击效果明显,黄酮类物质不能充分流经大孔树脂内部而从树脂表面间隙中快速通过,导致吸附效果较差。由实验结果可知3 BV/h比2 BV/h吸附率只下降了0.02%,综合考虑时间因素,兼顾提升工作效率,选择3 BV/h为最适上样流速。

图3 不同上样流速吸附率图Fig.3 Effect of different sample flow rate on adsorption capacity of HPD-400 resin
2.5 总黄酮吸附泄漏曲线绘制
按上述所确定条件,上样液pH为3.0,上样液浓度为0.53 mg/mL,上样流速为3 BV/h,进行动态吸附实验。分段收集流出液,每份5mL,共收集29管。以流出液中总黄酮浓度为检测指标,绘制泄漏曲线,结果如图4所示。从图4中可知,1~5号收集管中随着流经大孔树脂的上样液增多,流出液中黄酮浓度不断增高,在5号管内即上样液达1.5倍柱床体积时泄漏量达上样液浓度的1/5,达到了泄漏点质量浓度。继续增加上样液体积,流出液中黄酮大量泄漏,且呈现不规则曲线,可能为上样量过多将部分大孔树脂堵塞,黄酮流经通路混乱所致。为避免上样量过大造成泄漏使得黄酮提取液的浪费,因此上样液体积确定为1.5 BV。
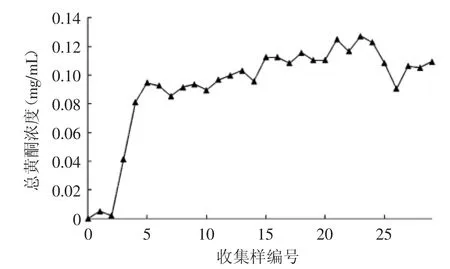
图4 黄酮吸附泄露曲线Fig.4 Flavonoid adsorption leakage curve
2.6 不同浓度乙醇洗脱液对大孔树脂洗脱的影响
2.6.1 乙醇梯度洗脱实验结果 分别用体积分数为20%、40%、60%、80%、95%乙醇溶液各50 mL的进行洗脱,测定其吸光值,按标曲计算得出各部分总黄酮含量分别为37.62%、33.38%、6.62%、6.07%、3.86%累积达到总上样量中黄酮的87.56%,当乙醇浓度为20%~60%时,吸附在大孔树脂上的黄酮被大量洗脱出来,洗脱率达到总洗脱量的88.66%,因此选取20%~60%乙醇洗脱液做重复实验以确定最适洗脱液乙醇浓度。
2.6.2 不同浓度乙醇洗脱液对总黄酮含量的影响
分别用乙醇浓度为20%、30%、40%、50%、60%的洗脱液对上样吸附后的大孔树脂柱进行洗脱,测定洗脱液吸光值,计算洗脱溶液总黄酮百分含量。由图5可见,随着洗脱液中乙醇浓度的增大,洗脱液中黄酮含量呈现先增大后减小的趋势,当乙醇浓度为40%时为最适洗脱液浓度,对总吸附黄酮的洗脱率达91.71%。推测原因可能为总黄酮中有部分为水溶性的,当乙醇浓度增大时,该部分水溶性黄酮未被充分洗脱出来,影响最终得率,因此,确定乙醇洗脱液浓度为40%。

图5 不同乙醇浓度洗脱液洗脱黄酮含量百分比Fig.5 Result of different ethanol concentration elution
2.7 不同体积洗脱液对总黄酮得率的影响
由图6可知,洗脱体积达45 mL后洗脱液中黄酮含量很少,可视为洗脱终点,累计洗脱黄酮总量95.59%,因此确定洗脱液体积为45 mL即3 BV。

图6 洗脱液不同体积黄酮含量曲线Fig.6 Concentration curve of different volume of elution
2.8 最佳工艺参数验证性实验
根据上述实验结果,按最佳工艺条件进行操作,取质量浓度为0.53 mg/mL的文冠果落果黄酮提取液
1.5 BV,调节pH为3.0,以3 BV/h流速上样,洗脱流速2 BV/h依次用去离子水2 BV清洗表面未吸附黄酮及杂质,40%乙醇水溶液3 BV进行洗脱。收集洗脱液,测定总黄酮的含量。浓缩干燥,并计算干粉中总黄酮的质量分数。重复实验3次,结果分别为44.97%、45.82%、46.58%,RSD值为1.76%,稳定性好。总黄酮含量由原冻干粉中270 mg/g提升为458 mg/g,质量分数由27.01%提升为45.79%(均值),HPD-400可以有效纯化文冠果落果总黄酮。
3 结论与讨论
通过对五种不同类型大孔树脂静态吸附、解吸性能的比较研究,筛选出了文冠果落果最适总黄酮分离纯化的树脂类型,即HPD-400,其静态饱和吸附量为15.82 mg/g,吸附率为66.89%,解吸率59.45%。经过对HPD-400型树脂动态吸附解吸条件的研究,确定了其对文冠果落果总黄酮最佳分离纯化条件:上样液浓度0.53 mg/mL,pH3.0,流速3 BV/h,上样体积1.5 BV,去离子水2 BV清洗表面除杂,洗脱液流速2 BV/h,乙醇洗脱液浓度40%,洗脱液体积3 BV。经大孔树脂纯化后,黄酮得到精制,由原来冻干粉中含量270 mg/g提升至纯化后的458 mg/g,纯度达45.79%,且重复实验3次结果稳定。
刘爱敬等用大孔树脂纯化黄秋葵黄酮后纯度为40.89%[22],胡月等用大孔树脂纯化费菜总黄酮得到产物纯度为47.98%[23],王晓琳等用大孔树脂法纯化锦灯笼宿萼总黄酮得到45.56%[24]。本研究中HPD-400型大孔树脂分离纯化文冠果落果总黄酮同比上述效果较好,且回收的树脂未变色残留物少,便于循环再生利用。目前市售银杏黄酮保健品中黄酮纯度为88.51 mg/g[25]而文冠果落果粗提总黄酮即为该标准3倍,直接可适用于黄酮保健品研发。经该工艺处理后文冠果落果总黄酮含量高纯度大,便于黄酮类单体物质的分离纯化,可为药用单体黄酮的制备提供一种新的便捷的材料。
[1]敖妍,段劼,于海燕,等.文冠果研究进展[J].中国农业大学学报,2012,17(6):197-203.
[2]万群芳,何景峰,张文辉.文冠果地理分布和生物生态学特性[J].西北农业学报,2010,19(9):179-185.
[3]申登峰.甘肃省文冠果产业发展分析[J].草业科学,2010,27 (5):157-160.
[4]马养民,张航涛,郭俊荣.文冠果种子油理化性质及脂肪酸组成[J].食品研究与开发,2010,31(4):100-102.
[5]万国盛,王晓波,吴立军,等.文冠果的化学成分及药理活性研究进展[J].中草药,2013,44(13):1842-1851.
[6]王颖,姜生,孟大利,等.文冠果的化学成分与生物活性研究进展[J].现代药物与临床,2011,26(4):269-273.
[7]郭影.文冠果果壳的化学成分研究[D].沈阳:辽宁中医药大学,2009.
[8]敖格日乐图,鞠爱华,肖志彬.蒙药文冠木的化学成分及临床应用的研究进展[J].中华中医药杂志,2009(6):769-771.
[9]徐东翔.文冠果落果机理及提高座果率和种子品质的研究[J].西北植物学报,1990(2):117-127.
[10]曾圣雅,周吉银.沙棘叶总黄酮的提取纯化方法概况[J].西部中医药,2015(3):136-139.
[11]CHPeter Hollman.Absorption,Bioavailability,and Metabolism of Flavonoids[J].Pharmaceutical Biology,2004(42):74-83.
[12]Miroslav Sisa,Bonnet Susan L.Photochemistry of Flavonoids [J].Molecules,2010(15):5196-5245.
[13]张汇慧,吴彩娥,范龚健,等.刺梨黄酮的精制及其抗氧化活性比较[J].南京林业大学学报:自然科学版,2015(3):101-105.
[14]吴珊,李小芳,罗佳,等.大孔树脂纯化山香圆叶中的总黄酮[J].华西药学杂志,2014,29(6):680-682.
[15]高彦华,罗玉琴,马庆苓,等.大孔吸附树脂富集纯化鹰嘴豆芽总异黄酮的工艺研究[J].中成药,2015,37(1):216-219.
[16]袁桥玉,刘新桥.大孔树脂纯化肺形草总黄酮工艺研究[J].中国中医药信息杂志,2015(3):94-97.
[17]焦岩.大果沙棘黄酮分离纯化及生物活性研究[D].哈尔滨:东北林业大学,2010.
[18]李容,蒋玉婷,罗莉娅,等.大孔吸附树脂纯化黄芩4种黄酮类成分的工艺研究[J].中药与临床,2015,6(2):47-50.
[19]魏旖琪,姚雷.皱皮木瓜中总黄酮分离纯化工艺[J].上海交通大学学报:农业科学版,2014,32(6):71-77.
[20]王晓林,钟方丽,薛健飞,等.AB-8型大孔树脂对锦灯笼宿萼总黄酮的富集工艺[J].北方园艺,2015(12):131-135.
[21]陈建真,季忆,陈彬.槐花散总黄酮大孔树脂分离纯化的工艺研究[J].中华中医药杂志,2015(7):2607-2609.
[22]刘爱敬,廖争争,郭琳,等.大孔树脂纯化黄秋葵黄酮及其体外抗氧化活性研究[J].食品工业科技,2015,36(16):284-288.
[23]胡月,王鸿飞,刘飞,等.费菜总黄酮分离纯化工艺的研究[J].食品工业科技,2014,35(17):213-216,221.
[24]王晓林,薛健飞,陈帅,等.大孔树脂法纯化锦灯笼宿萼总黄酮的工艺[J].食品科学,2014,35(14):58-61.
[25]熊冬梅,邓泽元,刘蓉,等.高效液相色谱法测定银杏保健品中总黄酮[J].食品科学,2009,30(22):256-259.
Purification of the total flavonoids from cast fruit of Xanthoceras sorbifolia Bunge by macroporous resin
SHI Guang-bo1,2,YANG Su-zhi3,LI Zheng-juan1,2,SUN Yi-jun1,2,LI Qing-ye1,2,ZHAO Xiao-rong1,2,LI Bo-sheng2,4,*
(1.College of Biological Sciences and Technology,Beijing Forestry University,Beijing 100083,China;2.Key Laboratory of Forestry Food Processing and Safety,Beijing Forestry University,Beijing 100083,China;3.Chifeng Research Institute of Forestry Science,Chifeng 100024,China;4.Institute of Spirulina,Beijing Forestry University,Beijing 100083,China)
In this study D101,AB-8,HPD-400,D001,X-5 five models of the macroporous resins were selected to compare their static adsorption ability of total flavonoids valued by spectrophotometry in purification of the total flavonoids from cast fruit of Xanthoceras sorbifolia Bunge.And the optimized one was used in the following dynamic adsorption tests.Result shows that HPD-400 was the best.The optimum purification technology was as follows:sample concentration of 0.53 mg/mL,sample pH3.0,sample volume of 1.5 BV,sample velocity of 3 BV/h,eluted with 2 BV deionized water and abandoned elute,then eluted with 3 BV 40%ethanol at the speed of 2 BV/h,and the elute was collected.The yield of total flavonoids was 45.79%.As a result HPD-400 macroporous resin with optimized conditions could purify the total flavonoids from the cast fruit of Xanthoceras sorbifolia Bunge effectively and with process stability.
cast fruit of Xanthoceras sorbifolia Bunge;total flavonoids;macroporous resin;static adsorption;dynamic adsorption
TS202.1
B
1002-0306(2016)08-0252-05
10.13386/j.issn1002-0306.2016.08.044
2015-10-22
石光波(1990-),女,硕士研究生,研究方向:天然产物开发与利用,E-mail:sgb90hou@163.com。
*通讯作者:李博生(1956-),男,教授,研究方向:螺旋藻综合开发利用,文冠果综合开发利用,E-mail:Libs7321@126.com。
林业公益性行业专项(201304605)。
