基于HiCapt Benzo固相萃取前处理的HPLC-FLD法检测油茶籽油中苯并(a)芘
2016-09-14李圣陶龚吉军中南林业科技大学食品科学与工程学院湖南长沙1000北海市农产品质量检测中心广西北海536000稻谷及副产物深加工国家工程实验室湖南长沙1000厦门出入境检验检疫局科学研究院福建厦门361026
李圣陶,龚吉军,吴 敏,唐 静(1.中南林业科技大学食品科学与工程学院,湖南长沙1000;2.北海市农产品质量检测中心,广西北海536000;3.稻谷及副产物深加工国家工程实验室,湖南长沙1000;.厦门出入境检验检疫局科学研究院,福建厦门361026)
基于HiCapt Benzo固相萃取前处理的HPLC-FLD法检测油茶籽油中苯并(a)芘
李圣陶1,2,龚吉军1,3,*,吴 敏4,唐 静1,3
(1.中南林业科技大学食品科学与工程学院,湖南长沙410004;2.北海市农产品质量检测中心,广西北海536000;3.稻谷及副产物深加工国家工程实验室,湖南长沙410004;4.厦门出入境检验检疫局科学研究院,福建厦门361026)
为了建立一种基于HiCapt Benzo固相萃取快速前处理的,更灵敏、准确的高效液相色谱-荧光检测法,以用于油茶籽油中苯并(a)芘的检测。油茶籽油样品以正己烷溶解后,用HiCapt Benzo专用固相萃取柱净化。检测条件为:LC-PAHs专用色谱柱;50%乙腈-50%水为流动相,流速1.0 mL/min;荧光检测器;外标法定量。研究结果表明,苯并(a)芘标准曲线在0.1~200 ng/mL范围内,线性关系好(R2=0.9993);检测限很低(0.0213~0.0246 μg/kg)。该法用于4个油茶籽油样品加标检测,回收率为93.06%~104.52%,相对标准偏差(RSD)为2.12%~3.98%。本文所建固相萃取-高效液相色谱(带荧光检测器)法前处理简单,结果准确可靠,是油茶籽油苯并(a)芘高效检测的适宜方法。
油茶籽油,苯并(a)芘,液相色谱,固相萃取,检测
采用传统方法制备的油茶籽油,因为制油过程中需经过高温焙炒,其中可能含有一定量的苯并(a)芘[B(a)P]。B(a)P是多环芳烃(PAHs)类化合物的典型代表,具有强烈的致癌性[1-3]。
目前测定食用植物油中B(a)P含量的国家标准方法有3种,包括荧光分光光度法(GB/T5009.27-2003)、目测比色法(GB/T5009.27-2003)和反相高效液相色谱法(GB/T22509-2008)。从操作步骤、耗时、毒害性等方面来看,3种方法均存在操作复杂、溶剂毒性大、费时、准确性差的问题[4]。
油茶籽油基体复杂,干扰因素多,且其B(a)P含量较低难以直接测定,通常需对样品进行净化和预浓缩处理,使之达到色谱分析的要求[5]。SPE前处理净化技术,具有溶剂使用量少、操作简便快速、选择性高、重现性好等优点,常与HPLC联用以定量检测食品中B(a)P[6-10]。史海良[11]采用SPE-HPLC-FLD检测方便面中的B(a)P,具有良好的灵敏度和精密度。Yang等[12]采用SPE-HPLC法检测了几种食用油(不含茶油)和油脂产品中的B(a)P,也取得了满意的效果。油茶籽油与其他食用油的成分有差异,与食品类的差异更大,将SPE-HPLC-FLD法用于油茶籽油中B(a)P的检测,其参数亟待探明,但迄今为止,还未见有关研究报道。
本文以HiCapt Benzo专用固相萃取柱对油茶籽油进行前处理,采用LC-PAHs专用液相色谱柱,旨在建立一种简便、高效,且能精确定量检测油茶籽油中B(a)P的HPLC-FLD法,以期为油茶籽油生产与市场监管中B(a)P的高效检测提供参考。
1 材料与方法
1.1 材料与仪器
压榨油茶籽毛油、浸提油茶籽毛油、油茶籽脱酸油 在实验室自制;1~10号品牌市售油茶籽油 购于沃尔玛超市;B(a)P标准品 Dr.Ehrensterfer公司;正己烷、甲醇、乙腈、乙酸乙酯、丙酮 Tedia公司,均为色谱纯(AR)。
Agilent 1200高效液相色谱仪 配荧光检测器(FLD),美国安捷伦公司;LC-PAHs色谱柱(25 cm×4.6 mm ID,Supelcosil TM 5 μm) 美国Supeleo;固相萃取装置(Large Volume Sample) 美国Supeleo;Vortex-Genie 2漩涡混合器 美国Scientific Industries;TurboVapÒ LV氮气吹扫装置 美国Biotage;TDL-80-2B离心机 上海安亭科学仪器厂;HiCapt Benzo固相萃取柱 维泰克科技(武汉)有限公司;C18柱、碱性氧化铝柱 博纳艾杰尔科技;硅胶柱、弗罗里柱 德国Simon Aldrich。
1.2 实验方法
1.2.1 标准溶液制备 用甲醇将l mL的B(a)P标液稀释成1 mg/L的标准储备液,用密封带密封,贮存于4℃冰箱中待用。
1.2.2 样品前处理
1.2.2.1 提取 称取0.5 g油茶籽油样品,置于50 mL聚丙烯离心管中,取3 mL正己烷溶解,涡旋1 min混均,加入2 mL超纯水,再涡旋1 min,4000 r/min离心3 min,取上层溶液2 mL,待净化。
1.2.2.2 净化 采用12孔真空固相萃取装置进行样品的净化。包括活化、上样、淋洗和洗脱4个步骤。活化:在固相萃取柱中依次加入5 mL丙酮、2 mL正己烷进行活化;上样:以1.2.2.1中的提取液上样,上样量2 mL,流速1 mL/min;淋洗:待上样液完全流出后,用3 mL乙酸乙酯与正己烷的混合液[1∶4(v/v)]淋洗,淋洗液弃去,将小柱抽干;洗脱:用3 mL丙酮洗脱,流速2.0 mL/min,收集洗脱液,先于50℃下用氮吹干,再加0.5 mL甲醇涡旋溶解,定容至1 mL,装入进样瓶,待分析。
1.2.3 仪器条件 检测仪器:LC-FLD(Agilent 1200);色谱柱:LC-PAHs专用液相色谱柱(25 cm×4.6 mm ID,SupelcosilTM 5 μm);进样量10 μL;柱温30℃;流动相:50%乙腈-50%水,流速:1.0 mL/min。
检测器:荧光检测器,荧光条件参考国家标准《GB/T 24893-2010动植物油脂多环芳烃的测定》,时间29.20 min,激发波长(Ex)270 nm,发射波长(Em)324 nm。
1.2.4 B(a)P标准曲线绘制 使用标准贮备液依次稀释制备0.1、0.2、0.5、1.0、2.0、5.0、10、50、100、200 ng/mL 10个不同浓度的B(a)P甲醇标准液,采用1.2.3的仪器条件上机,以样品的保留时间定性,以积分面积与含量比值定量,建立线性回归方程,确定相关系数及检出限。
1.2.5 B(a)P固相萃取柱的选择 分别用C18柱、硅胶柱、弗罗里硅土柱、碱性氧化铝柱以及HiCapt Benzo固相萃取柱吸附0.5 mL浓度为10 μg/L的B(a)P甲醇标准溶液,重复3次,采用与1.2.2中相同的方法用丙酮洗脱固相萃取柱、浓缩定容后,上机分析,以回收率反映不同固相萃取柱对B(a)P的吸附效果。
在1.2.2.1中,提取茶籽油中B(a)P用了3 mL正己烷进行液液萃取,在1.2.2.2中净化上样时用了2 mL收集的萃取液,所以修正后实际回收率的计算公式为:
回收率(%)=(W1×3/2-W0×3/2)/Z×100
其中:W1为加标样品测定值,μg/kg;W0为空白样品测定值,μg/kg;Z为加标量,μg/kg。
1.2.6 固相萃取洗脱剂的选择 分别用甲醇、乙腈、丙酮和二氯甲烷作为洗脱溶剂,以B(a)P回收率为考察指标,比较在同样的洗脱溶剂体积下,不同洗脱剂对B(a)P的洗脱效果。
1.2.7 固相萃取洗脱剂最佳用量的确定 为考察B(a)P合适的洗脱溶剂量,在2 mL(10 μg/L)B(a)P标准工作液上样过柱后,以5 mL优选的洗脱剂进行洗脱,每次加1 mL,分5次进行。在控制洗脱速度为1 mL/min的情况下,比较使用1、2、3、4、5 mL洗脱剂进行洗脱时B(a)P的回收率,以确定优选洗脱剂的最佳用量(mL)。
1.2.8 不同精炼程度油茶籽油B(a)P加标回收率测定和市售样品的检测 取0.50 g自制压榨油茶籽毛油、浸提油茶籽毛油、油茶籽脱酸油和某一品牌油茶籽油样品各6份,置于25 mL聚丙烯离心管中,在其中3份油茶籽油样品中加入500 μL(10 μg/L)B(a)P标
准工作液,振荡混匀,另外3份作为空白对照。经前处理后上机检测。
同时,选择10种不同品牌市售油茶籽油样品,对其B(a)P含量进行检测,每个样品重复测定3次。
1.2.9 数据分析 采用SPSS 18.0软件进行统计分析。
2 结果与分析
2.1 B(a)P标准曲线绘制
B(a)P标准曲线见图1。由图1可见,在0.1~200 ng/mL范围内,B(a)P标准曲线的回归方程为y=3.2051x+4.7649,相关系数R2=0.9993,检出限为0.0213~0.0246 μg/L,明显低于汤富斌等[13]所建方法的检出限(0.2 μg/kg),说明该方法对B(a)P检测的灵敏度高。10 μg/L的B(a)P标样的液相色谱图见图1,B(a)P单标检测色谱图见图2。

图1 苯并(a)芘标准曲线Fig.1 The standard calibration curve of B(a)P standard

图2 苯并(a)芘单标检测色谱图Fig.2 Chromatogram of B(a)P standard
2.2 固相萃取柱的选择

表1 比较不同固相柱的平均回收率(n=3)Table1 Recoveries of B(a)P of different SPE column(n=3)
分别采用C18柱、硅胶柱(Silica)、弗罗里硅土柱(Florisil)、碱性Al2O3柱以及HiCapt Benzo专用固相萃取柱对B(a)P进行吸附,其回收率测定结果见表1。结果表明,5种固相萃取柱对B(a)P吸附的回收率均存在显著差异(p<0.05),说明不同固相萃取柱对B(a)P吸附作用有明显差异。其中HiCapt Benzo苯并芘固相萃取柱的回收率最高,达到了92.28%,C18柱的回收率次之,为88.45%,Florisil柱和Silica柱的回收率则分别为85.64%和82.78%,而碱性氧化铝柱的回收率最低,仅为53.58%。可见,最佳固相萃取柱为HiCapt Benzo。
2.3 固相萃取洗脱剂的选择
同样洗脱剂体积,不同洗脱剂对B(a)P的洗脱效果见图3。由图3可见,采用丙酮和二氯甲烷作为洗脱剂的回收率要显著高于以甲醇和乙腈作为洗脱剂的回收率(p<0.05),表明丙酮和二氯甲烷对B(a)P的洗脱能力较强,但二氯甲烷洗脱剂的基质干扰对检测结果影响较大,所以最终选择丙酮作为洗脱剂。

图3 不同洗脱剂的回收率Fig.3 Recoveries of B(a)P with different elution solvents
2.4 固相萃取洗脱剂最佳用量的确定
不同体积丙酮洗脱B(a)P的回收率见表2。由表2中可见,用3~5 mL丙酮洗脱,与用1~2 mL丙酮洗脱相比,其回收率存在极显著差异(p<0.01),用3 mL丙酮洗脱的平均回收率明显高于用1~2 mL丙酮洗脱的回收率。而用4~5 mL丙酮洗脱的回收率与3 mL丙酮洗脱的回收率相比,差异不显著(p>0.05),因此,从节省溶剂和减少环境污染的角度来考虑,丙酮的最佳用量为3 mL。
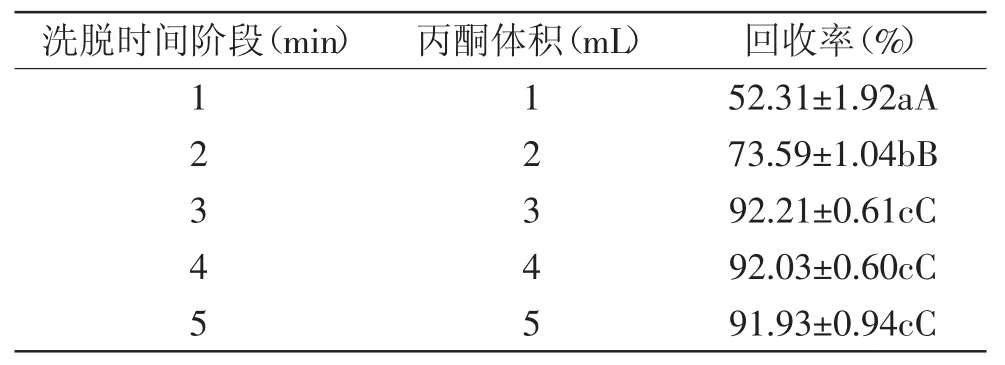
表2 不同体积丙酮洗脱苯并(a)芘的回收率(n=3)Table2 Recoveries of B(a)P with different volume of C3H6O cleaning(n=3)
2.5 不同精炼程度油茶籽油B(a)P加标回收率测定和市售样品的检测
2.5.1 不同精炼程度油茶籽油B(a)P加标回收率测
定 不同精炼程度的油茶籽油样品加标回收率测定结果见表3。压榨油茶籽毛油、浸提油茶籽毛油、油茶籽脱酸油和某市售商品油样品的加标回收率分别为104.52%、93.06%、98.12%、96.27%。而黄翠莉等[4]用反相高效液相色谱法测定油茶籽油中B(a)P的含量,其平均回收率为93.8%,低于本文所建方法的部分测定结果。油茶籽油样品中B(a)P加标量为10 μg/kg时,除了市售某品牌油茶籽油外,其加标回收率明显高于Brockmann氧化铝活度测定法(GB/T22509-2008)采用相同加标量时的实验室间比对结果(8.840± 0.498)μg/kg[14],说明本文所建B(a)P检测方法的精密度高于国标方法,提示本文所建方法具有很高的实用价值。

表3 不同精炼程度油样B(a)P加标回收率(n=3)Table3 Recoveries of B(a)P in different extent refining COASO(n=3)
2.5.2 对10种市售油茶籽油中B(a)P含量的检测 为了进一步检验本文所建立B(a)P检测方法的可靠性,对10种不同品牌油茶籽油中B(a)P含量进行了检测,并同时采用国标方法(GB/T 22509-2008)进行了检测,对比结果见表4。8号油样采用两种方法均未检出B(a)P。采用本文所建方法,其他油脂检出值在0.9464~6.0185 μg/kg,其中6号样的检出量最高,达到6.0185 μg/kg,其次为2号样,检出量为5.3638 μg/kg。统计分析结果表明,两种检测方法的检出结果并无显著差异(p>0.05),说明本文所建方法可靠,但从检出结果的标准差来看,采用国标方法均高于本文所建方法,说明本文所建方法的检测稳定性稍好。检测结果表明,所选的市售10种品牌油茶籽油除8号可能含量极低而无法检出外,其他均含有一定量的B(a)P,但均未超出国家标准(<10 μg/kg),同时也证明,本文所建方法可用于市售产品的检测。
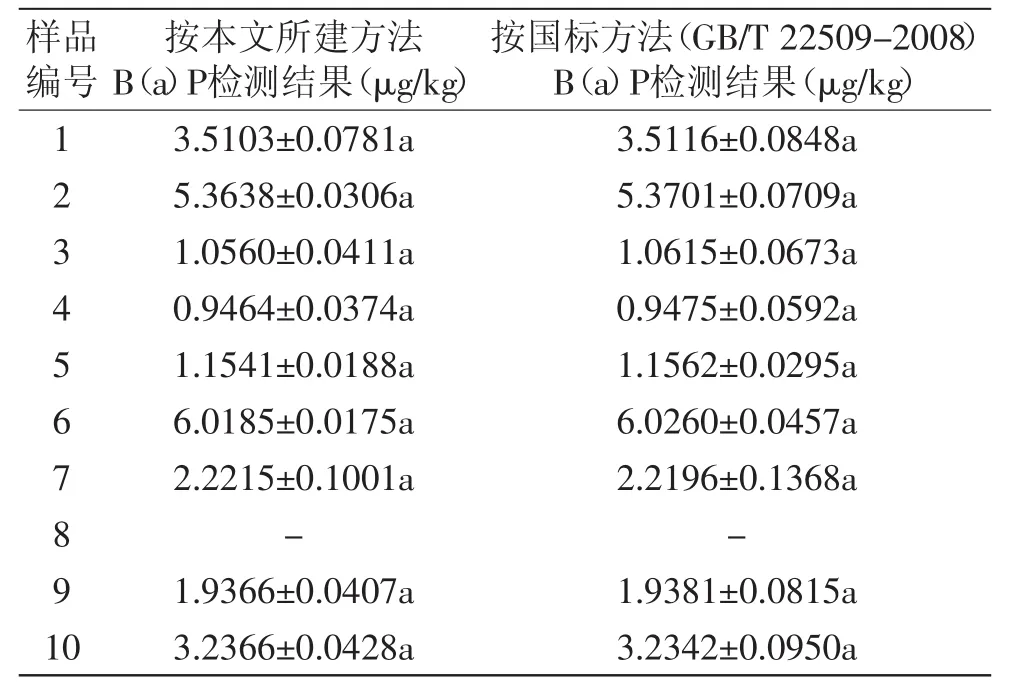
表4 市售10种品牌油茶籽油B(a)P检测结果(n=3)Table4 The contents of B(a)P in 10 brands of COASO(n=3)
3 结论
采用HiCapt Benzo固相萃取柱,以3 mL丙酮为洗脱剂,流速为1 mL/min,对油茶籽油进行净化前处理,其对B(a)P萃取的回收率达到92.28%,显著高于其他所测固相萃取柱。
将SPE前处理技术与HPLC-FLD结合,本文建立了一种油茶籽油B(a)P的高效检测方法,在0.1~200 ng/mL范围内,其检出限为0.0213~0.0246 μg/kg,相关系数(R2)为0.9993,相对标准偏差(RSD)为2.12%~3.98%,加标回收率为93.06%~104.52%,与现行国标方法(GB/T 22509-2008)相比,其前处理步骤简化、加标回收率更高,具有很高的实用价值。
[1]Skarek M,Janosek J,Cupr P,et al.Evaluation of genotoxic and non-genotoxic effects of organic air poliution using in vitro bioassays[J].Environment International,2007,33(7):859-866.
[2]王欣,周智慧,赵晓联.苯并(a)芘危害性及其检测技术[J].粮食与油脂,2011(3):48-49.
[3]李永红,金银龙.苯并(a)芘致癌机制研究新进展[J].医学研究杂志,2011,40(8):152-154.
[4]黄翠莉,吴苏喜,王力清,等.油茶籽油中苯并(a)芘快速检测方法研究[J].食品工业科技,2012,33(2):64-66.
[5]汪东卫.新型吸附材料在样品前处理技术中的应用研究[D].重庆:西南大学,2009.
[6]牟钧.固相萃取-高效液相色谱法测定食品中的苯并(a)芘[J].粮油食品科技,2011,19(3):42-44.
[7]王广会,许喜林,郭海英.高效液相色谱法测定芝麻油中的苯并(a)芘含量[J].现代食品科技,2011,27(12):1545-1547.
[8]林慧,颜春荣,徐春祥.固相萃取-高效液相色谱法测定肉制品中苯并(a)芘[J].肉类研究,2012,26(6):24-27.
[9]Lage Yusty M A,Cortizo Daviña J L.Supercritical fluid extraction and high-performance liquid chromatography-fluorescence detection method for polycyclic aromatic hydrocarbons investigation in vegetable oil[J].Food Control,2005,16(1):59-64.
[10]Husam A,Sameer A,Suad A,et al.Concentrations and dietary exposure to polycyclic aromatic hydrocarbons(PAHs)from grilled and smoked foods[J].Food Control,2011,22(12):2028-2035.
[11]史海良.固相萃取-高效液相色谱-荧光检测方便面中的苯并(a)芘[J].食品工业科技,2013,43(8):65-67.
[12]Yang Y Y,Wang H,Liu T,et al.Determination of benzo(a)pyrene residues in edible oil and oil products by high performance liquid chromatography with dispersive solid phase extraction[J].Chinese Journal of Analytical Chemistry,2014,42(9):1387-1388.
[13]汤富彬,莫润宏,钟冬莲,等.皂化提取-高效液相色谱法测定油茶籽油中苯并(a)芘残留[J].中国油脂,2012,37(2):62-64.
[14]GB/T 22509-2008,动植物油脂苯并(a)芘的测定[S].
A detection method over benzo(a)pyrene in Camellia oleifera Abel seed oil by HPLC-FLD based on HiCapt Benzo solid-phase extraction pretreatment
LI Sheng-tao1,2,GONG Ji-jun1,3,*,WU Min4,TANG Jing1,3
(1.College of Food Science and Engineering,Central South University of Forestry and Technology,Changsha 410004,China;2.Quality Inspection Center of Agricultural Products of Beihai City,Beihai 536000,China;3.National Engineering Laboratory for Rice and Byproducts Processing,Changsha 410004,China;4.Institute,Xiamen Entry-Exit Inspection and Quarantine Bureau,Xiamen 361026,China)
This study was aimed to establish a highly efficient method of high-performance liquid chromatography with fluorescence detection(HPLC-FLD)based on HiCapt Benzo solid-phase extraction time-saving pretreatment for benzo(a)pyrene[B(a)P]detection in Camellia oleifera Abel seed oil(COASO).Samples of COASO were dissolved in hexane,and purified by HiCapt Benzo solid phase extraction(SPE)column.The detection conditions were as followings:LC-PAHs chromatographic column,50% acetonitrile-50%pure water as mobile phase,flow rate 1.0 mL/min,fluorescence detector,quantification by external standard method.The results showed that standard calibration curve was linear over the concentration range of 0.1~200 ng/mL,with the regression efficiency (R2)of 0.9993.Furthermore,the detection limit was 0.0213~0.0246 μg/kg.A recovery range of 93.06%~104.52% and a relative standard deviation(RSD)range of 2.12%~3.98%was exhibited when the method was employed to detect four samples of COASO added with[B(a)P]standand.It was suggested that this detection method of SPE-HPLC-FLD established in the study was a suitable one for[B(a)P]detection in COASO,for its obvious advantages,such as simpler pretreatment,more sensitive and more efficient.
Camellia oleifera Abel seed oil(COASO);B(a)P;high-performance liquid chromatography;solid phase extraction;detection
TS227
A
1002-0306(2016)08-0077-04
10.13386/j.issn1002-0306.2016.08.007
2015-08-19
李圣陶(1986-),男,硕士研究生,研究方向:食品质量与安全,E-mail:349065553@qq.com。
*通讯作者:龚吉军(1972-),男,博士,教授,研究方向:食品质量与安全,食品天然保鲜剂,E-mail:jijungong2007@163.com。
湖南省科技计划项目(2014NK3054);粮油深加工与品质控制湖南省2011协同创新中心开放课题(湘教通[2013]448号);中南林业科技大学“十二五”专业综合改革试点项目(2013-6);国家质检总局科技计划项目(2012IK192)。
