溶藻弧菌实时荧光定量PCR快速检测方法的建立
2016-09-14李丹丹徐义刚李梦圆邱索平高会江高慎阳海南出入境检验检疫局检验检疫技术中心海南海口70东北农业大学动医学院黑龙江哈尔滨000从化出入境检验检疫局广东广州0900重庆出入境检验检疫局检验检疫技术中心重庆000中国农业科学院北京畜牧兽医研究所牛遗传育种研究室北京009辽宁医学院畜牧兽医学院辽宁锦州200
李丹丹,徐义刚,李梦圆,王 昱,邱索平,高会江,高慎阳(.海南出入境检验检疫局检验检疫技术中心,海南海口70;2.东北农业大学动医学院,黑龙江哈尔滨000;.从化出入境检验检疫局,广东广州0900;.重庆出入境检验检疫局检验检疫技术中心,重庆000;.中国农业科学院北京畜牧兽医研究所牛遗传育种研究室,北京009;.辽宁医学院畜牧兽医学院,辽宁锦州200)
溶藻弧菌实时荧光定量PCR快速检测方法的建立
李丹丹1,徐义刚2,*,李梦圆3,王 昱4,邱索平3,高会江5,高慎阳6
(1.海南出入境检验检疫局检验检疫技术中心,海南海口570311;2.东北农业大学动医学院,黑龙江哈尔滨150001;3.从化出入境检验检疫局,广东广州510900;4.重庆出入境检验检疫局检验检疫技术中心,重庆404100;5.中国农业科学院北京畜牧兽医研究所牛遗传育种研究室,北京100193;6.辽宁医学院畜牧兽医学院,辽宁锦州121001)
为建立溶藻弧菌(VA)的快速检测方法,本研究以VA Collagenase基因为靶基因设计合成引物及TaqMan探针,建立了实时荧光定量PCR快速检测VA的方法。结果显示,对15株实验菌株进行荧光定量PCR检测,只有VA菌株检测为阳性,表明该检测方法特异性强;该方法的灵敏度为18 cfu/mL;稳定性和重复性实验结果表明,同一样品重复检测4 次Ct值的变异系数均小于2%;利用该检测方法对采集的165份样品进行检测,共计检出2份VA阳性样品,与SN/T 2564-2010行标法检测结果一致,显示了良好的实用性。该检测方法灵敏度高、特异性强,具有良好的实用性。
溶藻弧菌,Collagenase基因,实时荧光定量PCR
溶藻弧菌(Vibrio alginolyticus,VA)是一种革兰氏阴性嗜盐菌,在海水养殖的牡蛎、虾和蟹等贝类、甲壳类水生动物中分布广泛,是流行程度、危害程度较高的食源性致病菌之一[1-3],人类进食被VA污染的食品能够引起急性胃肠炎,严重者还可引起败血症[4-6]。因此,建立快速并且准确的检测方法对防止VA的感染和提高VA的检测效率具有重要意义。
目前,包括我国在内的绝大多数国家针对溶藻弧菌的检测仍主要依靠传统细菌分离鉴定的方法。该方法存在检测效率低、灵敏度低且耗时长、操作繁琐等不足。通常情况下,鉴定一种细菌需要一周的时间,而针对一些生化特性复杂的细菌,如单增李斯特氏菌的检测周期可长达10 d之久[7],严重影响了检测效率,很难满足现代化食品安全快速检测的需要。LAMP法,是近年来刚刚兴起的一种检测方法,在某种程度上提高了检测效率,降低了检测成本;PCR技术在病原体核酸检测方面应用广泛,灵敏度和特异性都比较高,但是LAMP和PCR这两种检测方法都存在着假阳性率比较高的问题[8]。相对而言,实时荧光PCR技术不仅具有灵敏、快速、简便等优点,与常规PCR方法相比,特异性、灵敏度都更强、自动化程度更高,无需对PCR扩增产物进行后处理,有效地解决了PCR产物易污染造成的假阳性和不能准确定量的问题。该项技术已发展成为一种较成熟的分子生物学快速检测技术,目前国内的科研和检测机构都配备了实时荧光PCR检测仪,并为广大用户所接受,应用于实际检测工作中[9]。
实时荧光定量PCR方法实现了实时在线检测,精准度、灵敏度和特异性均高于常规PCR检测方法,同时适用范围广泛,目前已经成为一种常用的分子生物学检测技术[10-12]。本研究利用该技术,建立了VA实时荧光定量PCR快速检测方法,为快速准确检测VA提供有力的技术支持。
1 材料与方法
1.1 材料与仪器
空肠弯曲菌、肠出血性大肠埃希菌O157∶H7、单核细胞增生李斯特菌、沙门氏菌、变形杆菌、阪崎肠杆菌、粘质沙雷菌、创伤弧菌、志贺菌、金黄色葡萄球菌、产肠毒素大肠杆菌、小肠结肠炎耶尔森氏菌、肠侵袭性大肠杆菌、霍乱弧菌和溶藻弧菌等标准菌株 购自美国典型菌种保藏中心;165份水产品 来自于水产品养殖场和水产品流通市场,包括20份虾、15份蟹、15份海水、15份蛏子、15份鲍鱼、10份海鱼、15份蛤蜊、10份泥螺、10份花蛤、10份海虹、20份海瓜子、10份象拔蚌等水产品。
细菌培养基和增菌培养基BPW 均购自广东环凯微生物科技有限公司;细菌基因组DNA抽提试剂盒 购自北京康为世纪生物科技有限公司;Taq DNA聚合酶、dNTP、MgCl2均购自宝生物工程大连有限公司;ABI 7500 Real-time PCR仪 美国ABI公司;PRO 200型精密匀浆器 美国PRO公司。
1.2 实验方法
1.2.1 引物、探针设计 根据GenBank公布的VA Collagenase基因序列(DQ097161.1)中的保守序列,利用Oligo 6.0软件设计特异性检测引物和TaqMan探针各一对,均由上海生工生物工程技术服务有限公司合成。
引物序列:F:GAGCTTTCTGTTGAATGTAACGA CAC
R:ACCCACACGCTCCATTGC
探针序列:Fam-TCTCTGCAAACTCAGACGCAA GCGTAGG-TAMRA
1.2.2 DNA模板的制备 1.1节中的菌株分别接种到5 mL增菌培养基BPW中,增菌培养12 h后,取1 mL菌液按照试剂盒说明书提取细菌基因组DNA,-20℃保存备用。临床样品的检测采用煮沸法提取细菌DNA。
1.2.3 荧光定量PCR反应条件优化 PCR反应体系25 μL:rTaq酶(5 U/μL)用量范围0.25~1.00 μL,以0.25 μL递增;Mg2+(25 mmol/μL)用量范围2.00~5.00 μL,以每0.50 μL递增;dNTP(2.5 mmol/μL)用量范围1.00~3.00 μL,以0.50 μL递增;探针(20 μmol/μL)用量范围0.10~0.50 μL,以每0.10 μL递增;引物(10 pmol/μL)的用量范围0.50~1.00 μL,以0.10 μL递增。
PCR反应程序:95℃预变性3 min;95℃变性5 s,60℃退火20 s(此步骤收集荧光信号),进行40个循环,在每个循环的退火延伸阶段收集荧光信号,每次实验均包括阴性对照。
1.2.4 荧光定量PCR特异性检测实验 采用试剂盒法对1.1节中的菌株进行基因组DNA的提取,利用建立的实时荧光定量PCR方法进行检测,验证方法的特异性。
1.2.5 荧光定量PCR灵敏性检测实验 提取VA基因组DNA并测定浓度,10倍倍比稀释DNA,原液至10-1~10-7,每个浓度梯度设4个平行,根据试剂盒提取每级稀释度细菌DNA,各取2.00 μL作为模板进行实时荧光定量PCR检测。
1.2.6 稳定性和重复性实验 取3个不同浓度的样品作为模板进行重复性实验,每个浓度做3个平行,重复4次。收集数据,计算组内、组间变异系数,评价实验的稳定性和重复性。
1.2.7 荧光定量PCR检测方法的初步应用 将采集来的165份水产品经过匀浆器处理匀浆后,均用营养肉汤增菌培养6 h,增菌液煮沸法提取DNA并进行实时荧光定量PCR检测,所得检测结果用行标法(SN/T 2564-2010)进行复检,以验证所建立的实时荧光定量PCR检测方法的可靠性。
2 结果与分析
2.1 VA实时荧光PCR检测方法的建立
通过对实时荧光PCR反应体系中各项反应条件的优化,最终确定了VA最佳实时荧光PCR反应模式。在25 μL反应体系中含有:rTaq酶(5 U/μL)0.50 μL,Mg2+(25 mmol/μL)2.50 μL,dNTP(2.5 mmol/μL)2.00 μL,探针(20 μmol/μL)0.30 μL,上、下游引物浓度(10 pm/μL)1.00 μL,DNA模板2.00 μL,去离子水补充至25 μL。利用建立的方法对VA进行检测,结果如图1所示,获得了最低的Ct值和较高的荧光强度增加值,表明所建立的检测方法能够应用于对VA的检测。

图1 VA实时荧光PCR检测方法的建立Fig.1 Development of a dual real-time PCR reaction system
2.2 特异性实验检测结果
利用建立的实时荧光PCR检测方法对1.1节中的菌株进行扩增,结果显示:VA标准菌株扩增后出现了典型的扩增曲线,判定为阳性;而其他菌株和空白对照则出现平直的线或者是不规则曲线,判定为阴性(如图2)。
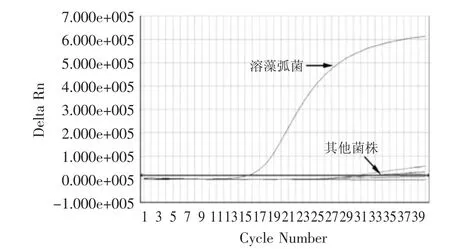
图2 VA实时荧光PCR方法特异性结果Fig.2 Specificity of a dual real-time PCR reaction system
2.3 灵敏度检测实验结果
10倍系列稀释菌液按试剂盒提取每级稀释度细菌DNA,按2.1优化出的实时荧光PCR反应条件进行检测,结果表明在25 μL反应体系中,模板DNA加入2 μL,菌体浓度自1.80×107cfu/mL至1.80×101cfu/mL均可出现规则的、典型的扩增曲线,菌体浓度为1.80×100未出现扩增曲线(图3),表明本研究建立的实时荧光PCR方法检测VA灵敏度为18 cfu/mL。
2.4 稳定性和重复性实验
选取1.80×106、1.80×104、1.80×102cfu/mL 3个浓度的阳性模板进行组内和组间重复性实验,计算出组内和组间Ct值的变异系数分别为0.32%~1.24%、0.29%~0.85%(表1),均小于2%,表明该方法具有很好的稳定性和重复性。

表1 实时荧光PCR的稳定性和重复性实验Table1 The stability and reproducibility test of real-time PCR

图3 VA实时荧光PCR检测灵敏度Fig.3 Sensitivity of a dual real-time PCR reaction system
2.5 实时荧光PCR检测临床样品的实验结果
利用建立的VA实时荧光定量PCR检测方法对165份样本进行了检测,检出2份VA阳性样本,所得检测结果经行标法[13]进行复检,两种方法检测结果的一致率为100%,显示该方法具有很好的应用性。
3 结论与讨论
针对检测靶基因的选择,胶原蛋白酶(Collagenase)是一种胞外酶,可能对VA的毒力有影响,经毒力评价后的VA利用实时荧光定量PCR方法对Collagenase基因的表达量进行了测定,结果显示其表达量与毒力大小具有相关性[14]。因此本研究选择VA的Collagenase基因为靶基因,建立了VA实时荧光定量PCR快速检测方法,确立了实时荧光定量PCR检测的最佳反应条件。利用建立的检测方法对15种不同菌株进行检测,结果只有VA菌株出现典型的扩增曲线,为阳性;而其他菌株未出现扩增曲线,为阴性;说明本研究所建立的检测方法具有很好的特异性。10倍系列稀释菌液按试剂盒提取每级稀释度细菌DNA作为模板进行实时荧光定量PCR检测,原始菌液稀释至10-6时仍能检出,说明本方法具有很高的灵敏度。组内和组间Ct值的变异系数分别为0.32%~1.24%、0.29%~0.85%,均小于2%,表明该方法具有很好的稳定性和重复性;对165份临床样本进行了检测,检出2份VA阳性样本,所得检测结果经行标法[13]进行复检,两种方法检测结果的一致率为100%。
综上所述,本研究所建立的实时荧光定量PCR检测方法为VA快速精准的检测提供了可靠的技术手段,适合在检验检疫系统内、食品安全监管及食品加工等部门推广应用。
[1]刘志刚,张其中,张占会,等.近江牡蛎HSC70基因对溶藻弧菌感染的反应[J].中国水产科学,2012,19(3):500-508.[2]Doyle M P.Food borne bacterial pathogens[M].New York:Marcel Dekker Inc,1989:552-554.
[3]Altekruse S F,Bishop R D,Baldy L M,et al.Vibrio gastroenteritis in the US Gulf of Mexico region:the role of raw Ostrea[J].Epidemiol Infect,2000,124:489-495.
[4]李毅,马雪莲,章乐怡,等.食品污染物中致病性弧菌污染情况调查分析[J].中国卫生检验杂志,2010,20(2):381-382.
[5]熊盼,彭喜春,魏霜,等.溶藻弧菌的毒力相关基因及其对小鼠的致病力[J].微生物学报,2014,54(1):80-88.
[6]陈强,鄢庆枇,马牲.溶藻弧菌致病性研究进展[J].海洋科学,2006,30(8):83-89.
[7]Zhang XH,Austin B.Haemolysins in Vibrio species[J].Journal of Applie Microbiology,2005,98(1):1011-1019.
[8]王琪,滕勇勇,何仕雯.多重PCR快速检测5种重要致病性弧菌[J].中国卫生检验杂志,2014,24(12):3497-3500.
[9]李富威,张舒亚,任硕.鳕鱼成分的实时荧光PCR检测方法[J].中国生物工程杂志,2012,32(12):80-85.
[10]张宇,白豆,朱乃硕.Taqman多重实时荧光定量PCR检测裸鼠肿瘤转移模型中肿瘤转移率方法的建立[J].中国生物工程杂志,2015,35(4):66-73.
[11]Thompson F L,Iida T,Swings J.Biodiversity of Vibrios[J].Microbiology and Molecular Biology Reviews,2004,68:403-431.
[12]宋丽萍,薛晨玉,路勇,等.应用实时荧光PCR技术定量检测羊肉中的猪肉成分[J].食品科技,2014,39(10):319-322.
[13]SN/T 2564-2010水产品中致病性弧菌检测MPCR-DHPLC法[S].
[14]韩佳丽.溶藻弧菌毒力相关基因的检测与保藏方法的研究[D].广东:广东海洋大学,2011.
Development of a dual real-time PCR for the rapid detection of Vibrio alginolyticus
LI Dan-dan1,XU Yi-gang2,*,LI Meng-yuan3,WANG Yu4,QIU Suo-ping3,GAO Hui-jiang5,GAO Shen-yang6
(1.Technical Center of Hainan Entry-exit Inspection and Quarantine Bureau,Haikou 570311,China;2.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150001,China;3.Conghua Entry-exit Inspection and Quarantine Bureau,Guongzhou 510900,China;4.Technical Center of Chongqing Entry-exit Inspection and Quarantine Bure,Chongqing 404100,China;5.Laboratory of Bovine Genetics and Breeding,Institute of Animal Science,Chinese Academy of Agricultural Sciences,Beijing 100193,China;6.Department of Animal Husbandry and Veterinary Medicine,Liaoning Medical University,Jinzhou 121001,China)
To establish a rapid assay for Vibrio alginolyticus(VA)detection,a dual real-time PCR method was developed targeting Collagenase gene of VA.The results showed that the test for 15 bacteria strains of the dual real-time PCR method,only VA test was positive,indicating that the method had high specificity.In addition,the sensitivity of a dual real-time PCR was 18 cfu/mL.Stability and reproducibility of the test results showed that the coefficient of variation of the same sample repeat the test four times Ct values were less than 2%.Furthermore,a total 2 positive samples for VA were detected from 165 clinical samples by the real-time method,which was in accordance with the testing result by SN/T 2564-2010 standard detection protocol.Therefore,the real-time method provides a novel rapid and sensitive detection method for VA infection.
VA;Collagenase gene;real-time PCR
TS207.4
A
1002-0306(2016)08-0069-04
10.13386/j.issn1002-0306.2016.08.005
2015-09-14
李丹丹(1979-),女,博士,高级兽医师,研究方向:微生物学与免疫学研究,E-mail:108074182@qq.com。
*通讯作者:徐义刚(1978-),男,博士,教授,研究方向:微生物学与免疫学研究,E-mail:esta123@126.com。
海南省社会发展科技专项(2015SF29);国家质检总局科技项目(2013IK031,2013IK051,2015IK089);重庆市科技计划项目(cstc2014yykfA80017);海南省应用技术研究与开发专项项目(ZDXM20130025);广东检验检疫局科技计划项目(2011GDK44,2013GDK04)。
