SSA/Ro60自身抗原的基因克隆与表达纯化*
2016-09-14牛广华高玉洁
牛广华,张 程,吕 丹,高玉洁
(辽宁中医药大学附属医院,沈阳 110032)
SSA/Ro60自身抗原的基因克隆与表达纯化*
牛广华,张程△,吕丹,高玉洁
(辽宁中医药大学附属医院,沈阳 110032)
目的克隆人SSA/Ro60自身抗原并表达纯化,为辅助诊断自身免疫提供物质基础。方法采用RT-PCR技术扩增SSA/Ro60基因,定向插入pPICZ表达载体,转入毕赤酵母表达系统,将获得的重组蛋白行SDS-PAGE和Western blotting鉴定。结果扩增出约1.5 kb的SSA/Ro60全长序列,获得相对分子质量60×103的重组蛋白,经鉴定具有SSA/Ro60抗原性。结论成功克隆并表达SSA/Ro60,为诊断自身免疫疾病奠定基础。
SSA/Ro60;基因克隆;表达纯化
干燥综合征(SS)是一种全身外分泌腺的慢性炎性自身免疫反应疾病。研究表明,干燥综合征A型抗原(SSA)与SS、系统性红斑狼疮(SLE)等疾病的发生、发展及预后判断密切相关[1]。SSA抗原是细胞质中一类小核糖核酸与蛋白质结合的复合物,是一种重要的自身抗原[2]。近年来越来越多的学者对自身免疫性疾病进行深入的研究,对Ro抗原的认识也越来越深,Ro成为了核糖核蛋白复合物(RNP)抗原中最常见的抗原之一[3]。后来发现,Ro抗原与SSA属同一种自身抗原,故命名SSA/Ro抗原[4]。同时有研究者发现检测SSA/Ro抗原在临床上对自身免疫性疾病的诊断有极其重要的意义[5]。该抗原有52 000和60 000两种相对分子质量的蛋白,分别称为SSA/Ro52和SSA/Ro60。SSA/Ro60存在于多种自身免疫性疾病患者体内,生理状态下SSA/Ro60核蛋白及hYRNA共同构成核糖核蛋白复合体SSA/Ro60抗原,与多种自身免疫疾病密切相关[6]。目前检测SSA的免疫双扩散法无法区分Ro52和Ro60,免疫印迹法只能检出Ro52,常常导致Ro60的漏检[5]。所以本实验应用基因克隆技术成功表达出SSA/Ro60,为下一步建立新的SSA/Ro60检测方法奠定基础。
1 材料与方法
1.1质粒、菌株、细胞株PMD18-T质粒、人白血病HL-60细胞株购买自TAKARA公司,pPICZ质粒、大肠埃希菌DH5α、酵母菌SMD1168由大连大学实验室赠送。
1.2仪器与试剂Thermo Hera生物安全柜;Biorad C1000 PCR扩增仪;Biorad稳压稳流水平电泳仪;Biorad稳压稳流垂直电泳仪;Thermo Heracell 150 CO2细胞培养箱;Thermo Maxq 6000恒温培养摇床;BIO-RAD凝胶成像分析系统;BIORAD电穿孔仪;电转化杯。PCR试剂盒、 DNA连接酶试剂盒、限制性内切酶、切胶纯化试剂盒、质粒抽提纯化试剂盒均购买自TAKARA公司。cDNA合成试剂盒来自Transgen Biotech。抗SSA抗体、生物素标记的羊抗鼠IgG、亲和素标记的HRP购买自ABCAM公司。
1.3方法
1.3.1SSA基因的扩增HL-60细胞株经CO2细胞培养箱培养收获,用TRIZOL方法提取RNA后反转录成cDNA。利用GeneBank数据库确定SSA在基因组的位置,设计其两端的引物,并引入限制性内切酶位点,HIS标签位点等为后续的克隆及蛋白纯化提供便利。上游引物:SAP3 5′-CCG GAA TTC AAA AGA ATG GAG GAA TCT GTA AAC CAA ATG CAG CCA CTG AAT GAG AAG CAG ATA-3′,下游引物:SAP4 5′-GCC TCG AGT TAT CAT TAT CAA TGA TGA TGA TGA TGA TGG GAA CCA CCA CCA CCT TAA ATC ATA TCT AAT GTG AAA TTT CGA ATT ACA T-3′。反应条件:94 ℃ 3 min, 94 ℃ 30 s、60 ℃ 30 s、72 ℃ 90 s共30个循环, 72 ℃ 10 min。扩增片段应为1 511 bp。
1.3.2PCR产物纯化,TA克隆及测序将PCR产物切胶纯化后测量浓度,经合适的酶切后连接于PMD18-T载体构建重组质粒,通过蓝白斑筛选方法,挑出白色斑点的重组质粒进行LB培养,培养后送至上海生工测序。
1.3.3定向克隆将测序鉴定好的质粒和PICZ质粒进行双酶切,经切胶纯化后按合适浓度进行定向连接,转化至DH5α后过夜培养,提取质粒,酶切鉴定。
1.3.4重组子线性化、导入表达系统及筛选挑选正确的转化菌,增殖后抽提质粒,用SacⅠ行单酶切,生成线性pPICZ-SSA重组子。采用电穿孔方法,将线性重组子导入毕赤酵母菌SMD1168中。用G418筛选高表达重组菌。
1.3.5重组蛋白的SDS-PAGE电泳分析在上述重组菌上清液1 mL加入0.4 g无菌的硫酸铵充分混匀,4 ℃条件下放置2 h,期间约10 min混匀一次,在4 ℃条件下,15 000 r/min离心5 min,弃上清液,加入15 μL pH 7.4 PBS彻底混匀,再加入上样缓冲液15 μL混匀,置100 ℃煮沸5 min(Marker煮1 min),然后4 ℃,15 000 r/min离心5 min。取25 μL样品加样后进行电泳(4 ℃,120 V),考马斯亮蓝染色。
1.3.6重组蛋白的Western blotting鉴定利用电转仪将重组蛋白转至PVDF膜上,BSA-TBST为封闭液,一抗是鼠抗人SSA抗体,二抗是生物素标记的羊抗鼠IgG抗体,在亲和素标记的HRP、TMB显色液共同作用下完成。
1.3.7蛋白纯化将离心过滤后的碎菌上清液加入准备好的His Bind column柱中,经过一系列的洗柱平衡后收集滤液。
2 结 果
2.1SSA基因扩增及SSA-TA克隆测序琼脂糖凝胶电泳结果显示约一条1.5 kb的特异性条带,片段大小与预计的1 511 bp相符(图1)。且重组质粒测序结果显示与GeneBank报道的一致。

注:1为SSA PCR产物;M为DL2000 Marker。
2.2SSA-PICZ双酶切鉴定将SSA-PICZ重组质粒用XhoⅠ与EcoRⅠ双酶切后电泳鉴定,得到两条清晰条带,片段大小分别为3.6 kbp和1.5 kbp,与预期结果一致(图2方框内)。
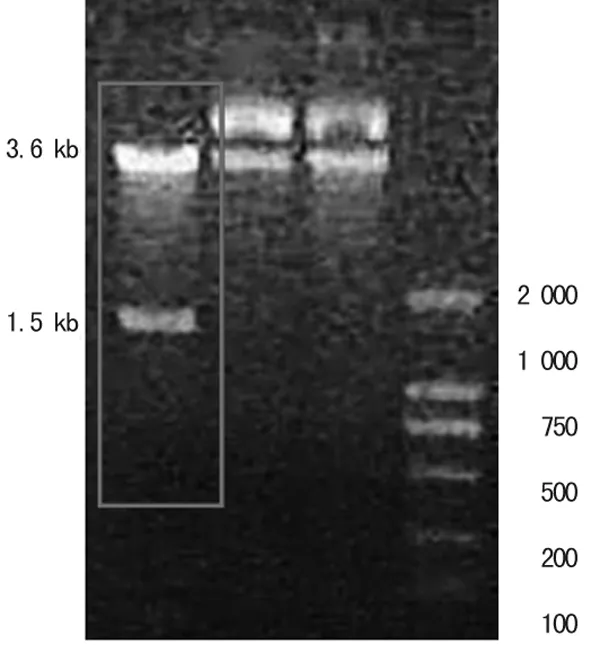
注:方框内为双酶切后基因片段,上面约3.6 kb为质粒,下面约1.5 kb为SSA;最右侧为DL2000 Marker。
2.3重组蛋白SDS-PAGE和Western blotting鉴定本实验成功表达出SSA/Ro60重组蛋白,经SDS-PAGE电泳分析,在60 000左右的位置出现一条较浓的蛋白区带(图3)。且该重组蛋白可与鼠抗人SSA结合,WB实验中可被特异性抗体识别,显示其有良好的特异性(图4)。

图3 重组蛋白SDS-PAGE电泳图谱

图4 重组蛋白Western blotting图谱
3 讨 论
Ro抗原根据其蛋白成分相对分子质量的大小分为两种类型:Ro52和Ro60抗原[7]。Ro抗原大部分存在于细胞质内,少部分存在于核周质及核内。Ro抗原在细胞内以低含量的RNP形式存在,是与细胞角蛋白相似的一种纤维网络,所以对该抗原的提取具有一定的难度[8]。
由于自身抗原本身的特点为低含量、种类多,所以提取自身抗原的难度较大,要获得均一的自身抗原更为困难。本实验从人白血病淋巴细胞HL-60株提取RNA,通过反转录技术得到cDNA,再以cDNA为模板成功扩增出了SSA基因。将SSA基因转入pPICZ载体构建pPICZ-SSA重组质粒,并将重组质粒导入毕赤酵母菌SMD1168真核表达系统进行诱导表达,最终获得纯度较高的重组蛋白,经过对重组蛋白的纯化鉴定后,证明其有一定的特异性。
本实验对靶基因SSA/Ro60 的核苷酸序列进行 cDNA 合成中,采取反转录PCR 这一途径代替用合成寡核苷酸探针筛选 cDNA 文库的繁琐基因克隆途径,可以方便、简捷地合成出目的基因SSA/Ro60。
毕赤酵母真核表达系统是蛋白表达研究中比较常用的表达系统。与原核表达系统相比,毕赤酵母基因系统具有许多优点[9-12]。(1)具有强大的启动子:毕赤酵母载体具有最强的醇氧化酶基因启动子,使得该表达系统对外源蛋白表达的调控相当严格。(2)表达量高:宿主菌株在毕赤酵母
菌中易于进行高密度连续发酵培养,外源蛋白表达量高。(3)稳定性高:重组质粒能在毕赤酵母体系中的特定位点以单/多拷贝的形式稳定整合,使外源基因在宿主细胞中稳定存在。
重组SSA/Ro60 抗原能特异识别患者体内抗SSA血清,因而可用重组抗原作为诊断抗原来检测自身免疫病,也可分析其片段的抗原性以了解其抗原表位,为探索自身免疫病的发生、发展提供辅助依据。下一步的研究中,笔者将对重组蛋白进行理化学分析,希望通过对SSA/Ro60重组抗原的透彻分析,从分子免疫学角度为某些自身免疫病的临床诊断提供依据,为制备重组抗原用于临床检测奠定基础。
[1]蔡逸婷,刘庆中,赵超,等.联合检测抗α-胞衬蛋白、抗SSA和抗SSB抗体在干燥综合征诊断中的应用[J].现代免疫学,2012,32(2):152-155.
[2]彭勇, 谭立明,李华,等.ANA、SSA、SSB、RO-52在干燥综合征诊断中的临床意义 [J].实验与检验医学,2013,31(3):229-247.
[3]郑宗富.SSA抗原的克隆表达及其抗体检测方法的建立[D].福州:福建医科大学学报,2007.
[4]魏权,杨湘越,兰小鹏.人自身抗原SSA/Ro60的基因克隆和原核表达[J].实用医技杂志,2005,12(23):3393-3394.
[5]徐泉.60kd SSA/Ro抗原的提取、纯化及蛋白质组学鉴定[D].北京:中国协和医科大学,2004.
[6]李洁.抗SSA/RO60kDa抗原表位特异性单克隆抗体的表达和致病机制的研究[D].北京:中国协和医科大学,2009.
[7]吕良敬,陈顺乐, 顾越英,等.R060/SSA基因转染HEp-2细胞作为间接免疫荧光检测底物及其应用[J].标记免疫分析与临床,2006,13(1):31-34.
[8]朱涛.人自身抗原Ro52的酵母重组表达及其抗体检测斑点免疫金渗滤法的建立[D].福州:福建医科大学,2011.
[9]张义浜,施立楠,唱韶红,等.人sTNFRⅡ-IgG Fc融合蛋白在毕赤酵母菌中的表达及其产物分析[J].细胞与分子免疫学杂志,2007,23(6):515-519.
[10]Cereghino JL,Cregg JM.Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J].FEMS Microbiol Rev,2000,24(1):45-66.
[11]Thongekkaew J,Boonchird C.Molecular cloning and functional expression of a Novel extracellular liPase from the thermotolerant yeast Candida thermoPhila[J].FEMS Yeast Res,2007,7(2):232-243.
[12]Lin Cereghino GP,Sunga AJ,Lin Cereghino J,et al.Expression of foreign genes in the yeast Piehia Pastoris[J].Genet Eng (N Y),2001,23:157-169.
Gene cloning and expression purification of human autoimmune antigen SSA/60*
NIUGuanghua,ZHANGCheng△,LYUDan,GAOYujie
(AffiliatedHospitalofLiaoningUniversityofTraditionalChineseMedicine,Shenyang,Liaoning110032,China)
ObjectiveTo clone human autoimmune antigen SSA/Ro60 and to purify its expression to provide the material basis for the assisted diagnosis of human autoimmune diseases.MethodsThe SSA/Ro60 gene was cloned by RT-PCR and directionally inserted into expression vector pPICZ.The recombinant plasmid was transformed into Pichia SMD1168.The obtained recombinant protein was identified by SDS-PAGE and Western blotting.ResultsThe amplified full-length sequence was about 1.5 kb in size.The pPICZ-SSA positive clone produced a 60×103recombinant protein which had natural immunogenicity of human autoimmune antigen SSA/Ro60 by SDS-PAGE and Western blot.ConclusionHuman autoimmune antigen SSA/Ro60 is successfully cloned and expressed,which lays a foundation for diagnosing autoimmune diseases.
SSA/60;gene cloning;expression and purification
辽宁省自然科学基金资助项目(02014010058-301)。
牛广华,男,主任技师,主要研究方向是风湿免疫分子生物。△
,E-mail:cecillia-85414@163.com。
10.3969/j.issn.1673-4130.2016.16.007
A
1673-4130(2016)16-2224-03
2016-01-29
2016-06-03)
