利用高能混合粒子场诱变选育高产Monacolin K、低产桔霉素的红曲霉菌株
2016-09-14郎天丹王成涛刘录祥北京工商大学北京市食品添加剂工程技术研究中心北京00048食品质量与安全北京实验室北京00048中国农业科学院作物科学研究所国家农作物航天诱变技术改良中心北京0008
郎天丹,梁 健,王成涛,2,张 婵,2,*,刘录祥(.北京工商大学北京市食品添加剂工程技术研究中心,北京00048;2.食品质量与安全北京实验室,北京00048;.中国农业科学院作物科学研究所,国家农作物航天诱变技术改良中心,北京0008)
利用高能混合粒子场诱变选育高产Monacolin K、低产桔霉素的红曲霉菌株
郎天丹1,梁 健1,王成涛1,2,张 婵1,2,*,刘录祥3
(1.北京工商大学北京市食品添加剂工程技术研究中心,北京100048;2.食品质量与安全北京实验室,北京100048;3.中国农业科学院作物科学研究所,国家农作物航天诱变技术改良中心,北京100081)
利用北京正负电子对撞机直线加速器E2束流打靶产生高能混合粒子场,以64.3 Gy的剂量处理两株紫色红曲霉(Monascus Purpureus)M1和M2,经初筛、复筛后采用HPLC法检测诱变菌株中Monacolin K含量,并进行遗传稳定性实验,从而选育高产Monacolin K、低产桔霉素的突变株。结果表明:经混合粒子场辐照后,紫色红曲霉M1和M2分别筛选出43株和22株正突变株,突变率分别为74.64%和56.72%,其中正突变率分别为60.56%和32.84%。突变株M1-20、M2-4发酵液中Monacolin K含量分别达到了421.69 mg/L和406.68 mg/L,较出发菌株分别提高了142.14%和101.27%,经5次传代培养后产Monacolin K的能力仅下降了4.21%和1.65%,并且其发酵液中桔霉素的含量均在0.01~0.04 mg/L之间,与出发菌株相比,桔霉素含量均明显下降。高能混合粒子场可引起紫色红曲霉菌落形态及色泽发生改变,突变率高,可获得遗传性能稳定的突变株,是一种可应用到微生物诱变育种的新方法。
紫色红曲霉,Monacolin K,混合粒子场,菌株选育
红曲是一种广泛应用于东南亚地区的传统药食同源的发酵产物,红曲霉作为食用菌在中国已有上千年的历史[1-2]。红曲霉可产生多种次级代谢产物,主要包括红曲色素[3-4]、Monacolin K[5-7]、γ-氨基丁酸[8-10]、麦角固醇[11]等。目前,Monacolin K已成为各国公认的降低胆固醇的理想药剂[12-13],对选育高产Monacolin K的红曲霉菌株就显得尤为重要。
空间环境诱变是微生物诱变育种的新途径[14],空间环境由于存在宇宙线粒子、高能重离子、高真空、极度温差和弱磁场等因素可诱导微生物产生基因突变,进而影响微生物的生物学性状和功能[15-18]。实践证明,航天空间环境诱变微生物具有变异幅度大、频率高、遗传稳定性好等特性[19-20]。但由于空间实验投资大,技术要求高,实验机会也十分有限,空间诱变难以大规模、持续应用到微生物诱变育种中,所以要加强地面模拟航天空间环境诱变育种工作,这对于有效利用航天技术开展微生物诱变育种具有重要意义。近年来,中国农业科学院航天育种中心等单位率先在国内外利用北京正负离子对撞机模拟次级宇宙粒子,产生具有广谱结构、能量在200 MeV~1.2 GeV之间的混合粒子场,主要应用于小麦、蔬菜、牧草等作物的改良上[21-22]。本研究利用北京正负离子对撞机模拟宇宙粒子组成的混合粒子场辐照处理紫色红曲霉M1和M2来筛选高产Monacolin K、低产桔霉素的突变株,为红曲霉的工业化生产提供新的理论依据,也为航天空间环境诱变技术在微生物诱变育种中的应用奠定基础。
1 材料与方法
1.1 材料与仪器
紫色红曲霉M1和M2 本实验室保存;葡萄糖、琼脂、甘油 北京奥博星生物技术责任有限公司;甲醇、乙腈 赛默飞世尔科技(北京)有限公司,色谱纯;Monacolin K(纯度≥98%)、桔霉素(纯度≥98%)
Sigma公司;其他试剂 均为国产分析纯。
LDZX-75KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;HZQ-F160全温振荡培养箱 太仓市实验设备厂;恒温水浴锅 山东华鲁电热仪器有限公司;20A型高效液相色谱仪、UV-2450型紫外可见光分光光度计 日本岛津公司;PHS-3D功能型pH计 上海三信仪表厂;超净工作台 北京东联哈尔仪器制造有限公司。
1.2 培养基
斜面培养基(g/L):葡萄糖20 g,蛋白胨3 g,酵母浸粉4 g,麦芽浸粉20 g,琼脂20 g,KH2PO42 g,NaNO32 g,MgSO4·7H2O 1 g。
液体种子培养基(g/L):葡萄糖30 g,豆粕粉15 g,蛋白胨10 g,甘油70 g,KH2PO42 g,NaNO32 g,MgSO4· 7H2O 1 g。
液体发酵培养基(g/L):甘油90 g,大米粉20 g,蛋白胨10 g,KH2PO42.5 g,NaNO35 g,MgSO4·7H2O 1 g,ZnSO4·7H2O 2 g。
1.3 培养方法
单菌落接种试管斜面后,30℃培养7 d,至菌丝长满斜面,用接种环刮取适量新鲜菌丝体接种到种子培养基中,30℃、200 r/min培养3 d,按10%(V/V)的接种量接种到发酵培养基中,25℃、150 r/min培养12 d。
1.4 实验方法
1.4.1 红曲霉孢子悬液的制备 将红曲霉M1和M2斜面在30℃培养7 d后,用10 mL 0.9%的无菌生理盐水将红曲霉孢子洗涤下来,倒入已灭菌装有玻璃珠的三角瓶中,振荡约5 min,显微镜检查,孢子分散即可。用已灭菌的带有滤纸的漏斗过滤除去菌丝体,制成孢子悬浮液,并调整孢子浓度至105个/mL,4℃冰箱保存备用[23]。
1.4.2 红曲霉的辐照处理 利用正负电子对撞机直线加速器E2束流打靶产生的混合粒子场(用CR表示)辐照处理两株紫色红曲霉的孢子悬液,辐照剂量为64.3 Gy。
1.4.3 诱变菌株初筛 将辐照处理的孢子悬液用0.9%的无菌生理盐水做倍比稀释,取10-1、10-2、10-3三个稀释梯度的菌液100 μL涂于平板培养基上,30℃倒置培养3 d,初步筛选出菌落形态与出发菌株有明显差异、生长较快或较红的单菌落,接于试管斜面保存,用于下步实验。对照组样品做同样处理[24]。
1.4.4 诱变菌株复筛 种子液培养:用接种环刮取适量新鲜培养好的试管斜面,接种到种子培养基中,30℃、200 r/min培养3 d。
液体发酵培养:按10%(V/V)的接种量将种子液接种到发酵培养基中,25℃、150 r/min培养12 d,检测Monacolin K含量。
1.4.5 标准曲线的绘制 Monacolin K标准曲线的绘制:精密称取Monacolin K标准品(内酯型)0.01 g,置于50 mL容量瓶中,加入4 mL甲醇溶液溶解,然后加20 mL 0.2 mol/L氢氧化钠溶液,40℃超声30 min后冷却,用3 mol/L磷酸调节pH至6左右,加甲醇定容至刻度,即配制成浓度为200 mg/L酸型标准溶液,再分别稀释成5、20、50、80、100、150 mg/L标准溶液。按照
1.4.6 中所述色谱条件进样,以峰面积为纵坐标(Y),Monacolin K质量浓度为横坐标(X),绘制标准曲线。
桔霉素标准曲线的绘制:精密称取桔霉素标准品0.001 g,置于50mL容量瓶中,加甲醇定容至刻度,即配制成浓度为20 mg/L的标准溶液,再分别稀释成0.05、0.2、2、4、8、12、16 mg/L标准溶液。按照1.4.7方法所述色谱条件进样,以峰面积为纵坐标(Y),桔霉素质量浓度为横坐标(X),绘制标准曲线。
1.4.6 Monacolin K的检测 发酵液的预处理:取发酵液5 mL,加入15 mL 75%的甲醇,超声波萃取30 min,静置过夜,然后取上清液经0.45 μm的有机微孔滤膜过滤,检测滤液中Monacolin K含量。
Monacolin K的检测[25]:采用HPLC法,色谱柱:InertsilODS-3 C18(150 mm×4.6 mm×5 μm),流动相:0.1%磷酸∶甲醇=1∶3,流速1 mL/min,检测器为紫外检测器(PDA),检测波长237 nm,检测温度30℃,进样量10 μL。
1.4.7 桔霉素的检测 发酵液的预处理:取红曲霉发酵液10 mL,加入20 mL无水乙醇,超声破碎细胞10 min,60℃水浴振荡1 h,冷却至室温,3000 r/min离心15 min,然后取上清液经0.45 μm的有机微孔滤膜过滤,滤液用来检测桔霉素含量。
桔霉素的检测[26]:采用HPLC法,色谱柱:YMCTriart C18(250 mm×4.6 mm×5 μm),流动相:乙腈∶水(磷酸调pH2.5)=35∶65,流速:1.2 mL/min,检测器:荧光检测器,激发波长λex=331 nm,发射波长λem= 500 nm,柱温28℃,进样量20 μL。
1.4.8 突变株的遗传稳定性实验 将筛选得到的相对高产Monacolin K、低产桔霉素的紫色红曲霉诱变菌株在固体培养基上连续传代5次,检测各诱变菌株第5代的Monacolin K含量,研究其遗传稳定性能,方法参见1.4.6。
1.4.9 突变株生物量的测定 干重法测定菌体生物量:取15 mL发酵液用3层纱布过滤,再用蒸馏水洗涤2~3次,拧干水分,在60℃烘箱中烘干至恒重,即为菌丝体干重[27]。
生物量(g/L)=干物质质量/发酵液体积
1.4.10 突变率的计算 诱变菌株突变率的计算以Monacolin K的含量为标准。将Monacolin K含量降低或提高20%以上的诱变菌株定义为突变株。正突变株即指Monacolin K含量提高20%以上的突变株。计算公式如下[28]:
突变率(%)=突变株数/总诱变株数
正突变率(%)=Monacolin K含量提高20%以上的突变株数/总诱变菌株数
负突变率(%)=Monacolin K含量降低20%以上的突变株数/总诱变菌株数
2 结果与分析
2.1 Monacolin K标准曲线
线性回归方程:y=32768x+31956,R2=0.9992,证明Monacolin K在5~200 mg/L的范围内线性关系良好。
2.2 诱变菌株初筛

图1 诱变前(a)后(b)菌落形态Fig.1 Colony morphology before(a)and after(b)M1 mutagenesis
以紫色红曲霉M1为例,a图为辐照前孢子悬液(稀释100倍)涂布平板后长出的菌落,b图为辐照后孢子悬液(稀释100倍)涂布平板得到的菌落。通过对比可知,经辐照处理后菌落数明显降低,部分菌株的菌落直径明显小于出发菌株,菌落色泽呈现橙红色,而部分菌株各个时期的菌落直径均大于出发菌株相应时期的菌落直径,其生长速度明显快于出发菌株。因此,辐照处理后,初步筛选出菌落形态与出发菌株有明显差异、生长较快或较红的单菌落,接于试管斜面保存。
2.3 诱变菌株复筛
紫色红曲霉M1初筛共得到71株诱变菌株,以Monacolin K含量为计算标准,得出紫色红曲霉M1的突变率为74.64%,其中正向突变率为60.56%,负向突变率为14.08%,其中有12株突变株Monacolin K含量较高,与出发菌株相比提高了1倍以上,结果见图2。紫色红曲霉M2初筛共得到67株诱变菌株,突变率为56.72%,其中正向突变率为32.84%,负向突变率为23.88%,其中有5株突变株Monacolin K含量较高,4株与出发菌株相比提高了1倍左右,另外一株与出发菌株相比提高了2倍多,结果见图3。
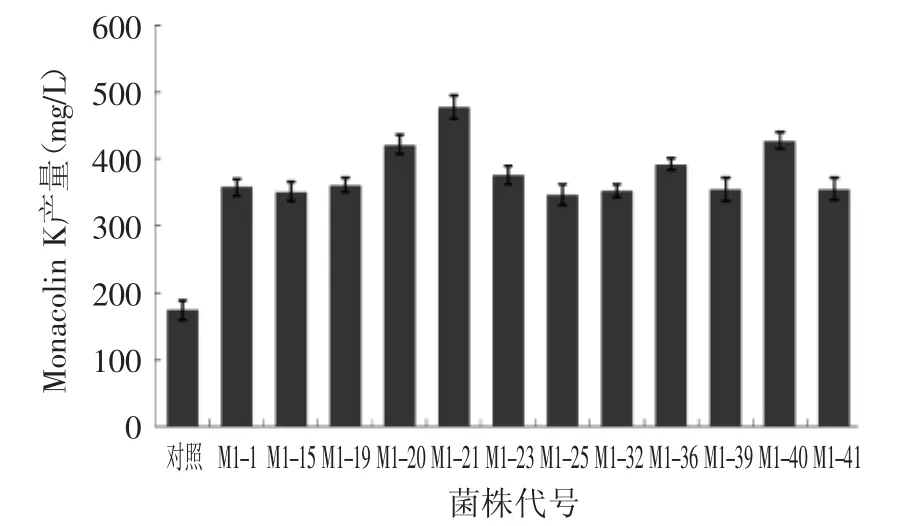
图2 出发菌株M1与其突变株的Monacolin K产量Fig.2 The Monacolin K production of original strains M1 and its mutant strains
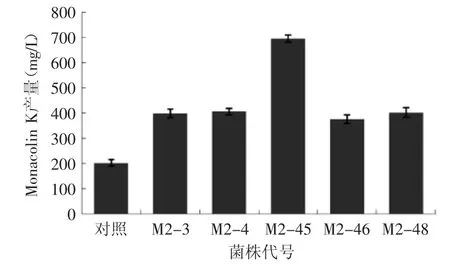
图3 出发菌株M2与其突变株的Monacolin K产量Fig.3 The Monacolin K production of original strains M2 and its mutant strains
2.4 高产Monacolin K突变株产桔霉素的情况
2.4.1 桔霉素标准曲线 线性回归方程:y=3263493x+49697,R2=0.9962,桔霉素在0.05~16 mg/L的范围内线性关系良好。
2.4.2 突变株的桔霉素含量 将复筛得到的一些较出发菌株高产Monacolin K的突变株,参照1.4.7方法检测各突变株产桔霉素情况,结果见表1。
由表1可见,各突变株产桔霉素能力相差不大,与出发菌株的桔霉素含量相比均下降了93%以上。故选择Monacolin K含量较高、桔霉素含量相对较少的红曲霉M1-20、M1-21、M1-23、M1-36、M1-40和M2-3、M2-4、M2-45、M2-46、M2-48突变株进行菌株的遗传稳定性实验。
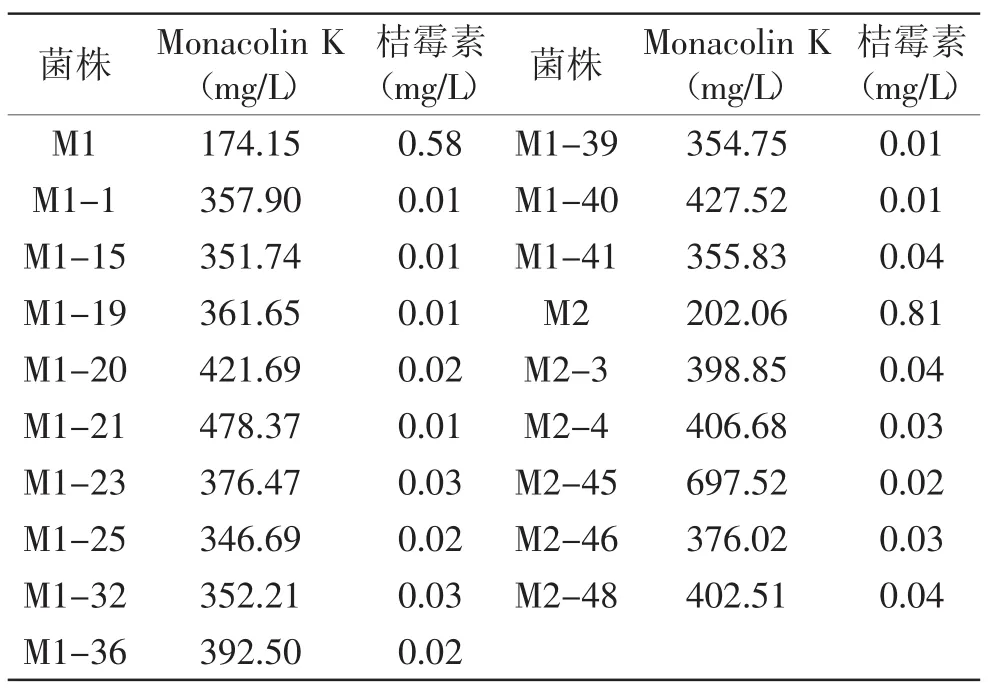
表1 突变株产Monacolin K和桔霉素的情况Table1 Mutant strains produce Monacolin K and citrinin
2.5 突变株的遗传稳定性实验
为检测突变株的遗传稳定性,对筛选出的10株突变株连续传代5次,采用HPLC法检测突变株中Monacolin K含量。由图4和图5可见,红曲霉M1-20、M1-21、M1-23、M1-36、M1-40和M2-3、M2-4、M2-45、M2-46、M2-48突变株经5次传代培养后产Monacolin K能力分别下降了4.2%、65.1%、20.75、6.2%、80.7%和10.6%、1.65%、38.0%、33.8%、72.6%,其中M1-20和M2-4突变株遗传性能比较稳定,Monacolin K产量相对较高,故选择该菌株作为继续研究的菌株。
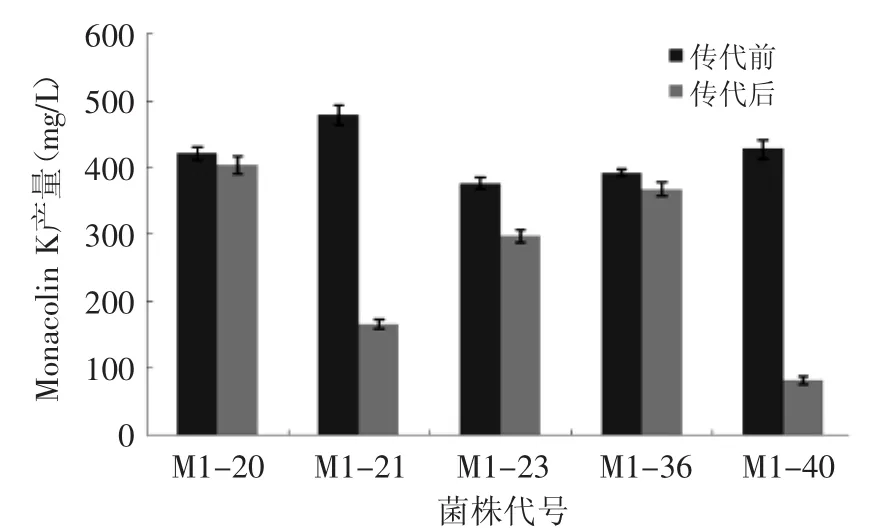
图4 紫色红曲霉M1突变株传代稳定性Fig.4 Monascus Purpureus M1 mutant subculture stability
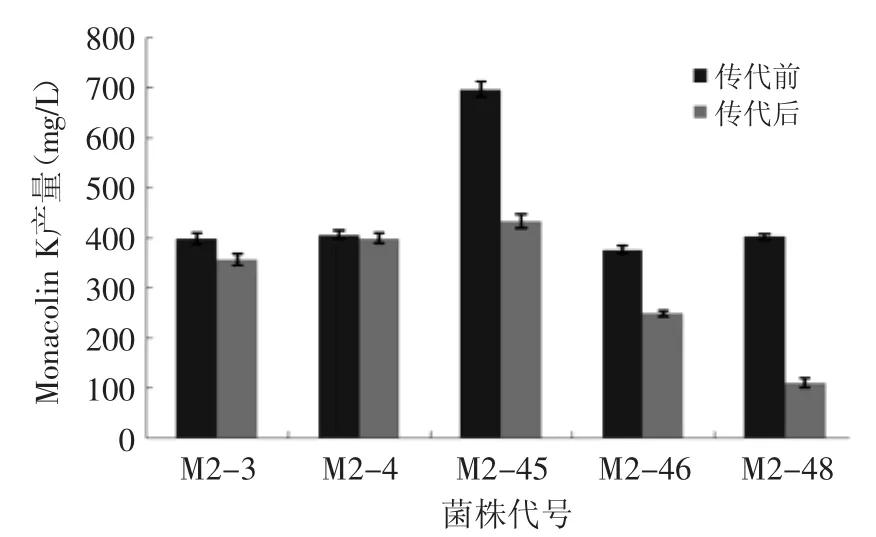
图5 紫色红曲霉M2突变株传代稳定性Fig.5 Monascus Purpureus M2 mutant subculture stability
2.6 突变株Monacolin K产量及生物量的测定
将遗传稳定的突变株M1-20和M2-4摇瓶发酵,参照方法1.4.6和1.4.9分别测定突变株的Monacolin K产量和菌体生物量,出发菌株做同样处理。如图6和图7所示,菌体生长基本符合S形生长曲线,菌体生物量在7 d左右达到最大值,且突变株M1-20和M2-4的生物量较出发菌株有一定提高。突变株M1-20和M2-4在4~5 d时开始积累Monacolin K,第6 d时Monacolin K积累进入对数期,速度明显加快。Monacolin K主要在菌体生长的稳定期积累,且突变株M1-20和M2-4的Monacolin K产量明显高于出发菌株,到第13 d时Monacolin K的合成量趋于稳定,此时部分细胞发生裂解死亡引起产量细微的波动。
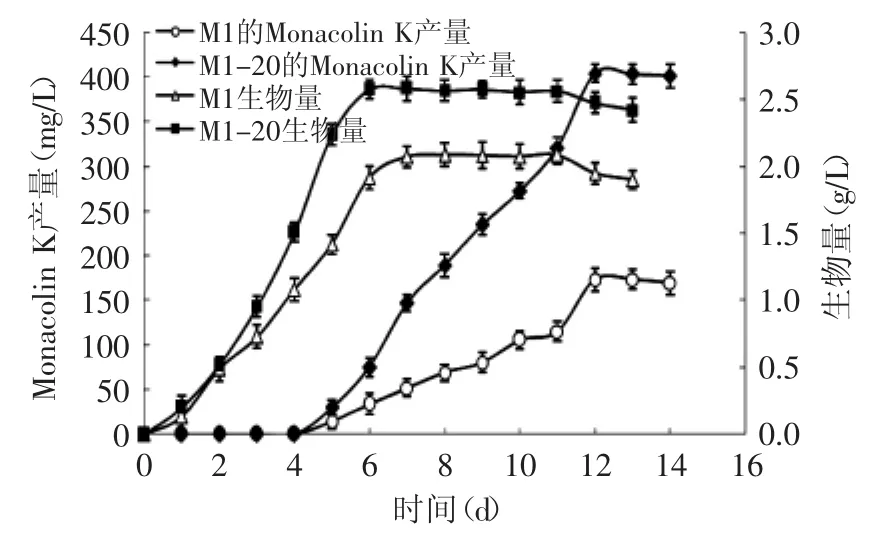
图6 突变株M1-20生物量及Monacolin K产量Fig.6 Biomass and Monacolin K yield of mutant M1-20

图7 突变株M2-4生物量及Monacolin K产量Fig.7 Biomass and Monacolin K yield of mutant M2-4
3 结论
利用北京正负电子对撞机模拟宇宙粒子组成的混合粒子场辐照处理紫色红曲霉M1和M2,通过观察红曲霉的菌落形态、HPLC法检测Monacolin K和桔霉素含量、遗传稳定性实验来筛选稳定的高产Monacolin K,低产桔霉素的突变株,最终筛选出M1-20和M2-4两株稳定高产的突变株。突变株M1-20、M2-4发酵液中Monacolin K含量分别达到了421.69 mg/L和406.68 mg/L,与出发菌株相比分别提高了142.14%和101.27%,其经5次传代培养后产Monacolin K的性能仅下降了4.2%和1.65%,表现出良好的遗传稳定性,可作为进一步研究的菌株。与传统的诱变育种相比,混合粒子场诱变具有诱变作用强、诱变率高、变异幅度广和有益变异多等优点,可从中获得丰富的突变株,在提高诱变效率、提高红曲霉生产潜力、改良品质方面起到理想的效果,特别是可从中获得传统育种难以获得优质红曲霉突变株。因此,高能混合粒子场已成为微生物诱变育种的新途径。
[1]杨悦,王硕,杜欣军,等.不同培养基对紫色红曲霉发酵规律的影响[J].食品科技,2014,39(8):21-27.
[2]Shi Y C,Pan T M.Beneficial effects of Monascuspurpureus NTU 568-fermented products:a review[J].Applied Microbiology &Biotechnology,2011,90(4):1207-1217.
[3]Mapari S A.Fungal polyketideazaphilone pigments as future natural food colorants[J].Trends in Biotechnology,2010,28(6):300-307.
[4]张锐.红曲霉液态发酵生产红曲色素的工艺优化[J].生物技术通报,2015,31(2):187-195.
[5]Endo A.Monacolin K,a new hypocholesterolemic agent produced by a Monascus species.[J].Journal of Antibiotics,2000,32(8):852-854.
[6]杨欢欢,胡中泽.红曲菌的复合诱变及其固态发酵条件的优化[J].食品科学,2012(11):247-251.
[7]李滔滔,李小龙,张凤琴.高产洛伐他汀红曲菌株的诱变选育[J].食品工业科技,2012,33(24):246-248.
[8]Obata K,Ito M,Ochi R,et al.Pharmacological properties of the postsynaptic inhibition by Purkinje cell axons and the action of γ-aminobutyric acid on Deitersneurones[J].Experimental Brain Research,1967,4(1):43-57.
[9]何晓娇,陈璨,周月婷,等.高产γ-氨基丁酸低产桔霉素红曲霉(Monascusruber)突变子1047筛选与发酵特性研究[J].微生物学杂志,2014,34(5):38-43.
[10]张圆林,王昌禄,陈勉华,等.高产γ-氨基丁酸的红曲霉菌株筛选及发酵条件优化[J].食品科学技术学报,2014,32(5):35-40.
[11]黄志兵,许杨,张泓,等.红曲菌几种主要次级代谢产物及其生物活性的研究进展[J].食品与发酵工业,2010,36(4):143-148.
[12]王璐.农杆菌介导转化及原生质体融合法选育红曲菌Monacolin K高产株[D].无锡:江南大学,2011.
[13]李晶,马贵民,冯晓明,等.红曲霉发酵产物Monacolin K的研究进展与应用[J].食品工程,2014(2):9-11.
[14]胡延岭,刘录祥,郭会君,等.高能混合粒子场诱发的小麦矮杆突变体的SSR分析[J].核农学报,2008,22(4):399-403.
[15]俞法明,严文潮,毛雪琴,等.利用空间诱变技术进行早籼稻新品种的改良[J].核农学报,2014,28(6):949-954.
[16]董亚琳,张洪伟,代秀云.空间环境诱变育种技术及应用[J].农业与技术,2010,33(3):21-23.
[17]高桐梅,卫双玲,李春明,等.芝麻太空诱变效应及AFLP标记检测[J].华北农学报,2013,28(1):227-233.
[18]黄永相,郭涛,蔡金洋,等.空间环境和60Co-γ辐照对水稻稻米品质的诱变效应[J].核农学报,2013,27(6):709-714.
[19]赵金涛,郭新梅,裴玉贺,等.高能混合粒子场对玉米幼苗生长及抗氧化系统的影响[J].核农学报,2014,28(12):2133-2138.
[20]张文涛,杜久元,白斌.作物空间诱变及其在遗传育种中的应用[J].种子,2014,33(4):48-52.
[21]于新玲,刘录祥,乔利仙,等.高能混合粒子场辐照对花生胚小叶组织培养及植株再生的影响[J].核农学报,2012,26 (3):433-438.
[22]刘录祥,韩微波,郭会君,等.高能混合粒子场诱变小麦的细胞学效应研究[J].核农学报,2005,19(5):327-331.
[23]李滔滔.高产洛伐他汀红曲霉菌诱变育种及其在酱油废水中的应用[D].株洲:湖南工业大学,2013.
[24]印红,谢申义,章光明,等.利用返回式飞船选育优良红曲霉菌[J].核农学报,2004,18(4):297-299.
[25]胡文效,魏彦锋,蒋锡龙,等.高产Monacolin K红曲霉菌种的诱变选育及液态发酵工艺优化[J].食品工业科技,2013,34 (24):296-301.
[26]黄艳,孟丽茹,许赣荣,等.高产色素红曲菌的选育及摇瓶发酵培养基优化[J].中国食品添加剂,2013(6):133-139.
[27]付海平.产Monacolin K红曲霉的筛选及其发酵条件的研究[D].长沙:湖南农业大学,2004.
[28]邱雯雯,任雅琳,陈存社,等.常压室温等离子体诱变筛选高乳糖酶活力酵母的研究[J].中国食品学报,2014,14(2):132-137.
Using high-energy hybrid particle field mutation breeding high yield Monacolin K and low yield citrinin of Monascus strains
LANG Tian-dan1,LIANG Jian1,WANG Cheng-tao1,2,ZHANG Chan1,2,*,LIU Lu-xiang3
(1.Beijing Engineering and Technology Research Center of Food Additives,Beijing 100048,China;2.Beijing Laboratory of Food Quality and Safety,Beijing Technology and Business University(BTBU),Beijing 100048,China;3.Institute of Crop Science,Chinese Academy of Agricultural Sciences,National Center of Space Mutagenesis for Crop Improvement,Beijing 100081,China)
Using of the Beijing electron-positron collider linear accelerator E2 beam shooting produce highenergy hybrid particle field processed two Monascus Purpureus strains M1 and M2 with the dose of 64.3 Gy,after initial and second screening,using HPLC method to detect the Monacolin K content in the mutant,and genetic stability experiments,thus breeding high Monacolin K and low yield citrinin mutant.The results showed that:after hybrid particle field irradiated,Monascus Purpureus M1 and M2 obtained 43 and 22 high yield Monacolin K mutants,respectively,the mutation rate was 74.64%and 56.72%,respectively,in which the positive mutation rate was 60.56%and 32.84%,respectively.Monacolin K content of M1-20 and M2-4 mutant reached 421.69 mg/L and 406.68 mg/L,which improved 142.14%and 101.27%than the original strain,respectively,Monacolin K content of M1-20 and M2-4 mutant decreased 4.21%and 1.65%after subculture for 5 times,respectively,and citrinin content of two mutant were between 0.01 mg/L and 0.04 mg/L,which compared with the original strain,citrinin content were significantly decreased.High-energy hybrid particle field could cause colony morphology and color change of Monascus Purpureus,high mutation rate,the mutant strains of genetic stable performance could be obtained,it was a kind of new method that could be applied in the microbial mutation breeding.
Monascus Purpureus;Monacolin K;hybrid particle field;strain screening
TS201.3
A
1002-0306(2016)02-0165-05
10.13386/j.issn1002-0306.2016.02.025
2015-06-10
郎天丹(1991-),女,硕士研究生,研究方向:食品生物技术,E-mail:langtiandan@163.com。
*通讯作者:张婵(1984-),女,博士,副教授,研究方向:食品生物技术,E-mail:zhangchan@th.btbu.edu.cn。
国家自然科学基金项目(31301411);北京市教委(KM201410011009);北京市科技计划项目(Z151100001215008)。
