凝血酶预处理对大鼠脑出血后SVZ细胞迁移和分化的影响
2016-09-14关景霞解燕春张少锋袁振华黄婷婷卢祖能
关景霞 解燕春 张少锋 袁振华 黄婷婷 卢祖能
凝血酶预处理对大鼠脑出血后SVZ细胞迁移和分化的影响
关景霞解燕春张少锋袁振华黄婷婷卢祖能
目的探讨凝血酶预处理(thrombin preconditioning,TPC)对大鼠脑出血(intracerebral hemorrhage,ICH)后侧脑室下带(subventricular zone,SVZ)细胞迁移和分化的影响。方法将90只SD雄性大鼠随机分为3组:TPC组、ICH组、对照组。每组分为3、7、14、21、28 d亚组;应用IV型胶原酶脑内立体定向注射制作脑出血模型,应用Brdu标记新生的SVZ细胞;进行脑片培养,应用时间间隔显微系统动态观察Dil标记的SVZ细胞在活体脑片上的迁移;为了评估迁移至损伤区的SVZ细胞是否具有与其他细胞形成突触的能力,进行Brdu和突触蛋白Ⅰ免疫组织化学双标染色。结果在时间间隔显微系统下观察Dil标记的SVZ细胞向纹状体迁移,动态观察12 h,TPC组3 d SVZ细胞迁移的速度是(4.23±0.25)μm/h,7 d的速度是(6.53±0.37)μm/h,14 d的速度是(8.23±0.47)μm/h,21 d的速度是(7.05±0.31)μm/h,28 d的速度是(5.29±0.20)μm/h,在各个时间点TPC组的迁移速度明显快于脑出血组(P<0.01)。TPC组同侧纹状体Brdu和突触蛋白Ⅰ双标阳性细胞3 d明显增加,14 d达高峰,持续至21 d,然后逐渐减少。脑出血组3 d未见Brdu和突触蛋白Ⅰ双标阳性细胞,7 d可见少数阳性细胞,14 d达高峰,然后逐渐下降,在各个时间点双标阳性细胞与脑出血组比较均明显增加(P<0.01)。TPC使突触蛋白I的表达出现时间更早,持续时间更长。结论TPC能够促进脑出血后SVZ细胞的迁移和分化。
脑出血侧脑室下带凝血酶预处理
脑出血(Intracerebral haemorrhage, ICH)具有较高的发病率和病死率, 大约占所有脑卒中死亡的15%[1]。目前,尽管脑出血急性期的治疗已经逐渐走上规范化道路,但是对脑出血后造成的神经功能缺失仍然缺乏有效的治疗手段[2]。近来的研究发现,脑损伤能引起内源性的神经再生,主要在侧脑室下带(subventricular zone, SVZ), 新生的细胞可以向损伤区域迁移[3-4]。我们的前期研究也发现脑出血后存在内源性神经再生,但是脑出血后内源性神经再生的调节机制尚不明确[5-6]。因此,探讨脑出血后内源性神经再生机制对于进一步增强这一过程是非常重要的。
凝血酶是一种血清丝氨酸蛋白酶,是凝血瀑布的重要成分,脑出血后立即产生。既往研究表明高浓度的凝血酶对脑组织具有损伤作用,低浓度的凝血酶具有保护作用[7-9]。我们的前期研究发现凝血酶能够破坏血脑屏障、引起脑水肿,介导炎症反应[10-11]。但是预先使用小剂量的凝血酶能够减轻脑出血导致的脑水肿和神经细胞的死亡[12-13],这种现象被称作凝血酶预处理(thrombin preconditioning,TPC)或凝血酶引起的脑耐受。TPC的机制尚不明确。我们的前期研究表明TPC能够增强脑出血后的SVZ细胞的再生[6],本研究主要进一步探讨TPC对脑出血后SVZ细胞迁移和分化能力的影响。
1 材料与方法
1.1实验动物分组
健康SD雄性大鼠90只,体重(250±20)g,随机分为对照组、ICH组和TPC组,每组分为3、7、14、21、28 d亚组,每亚组各6只大鼠。
1.2动物模型的制作
实验大鼠用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,固定于立体定位仪上, 头皮正中切开,剪开骨膜,暴露前囟,于颅骨背侧前囟后0.2 mm,中线右侧3 mm处钻一直径为2 mm的孔;用固定于立体定位仪上30号无菌针头沿针孔垂直进针,进针深度为5.8 mm。对照组注射生理盐水2 μL,ICH组注射溶有胶原酶0.4 U的生理盐水2 μL。TPC各组首先在右侧纹状体注入1 U凝血酶,1 d后再制作右侧纹状体脑出血模型。每组6只大鼠在模型制作后3只进行Brdu标记,3只进行Dil标记,各组大鼠在相应的时间点处死。
1.3Dil在体标记SVZ细胞
各组的动物模型制作后在各个亚组时间点的前1 d(即第2、6、13、20、27 d)用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,固定于立体定位仪上, 头皮正中切开,剪开骨膜,暴露前囟,于颅骨背侧前囟后1.0 mm,右侧旁开1.5 mm,硬脑膜下3.5 mm处,将2 g/L的荧光染料Dil 10 μL缓慢注入右侧侧脑室,留针5 min后缓慢退针,常规消毒,缝合皮肤。
1.4制作皮层纹状体脑片进行培养
各组大鼠在各亚组时间点断头处死,浸入75%酒精消毒,快速取出全脑放入预冷人工脑脊液中(成分mmol/L:NaCl 126,KCl 2.5,NaH2PO31.2,MgCl 1.3,葡萄糖11,NaC0325,CaCl24,试剂配制均用蒸馏水)。清除软脑膜, 取前囟前1.3 mm 至前囟后2.7 mm之间的脑块,置于组织切片机的载物台上,以300 μm厚度单位切取脑片,放入预冷的人工脑脊液中漂洗,然后放入加有脑片培养液的六孔培养板中。脑片培养液组成:50%DMEM,25%HESS,25%马血清,65 g/L D-葡萄糖,298 mg/L HEPES,100 U/mL青霉素,100 μg/mL链霉素,25 μg/mL两性霉素。脑片的培养条件为温度37 ℃,体积分数为95%的空气和5%饱和湿度的CO2孵箱中培养。
1.5时间间隔成像系统动态追踪SVZ细胞
该检测系统配有自动化载物台、荧光显微镜和时间间隔成像系统,自动化载物台提供最理想的活体细胞存活环境,适用于长时间间隔法动态追踪活体细胞。将各个亚组脑片的培养皿放置于显微镜的自动化载物台上,显微镜观察Dil标记的SVZ细胞的迁移,自动拍照,观察12 h,应用metamorph通用软件进行综合分析处理。
1.6BrdU在体标记SVZ细胞
动物模型制作后腹腔注射Brdu磷酸盐缓冲液(50 mg/kg),2次/d,直至在相应的时间点处死大鼠。
1.7免疫组织化学双标染色
各组大鼠在相应的时间点经心脏进行灌注,断头取全脑,以注入针道为中心,冠状位切下组织块,厚约4 mm,剩余部分弃去;组织块放入4%多聚甲醛内,后固定4 h,换入20%蔗糖溶液中过夜至组织块沉底;标本用恒温冰冻切片机经血肿中心作全脑连续冠状位切片,片厚5 μm,切片放入37 ℃的盐酸溶液中30 min,进行DNA变性,再放入硼酸溶液中洗涤10 min,首先进行亲和素-生物素-碱性磷酸酶法染色,一抗为小鼠抗大鼠Brdu,二抗为生物素化的马抗小鼠抗体,硝基四氮唑蓝(NBT/BICP)显色,冲洗后进行亲和素-生物素-过氧化物酶法染色,一抗为兔抗大鼠突触蛋白Ⅰ抗体,二抗为生物素化的羊抗兔抗体,DAB显色,进行水洗、脱水、透明、封片。利用图像分析系统,随机观察并计数10个不重复视野的阳性细胞数目,进行分析处理。
1.8统计学处理

2 结 果
2.1时间间隔显微成像系统下观察SVZ细胞的迁移
为了动态观察SVZ细胞在活体组织上的迁移,进行了Dil在体标记SVZ细胞和脑片培养,然后在时间间隔显微成像系统下动态追踪Dil标记的SVZ细胞在活体脑片上的迁移,连续观察12 h,时间间隔显微成像系统下可见Dil标记的SVZ细胞随着时间逐渐向纹状体进行迁移(图1)。脑出血后3 d的迁移速度相对较慢,14 d的迁移速度最快,然后逐渐减慢。TPC组3 d的迁移速度明显快于脑出血组,7 d逐渐增快,14 d达高峰,21 d开始逐渐减慢,在各个时间点TPC组的迁移速度明显快于脑出血组(P<0.01)(表1)。

表 Dil标记的SVZ细胞在活体脑片上的迁移速度 (μm/h)
注:与ICH组比较,*P<0.01

图1 脑出血组和TPC组14 d Dil标记的SVZ细胞向纹状体的迁移A为脑出血组;B为TPC组。A和B图中的箭头指同一个Dil标记的SVZ细胞在观察期间随着时间向纹状体迁移。LV= lateral ventricle (侧脑室)
2.2Brdu和突触蛋白Ⅰ免疫组织化学双标染色
为了明确迁移至损伤区的新生SVZ细胞是否具有与其他细胞形成突触的能力,我们进行了Brdu和突触蛋白Ⅰ免疫组织化学双标染色(图2~图3)。脑出血后3 d纹状体没有明显的Brdu和突触蛋白Ⅰ双标阳性细胞,7 d可见少数阳性细胞,14 d阳性细胞达高峰,21 d开始下降。TPC组3 d可见明显的Brdu和突触蛋白Ⅰ双标阳性细胞,7 d阳性细胞数进一步增加,14 d达高峰,持续至21 d,28 d开始下降,在各个时间点TPC组的阳性细胞数较脑出血组明显增加(P<0.01),TPC使新生SVZ细胞突触蛋白Ⅰ的表达出现时间更早,持续时间更长。

图2Brdu和突触蛋白Ⅰ免疫双标染色的表达过程与脑出血组和对照组比较,*P<0.01;与对照组比较,#P<0.01,△P>0.05
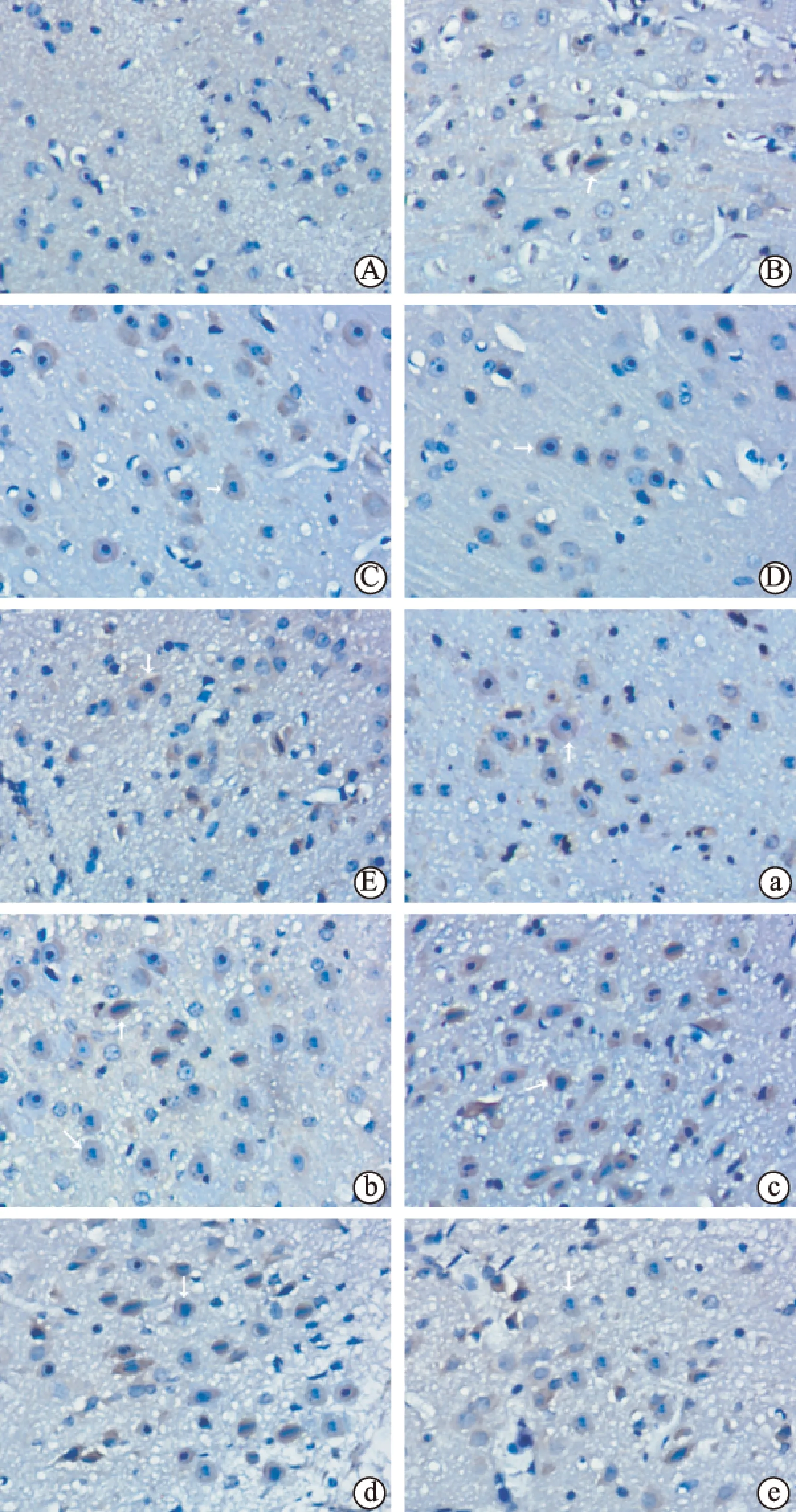
图3Brdu和突触蛋白Ⅰ免疫组织化学双标染色Brdu免疫染色位于细胞核(蓝色),突触蛋白Ⅰ免疫染色位于细胞浆(棕色);箭头指Brdu和突触蛋白Ⅰ免疫双标阳性细胞;(A~E): 脑出血组在各个时间点Brdu和突触蛋白Ⅰ免疫双标阳性细胞的分布,A为3 d; B为7 d; C为14 d; D为21 d; E为28 d;(a~e): TPC组在各个时间点Brdu和突触蛋白Ⅰ免疫双标阳性细胞的分布,a为3 d; b为7 d; c为14 d; d为21 d; e为28 d
3 讨论
脑出血是一种较常见的致死性卒中亚型,幸存者常遗留明显的神经功能障碍[14]。内源性神经再生的发现给脑出血的治疗带来新的希望。脑内两个主要区域存在内源性神经再生,即侧脑室下带和海马齿状回。近年来的研究显示脑缺血后可出现内源性神经再生,新生的SVZ细胞可向损伤区域迁移,并且可分化成有功能的神经细胞并入损伤脑组织[15-16]。研究显示脑出血后存在内源性神经再生[17-19],但是脑出血后新生的细胞只有少数能够存活,大部分细胞在短期内死亡,不能与其他细胞建立突触联系,并入神经传导通路,达到改善神经功能的目的,因此如何增强脑出血后内源性神经再生对于改善功能至关重要。
我们的前期研究显示脑出血后存在内源性神经再生,TPC能够增强脑出血后的内源性神经再生[5-6]。为近一步观察TPC对脑出血后SVZ细胞迁移的影响,本研究应用Dil在体标记SVZ细胞。Dil是一种荧光染料,可以渗入细胞膜的脂质双分子层,不在细胞间进行扩散,对细胞无损伤作用。将进行Dil标记的活体脑片进行培养,然后应用时间间隔显微成像系统。在活体脑片上动态追踪Dil标记的SVZ细胞,研究显示Dil标记的SVZ细胞随着时间逐渐向纹状体进行迁移。TPC组的迁移速度明显较脑出血组快,提示TPC可能上调某些因素,从而促进SVZ细胞的迁移。
正常情况下SVZ细胞通过嘴侧迁移流至嗅球,分化成中间神经元。脑出血后新生的SVZ向损伤的纹状体进行迁移。近年来时间间隔显微成像系统已成功地记录了脑内细胞的迁移[20],但是既往大多数研究使用固定的组织切片,固定组织切片有一定局限性,不能显示细胞迁移的真实情况。本研究提供了脑出血后SVZ细胞向损伤区域迁移的直接证据。但是脑片培养和体内组织存在一定的区别。首先,脑片培养时营养的供给可能不充分;其次,在脑片上细胞的移动可能受到部分限制;第三,脑片上没有血流,这一点与体内完全不同。所有这些因素可能会影响细胞的迁移速度。
迁移至损伤区域的SVZ细胞是否能够分化成有功能的神经细胞,与其他神经细胞建立突触联系,整合至神经环路,这对于改善神经功能至关重要。本研究显示脑出血后3 d,纹状体没有明显的Brdu和突触蛋白Ⅰ双标阳性细胞,7 d可见少数阳性细胞,14 d阳性细胞达高峰,21 d开始下降。TPC组3 d时可见明显的Brdu和突触蛋白Ⅰ双标阳性细胞,14 d达高峰,一直持续至21 d,然后开始下降,在各个时间点TPC的阳性细胞数较脑出血组明显增加,说明TPC能够促进突触蛋白Ⅰ的表达, TPC使新生SVZ细胞突触蛋白Ⅰ表达时间出现的更早,持续时间更长。突触蛋白Ⅰ是突触前蛋白,调节突触囊泡内神经递质的释放,突触蛋白Ⅰ对于突触的功能非常重要。本研究表明迁移至损伤区域的SVZ细胞具有形成突触的能力,TPC对其有增强促进作用。
本研究显示TPC能够增强脑出血后SVZ细胞迁移和分化能力,但其机制尚不明确。高浓度的凝血酶对脑组织有损伤作用,低浓度的凝血酶对脑组织有保护作用。凝血酶可激活许多细胞内信号传导途径。证据显示凝血酶能够激活神经再生[21]、血管再生[22]和神经可塑性[23],能够促进内皮祖细胞的分化。此外,凝血酶能够增强胶质细胞神经生长因子的合成和分泌,促进胶质细胞的增生[24],促进血管内皮生长因子的分泌[25]。TPC增强脑出血后内源性神经再生的准确机制尚需进一步研究,对其机制的理解有助于进一步改善损伤部位新生神经元的存活和分化。
[1]Xi GH,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage[J].The Lancet Neurology,2006,5(1):53-63.
[3]Kojima T,Hirota Y,Ema M,et al.Subventricular zone-derived neural progenitor cells migrate along a blood vessel scaffold toward the post-stroke striatum[J].Stem Cells,2010,28(3):545-554.
[4]Mart -F bregas J,Romaguera-Ros M,G mez-Pinedo U,et al.Proliferation in the human ipsilateral subventricular zone after ischemic stroke[J].Neurology,2010,74(5):357-365.
[5]关景霞,解燕春,周琴,等.实验性脑出血SVZ细胞再生的实验研究[J] .卒中与神经疾病, 2010,17(5):274-276.
[6]关景霞,张少锋,袁振华,等.凝血酶预处理对大鼠脑出血后内源性神经再生的影响[J].卒中与神经疾病,2015,22(5):259-262.
[7]Hua Y,Keep RF,Hoff JT,et al.Brain injury after intracerebral hemorrhage: the role of thrombin and Iron[J].Stroke,2007,38(2 Suppl):759-762.
[8]Liu CM,Shi BZ,Zhou JS.Effects of thrombin on the secondary cerebral injury of perihematomal tissues of rats after intracerebral hemorrhage[J].Genetics and Molecular Research,2014,13(2):4617-4626.
[9]Babu R,Bagley JH,Di C,et al.Adamson C[J].Thrombin and hemin as central factors in the mechanisms of intracerebral hemorrhage-induced secondary brain injury and as potential targets for intervention.Neurosurg Focus,2012,32(4):E8.
[10]Guan JX,Sun SG,Cao XB,et al.Effect and mechanism of thrombin on blood brain barrier permeability[J].J Chin Med,2004,117(11):1677-1681.
[11]Guan JX,Sun SG,Cao XB,et al.A study on PAR-1 expression around hemotoma after intracerebral hemorrhage in rats[J].Journal of Huazhong University of Science and Technology,2004,24(3):266-268.
[12]Song S,Hu H,Hua Y,et al.Thrombin preconditioning reduces iron-induced brain swelling and brain atrophy[J].Acta Neurochir Suppl,2011,111(33):219-223.
[13]Hua Y,Keep RF,Hoff JT,et al.Thrombin preconditioning attenuates brain edema induced by erythrocytes and Iron[J].J Cereb Blood Flow Metab,2003,23(12):1448-1454.
[14]Aronowski J,Zhao X.Molecular pathophysiology of cerebral hemorrhage: secondary brain injury[J].Stroke,2011,42(6):1781-1786.
[15]Kuge A,Takemura S,Kokubo Y,et al.Temporal profile of neurogenesis in the subventricular zone, dentate gyrus and cerebral cortex following transient focal cerebral ischemia[J].Neurol Res,2009,31(9):969-976.
[16]Mart -F bregas J,Romaguera-Ros M,G mez-Pinedo U,et al.Forebrain neurogenesis after focal ischemic and traumatic brain injury[J].Neurobiol Dis,2010,37(2):267-274.
[17]Masuda T,Isobe Y,Aihara N,et al.Increase in neurogenesis and neuroblast migration after a small intracerebral hemorrhage in rats[J].Neurosci Lett,2007,425(2):114-119.
[18]Yan YP,Lang BT,Vemuganti R,et al.Persistent migration of neuroblasts from the subventricular zone to the injured striatum mediated by osteopontin following intracerebral hemorrhage[J].J Neurochem,2009,109(6):1624-1635.
[19]Otero L,Zurita M,Bonilla C,et al.Endogenous neurogenesis after intracerebral hemorrhage[J].Histol Histopathol,2012,27(3):303-315.
[20]Kakita A GJ,Dynamics of SVZ Cell Migration in the Postnatal Forebrain:Monitoring Living Progenitors in Slice Preparations[J].Neuron,1999,23(3):461-472.
[21]Yang SX,Song SJ,Hua Y,et al.Effects of thrombin on neurogenesis after intracerebral hemorrhage[J].Stroke,2008,39(7):2079-2084.
[22]Zhou HJ,Tang T,Cui HJ,et al.Thrombin-triggered angiogenesis in rat brains following experimental intracerebral hemorrhage[J].J Neurosurg,2012,117(5):920-928.
[23]Yang Y,Zhang M,Kang X,et al.Thrombin-induced microglial activation impairs hippocampal neurogenesis and spatial memory ability in mice[J].Behav Brain Funct,2015,11(1):30.
[24]Mufti RE,Sarker K,Jin Y,et al.Thrombin enhances NGF-mediated neurite extension via increased and sustained activation of p44/42 MAPK and p38 MAPK[J].PLoS One,2014,9(7):e103530.
[25]Belling F,Ribeiro A,W rnle M,et al.PAR-1 mediates the thrombin-induced mesothelial cell overproduction of VEGF and PAI-1[J].Int J Artif Organs,2013,36(2):97-104.
(2016-01-06收稿2016-05-16修回)
The Effect of thrombin preconditioning on migration and differentiation of subventricular zone cells after intracerebral hemorrhage in rats
GuanJingxia,XieYanchun,ZhangShaofeng,etal.
DepartmentofNeurology,RenminHospitalofWuhanUniversity,Wuhan430060
ObjectiveTo investigate the effect of thrombin preconditioning (TPC) on the migration and differentiation of subventricular zone (SVZ) cells in rats after intracerebral hemorrhage (ICH).Methods90 Male Sprague-Dawley rats were randomly divided into 3 groups (ICH, TPC and control group). Rats of each group were randomly divided into 5 subgroups (3 d, 7 d, 14 d, 21 d, 28 d subgroup). ICH was caused by intrastrial stereotactic administration of collagenase type IV. Brdu was used to label newborn SVZ cells. To dynamically observe the migration of SVZ cells at living brain tissue, brain slices were cultured. Migration of Dil-labeled SVZ cells in living brain slice was traced by time-lapse microscopy. To assess whether SVZ cells migrating to injured striatum had the ability to form synapses with other cells, the brain slices from each group were double immunolabeled with Brdu and synapsinⅠ.ResultsMigration of Dil-labeled SVZ cells to the striatum in brain slices in each group was dynamically observed and imaged by time-lapse microscopy during a 12 hour period. The velocity of migration of Dil-labeled SVZ cells in the TPC group was 4.23±0.25 m/h in the 3-day group, 6.53±0.37 m/h in the 7-day group, 8.23±0.47 m/h in the 14-day group, 7.05±0.31 m/h in the 21-day group, and 5.29±0.20 m/h in the 28-day group respectively. The velocity of migration in the TPC group was faster than that in the ICH group with significant statistic difference (P<0.01).The numbers of Brdu and synapsin positive cells were markedly increased in the ipsilateral striatum at 3 days after TPC, peaked at 14 days (P<0.01), continued to 21 days, and then gradually decreased at 28 days. At 3 days after ICH, all of the Brdu-positive cells in the ipsilateral stratum were not synapsinⅠ-positive cells. At 7 days after ICH, the minority of Brdu-positive cells were synapsinⅠ-positive cells. Colocalization of Brdu with synapsinⅠ peaked at 14 days and then gradually decreased. There was significant statistic difference between the ICH group and TPC group at each time point (P<0.01). TPC made colocalization of Brdu and synapsinⅠ appear earlier and continue for a longer time compared to the ICH group.ConclusionOur results demonstrated TPC could promote the migration and differentiation of SVZ cells after ICH, which may provide a new idea for enhancing endogenous neurogenesis.
Intracerebral hemorrhageSubventricular zoneThrombin preconditioning
国家自然科学基金资助项目(项目批准号为81301010)
430060武汉大学人民医院神经内科[关景霞解燕春张少锋袁振华黄婷婷卢祖能(通信作者)]
R743.34
A
1007-0478(2016)04-0232-05
10.3969/j.issn.1007-0478.2016.04.004
