高效液相色谱法测定马铃薯中绿原酸和原儿茶酸
2016-09-13程丽林张长峰王庆国
程丽林,张长峰,王庆国
(1.山东省农产品贮运保鲜技术重点实验室,山东济南 250103;2.山东农业大学食品科学学院,山东泰安 271018)
高效液相色谱法测定马铃薯中绿原酸和原儿茶酸
程丽林1,2,张长峰1,王庆国2,*
(1.山东省农产品贮运保鲜技术重点实验室,山东济南 250103;2.山东农业大学食品科学学院,山东泰安 271018)
目的:建立高效液相色谱法测定马铃薯块茎中绿原酸和原儿茶酸的含量,并测定了两种马铃薯贮藏期间绿原酸、原儿茶酸含量的变化。方法:采用高效液相色谱法梯度洗脱,使用反相C18色谱柱,以1%甲酸水溶液和100%甲醇为流动相,流速为0.8 mL/min,柱温:40 ℃,在326、280 nm波长处分别对绿原酸和原儿茶酸进行测定。结果:绿原酸、原儿茶酸分别在50~500、200~1000 μg/mL范围内与峰面积线性良好,相关系数分别为0.9999、0.9992;精密度RSD均小于0.35%,稳定性RSD均小于1.68%,绿原酸、原儿茶酸重复性RSD分别为2.07%、3.58%,绿原酸、原儿茶酸平均加样回收率分别为98.29%、97.81%,RSD分别为1.46%、1.31%(n=5)。结论:该方法线性范围宽,分离效果好,快速、准确,可用于马铃薯块茎中绿原酸和原儿茶酸含量的测定。
高效液相色谱法,马铃薯,绿原酸,原儿茶酸
马铃薯,茄科茄属,是继水稻、小麦、玉米之后的四大粮食作物之一[1]。马铃薯块茎除含有丰富的淀粉、蛋白质、多种维生素和无机盐成分外,还含有丰富的酚酸物质[2-3]。酚酸物质多为对羟基苯甲酸和对羟基肉桂酸的衍生物,是一类广泛存在于植物体内的次生代谢产物,具有一定的抗氧化能力[2]。马铃薯块茎中的酚酸类化合物包括绿原酸、原儿茶酸、咖啡酸、香草酸、芥子酸、没食子酸、丁香酸、对香豆酸、阿魏酸、水杨酸、桂皮酸等多种成分[4]。其中绿原酸、原儿茶酸为马铃薯酚酸的主要成分[5]。酚酸物质其中的一种氧化反应就是酶促褐变,马铃薯鲜切后易发生褐变,而马铃薯中主要的酚酸物质是绿原酸、原儿茶酸,所以绿原酸、原儿茶酸含量的变化可能有褐变相关[6]。
目前,分析酚酸的方法有紫外分光光度法(UV)[7]、薄层层析法(TCL)[8-9]、高效液相色谱法(HPLC)[10-11]和高效毛细管法[12]等。应用较多的是紫外分光光度法和高效液相色谱法。张建华[13]建立了高效液相色谱法测定马铃薯块茎中绿原酸的含量。Therese M. Work[14]报道了采用高效液相色谱法测定了加工马铃薯中总酚的含量。Pirjo Mattila和Jarkko Hellström[15]采用HPLC测定了马铃薯、蔬菜中酚酸的含量。
本文建立了高效液相色谱法测定马铃薯中绿原酸、原儿茶酸含量。并采用该方法测定了克新4号、克新13号马铃薯鲜切后贮藏期间绿原酸、原儿茶酸含量的变化,为以后研究鲜切马铃薯绿原酸、原儿茶酸含量变化与褐变之间的关系提供了实验依据。
1 材料与方法
1.1材料与仪器
供试马铃薯由黑龙江农业科学院克山马铃薯研究所李庆全助理研究员提供,品种为克新4号、克新13号,于2013年10月收获,选择大小均一,无病虫害,无机械损伤的马铃薯为实验材料;绿原酸(Chlorogenic Acid)标准品(HPLC≥98%,批号:20140126)、原儿茶酸(Protocatechuic Acid)标准品(HPLC≥98%,批号:20140126)上海金穗生物科技有限公司;甲醇(色谱纯)、甲酸(色谱纯)美国Sigma公司。
Waters e2695高效液相色谱仪(包括四元泵、真空脱气机、柱温箱、自动进样系统、Empower色谱软件系统)美国Waters公司;反相C18色谱柱(150 mm×4.6 mm,5 μm),紫外2489检测器美国Waters公司;KQ-250B型超声波清洗器昆山市超声仪器有限公司;UniversaL 320R台式离心机德国Hettich公司;优普系列纯水制造系统城都超纯科技有限公司;EL204-IC电子天平梅特勒-托利多仪器(上海)有限公司。
1.2实验方法
1.2.1样品制备选择大小均一、无机械损伤、无绿变新鲜马铃薯克新4号和克新13号,用水清洗除去表面污物,去皮,切成5 mm的切片,切片后放在保鲜袋中,放置在3~4 ℃环境下贮藏,分别在0、1/24、2/24、4/24、12/24、2、5、8、11、14 d进行取样,将样品切碎用液氮进行冷冻处理,再放置-70 ℃超低温冰箱中进行冻存。参考Zhou,L-L[16]方法测定,有改动。将冷冻样品在液氮冷冻多功能粉碎机中打碎,称取果肉粉末0.2 g,加入0.8 mL甲醇甲酸混合(80%甲醇水溶液中含有1%甲酸)溶液,置于4 ℃冰箱中过夜浸提,浸提混合物在30 ℃下超声振荡提取30 min,然后离心(1000 r/min,30 min),剩余残渣用0.5 mL甲醇甲酸混合溶液重新提取,再离心。合并两次浸提液,进样前经脱气处理,再用0.45 μm的滤膜进行过滤。
1.2.2标准品溶液制备准确称取绿原酸、原儿茶酸标准品各5 mg和10 mg,分别置于10 mL棕色容量瓶中,加入甲醇甲酸混合溶液溶解,并稀释至刻度,得到绿原酸、原儿茶酸标准溶液。
1.2.3色谱条件色谱柱:反相C18柱(150 mm×4.6 mm,5 μm),流动相A:1%甲酸水溶液;流动相B:100%甲醇溶液;流速:0.8 mL/min,柱温:40 ℃;进样体积:10 μL;绿原酸检测波长为326 nm,原儿茶酸检测波长为280 nm。流动相梯度表见表1。

表1 梯度洗脱表
1.2.4方法线性关系实验:将配制好的0.5 mg/mL绿原酸标准溶液分别稀释为50、100、200、300、500 μg/mL,以绿原酸浓度(μg/mL)(X)为横坐标,以峰面积(Y)为纵坐标,进行线性回归分析。将配制好的1.0 mg/mL原儿茶酸标准溶液分别稀释为200、500、700、900、1000 μg/mL,以原儿茶酸浓度(μg/mL)(X)为横坐标,以峰面积(Y)为纵坐标,进行线性回归分析。精密度实验:取绿原酸标准品200 μg/mL溶液10 μL,按照1.2.3项下色谱条件,重复进样测定5次。稳定性实验:准确称取马铃薯样品,按照1.2.1进行样品制备,将样品待测液放置4 ℃冰箱中保存,分别在2、4、8、16、24 h时按照1.2.3色谱条件进行测定。重复性实验:准确称取1 g马铃薯样品5份,按照1.2.1进行样品制备和1.2.3色谱条件进行测定,重复测定5次。加样回收率实验:准确称取已知绿原酸、原儿茶酸含量的克新13号5 d的样品6份,按照1.2.1进行样品制备待测液,再分别加入绿原酸标准品(50 μg/mL)、原儿茶酸标准品(50 μg/mL)0.1、0.2、0.3 mL,制成样品溶液,按照1.2.3项下色谱条件进行绿原酸及原儿茶酸含量测定,重复5次实验,计算平均回收率及相对标准偏差。
1.2.5含量的测定在相同色谱条件下根据标准品、样品峰面积与标准品含量,计算出原始样品中绿原酸、原儿茶酸含量。
2 结果与分析
2.1线性关系实验
进行线性回归分析,得到线性回归方程为:Y=4.248×104X-2.443×104(r=0.9999),绿原酸标准品浓度在50~500 μg/mL范围内与峰面积呈良好的线性关系(如图2)。
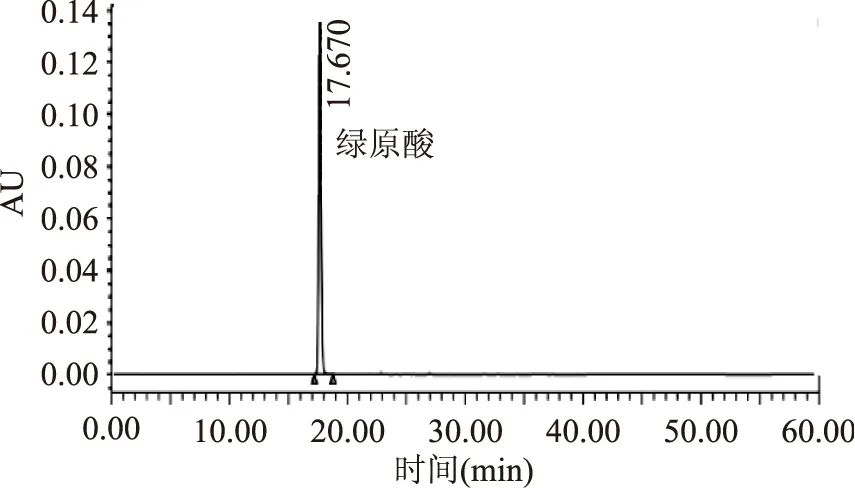
图1 50 μg/mL绿原酸标品HPLC色谱图Fig.1 HPLC for 50 μg/mL standard chlorogenic acid
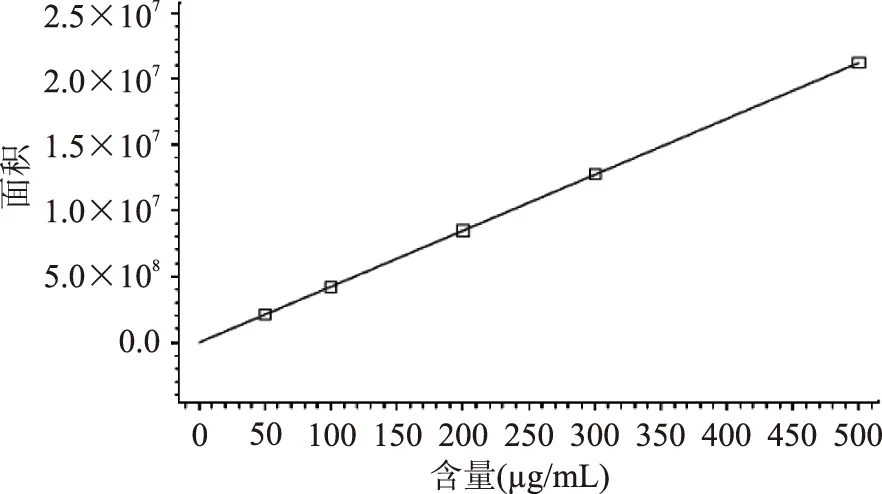
图2 绿原酸标准品HPLC的线性关系Fig.2 HPLC linear relation for standard chlorogenic acid
进行线性回归分析,得到线性回归方程为:Y=2.062×104X+2.667×105(r=0.9992),原儿茶酸标准品浓度在200~1000 μg/mL范围内与峰面积呈良好的线性关系(如图4)。
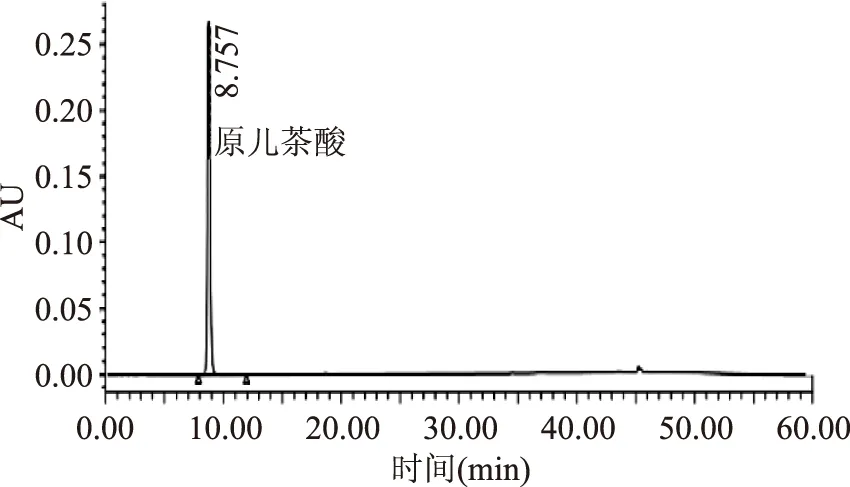
图3 200 μg/mL原儿茶酸标品HPLC色谱图Fig.3 HPLC for 200 μg/mL standard protocatechuic acid

图4 原儿茶酸标准品HPLC的线性关系Fig.4 HPLC linear relation for standard protocatechuic acid
2.2精密度实验
根据实际检测值得出,绿原酸峰面积相对标准偏差(RSD)为0.29%(n=5)。取原儿茶酸标准品700 μg/mL溶液10 μL,重复进样测定5次,根据实际检测值得出,原儿茶酸RSD为0.34%(n=5),见表2,表明仪器精密度良好。
2.3稳定性实验
测定绿原酸峰面积的RSD为0.67%,原儿茶酸峰面积的RSD为1.67%,绿原酸和原儿茶酸峰面积相对标准偏差较小,表明样品溶液至少在24 h内稳定。

表2 精密度实验结果
2.4重复性实验
测定绿原酸峰面积RSD为2.07%(n=5),原儿茶酸峰面积的RSD为3.58%(n=5),重复性RSD较低,说明方法重复性较好。
2.5加样回收率实验
结果见表3。

表3 回收率测定结果(n=5)
表3结果表明,绿原酸平均加样回收率为98.29%,RSD为1.46%,原儿茶酸平均加样回收率为97.81%,RSD为1.31%,回收率较高,相对偏差较小。
2.6样品含量的测定
采用本实验所建立的HPLC方法测定了马铃薯块茎中绿原酸和原儿茶酸含量。
图5为空白样品色谱图。图6、图7是鲜切马铃薯0 h时,绿原酸和原儿茶酸含量测定的色谱图。采用本实验所建立的HPLC法测定了克新4号、克新13号鲜切贮藏过程中0、1/24、2/24、4/24、12/24、2、5、8、11、14 d绿原酸和原儿茶酸含量的变化。结果如图8、图9。
图5 空白样品HPLC色谱图Fig.5 HPLC chromatogram for blank samples
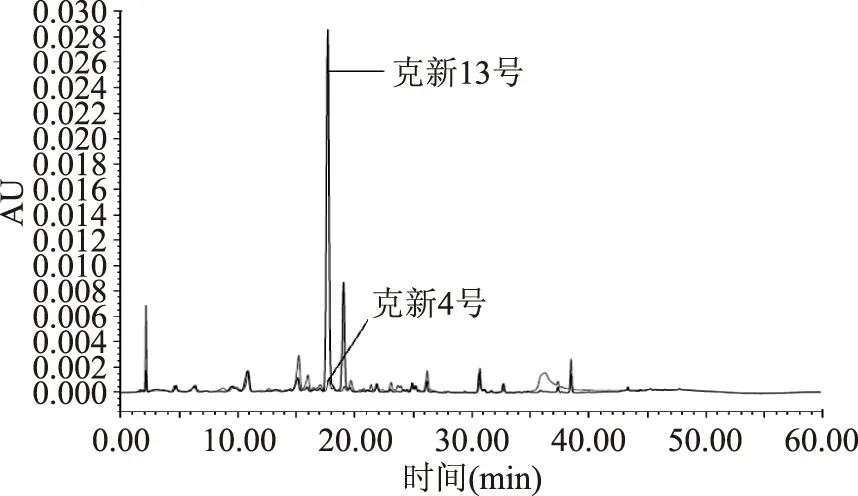
图6 绿原酸含量测定的HPLC色谱图Fig.6 HPLC chromatogram for thecontent determination of chlorogenic acid

图7 原儿茶酸含量测定的HPLC色谱图Fig.7 HPLC chromatogram for the contentdetermination of protocatechuic acid
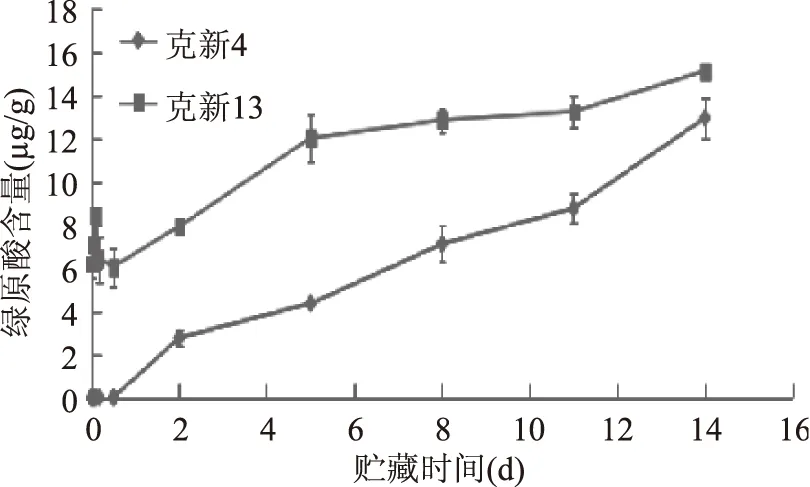
图8 克新4、克新13绿原酸含量的变化Fig.8 The change of chlorogenic acid contentin Kexin No.4 and Kexin No.13
从图8中可看出,0~12 h内,克新4号绿原酸含量为0 μg/g,2 d后克新13号绿原酸含量呈上升趋势。在整个贮藏期间,克新4号绿原酸含量始终低于克新13号。绿原酸含量在贮藏过程中呈上升趋势,主要原因是机械损伤诱发的主要次生代谢物质如各种酚类等通过苯丙烷类代谢途径生成。
从图9中可看出,克新4号0~2 h内原儿茶酸含量变化不明显,2 h后呈下降趋势,克新13号0~12 h内原儿茶酸含量变化不明显,12 h后呈下降趋势。在整个贮藏过程中,克新4号原儿茶酸含量始终高于克新13号,且整体呈下降趋势。原儿茶酸含量在贮藏过程中呈下降趋势,原因可能是原儿茶酸作为褐变底物参与了酶促褐变反应。

图9 克新4、克新13原儿茶酸含量的变化Fig.6 The change of protocatechuic acid contentin Kexin No.4 and Kexin No.13
3 结论与讨论
建立了高效液相色谱法测定马铃薯中绿原酸及原儿茶酸含量,测定了贮藏期间两种鲜切马铃薯中绿原酸、原儿茶酸含量的变化。CaoYu[17]也采用此方法测定了荷兰7号马铃薯中绿原酸、原儿茶酸的含量。本实验绿原酸、原儿茶酸在50~500、200~1000 μg/mL范围内与峰面积线性良好,相关系数分别为0.9999、0.9992,相关性较高,符合实验要求。精密度RSD分别为0.29%、0.34%,表明仪器精密度较高,稳定性RSD为0.67%、1.67%,重复性RSD为2.07%、3.58%,样品稳定性、重复性较好。
马玉荣[18]采用高效液相色谱法测定了马铃薯中主要的酚类物质,其采用甲醇提取,再进行55 ℃旋转蒸发,制得检测分析液,再在液相色谱条件下进行检测液的测定。与本文方法相比,其检测液的制备过程较繁琐。张建华[13]采用高效液相色谱法测定了马铃薯中绿原酸含量,采用甲醇超声浸提,在液相条件下进行检测分析液的测定。骆成尧[4]采用了反相高效液相色谱法测定了马铃薯中的酚酸物质,采用70%甲醇超声提取,再以甲醇-水-冰醋酸为流动相进行样品的测定。与本文方法相比,他们所采用的流动相A、B溶液配制起来较为繁琐。本方法提取较为简单,选择的流动相溶液配制方便,进行样品检测液液相操作简便,可一同测定绿原酸和原儿茶酸含量。该方法具有简单快速,线性范围宽,分离效果好,数据准确、可靠等优点,可作为马铃薯块茎中绿原酸和原儿茶酸含量测定的方法。
[1]代丽丽.转AtMYB12基因提高马铃薯中绿原酸含量的研究[D].泰安:山东农业大学,2013.
[2]张春秋.马铃薯块茎中类胡萝卜素和酚酸的研究[D].北京:中国农业科学院,2007.
[3]周胜男.马铃薯中酚类物质的提取、纯化及检测方法研究[D].合肥:安徽农业大学,2010.
[4]骆成尧,印遇龙,阮征,等.反相高效液相色谱法同时测定马铃薯块茎中酚酸类物质[J].食品科学,2011,32(18):300-303.
[5]Lewis C E,Walker J R L,Laneaster J E,et al. Determination of anthocyanins,flavonoids and phenolic acids in potatoes:Coloured cultivars of Solanum tuber,osum L[J]. Journal of the Science of Food and Agriculture,1998,77:45-57.
[6]王磊.马铃薯酶促褐变机理研究[D].南昌:南昌大学,2012.
[7]夏苗芬,周双林.紫外分光光度法测定香丹注射液中水溶性酚和酚酸的总含量[J].科技通报,2004,20(6):549-551.
[8]郭晓军,温秀军,孙朝晖,等.抗枣疯病枣树品种酚类物质的薄层层析分析[J].河北林业科技,2006,1:1-2.
[9]向昌国,李文芳,向宁,等.甘薯叶绿原酸测定方法的研究[J].食品科学,2009,30(24):279-282.
[10]翁芳华,陈建业,温鹏飞,等. 蓝莓酒中11种酚酸的高效液相色谱测定[J].食品科学,2006,27(9):223-226.
[11]蔡力创,骆成尧,罗晓燕.不同产地马铃薯果肉与皮中总酚和单体酚类物质的测定与比较[J].食品科学,2012,33(12):233-237.
[12]许虎,刘训红,傅兴圣,等.高效毛细管电泳法同时测定丹参饮片中5种酚酸类成分[J].中国药学杂志,2012,47(20):1661-1664.
[13]张建华,金黎平,谢开云,等.高效液相色谱法测定马铃薯块茎的绿原酸含量[J].食品科学,2007,28(5):301-304.
[14]Therese M Work,Mary Ellen Camire. Phenolic acid detection thresholds in processed potatoes[J]. Food Quality and Preference,1996,7(3-4):271-274.
[15]Pirjo Mattila,Jarkko Hellström. Phenolic acids in potatoes,vegetables,and some of their products[J]. Journal of Food Composition and Analysis,2007,20(3-4):152-160.
[16]Zhou L-L,Zeng H-N,Shi M-Z,et al. Development of tobacco callus cultures over expressing Arabidopsis PAP1/MYB75 transcription factor and characterization of anthocyanin biosynthesis[J]. Planta,2008,229:37-51.
[17]Yu Cao,Lili Zhou,Yanyan Feng,et al. Flesh color and phenolic metabolism in fresh cut potato products as affected by postharvest curing treatment[J]. Food Biochemistry,2014.
[18]马玉荣.鲜切马铃薯褐变控制技术研究[D].泰安:山东农业大学,2010.
Determination of chlorogenic acid and protocatechuic acid in potatoes by HPLC
CHENG Li-lin1,2,ZHANG Chang-feng1,WANG Qing-guo2,*
(1.Shandong Key Laboratory of Storage and Transportation Preservation Technology of Agricultural Products,Ji’nan 250103,China;2.College of Food Science and Engineering,Shandong Agricultural University,Tai’an 271018,China)
Objective:To establish a method of detecting the content of chlorogenic acid and protocatechuic acid in potato tuber by High Performance Liquid Chromatography(HPLC),this method was used to determine the change of chlorogenic acid,protocatechuic acid content in two species potatoes during storage. Methods:Gradient elution HPLC was used to determine chlorogenic acid and protocatechuic acid. The samples were separated by reversed-phase C18chromatographic column using 1%formic acid and 100% methanol as a mixed mobile phase. The detection wavelength was set at 326 nm and 280 nm respectively.The column temperature was set 40 ℃. Results:The calibration curves showed good linear relationship between the peak areas and concentrations was 50~500 μg/mL for chlorogenic acid,200~1000 μg/mL for protocatechuic acid,the related coefficient was 0.9999,0.9992. The RSD of precision were all lower than 0.35%. The RSD of stability were all lower than 1.68%. The RSD of repeatability was 2.07% for chlorogenic acid,3.58% for protocatechuic acid. Standard addition recovery of chlorogenic acid,protocatechuic acid was 98.29%,97.81% with relative standard deviation(RSD)of 1.46%,1.31%(n=5). Conclusion:The method was rapid,accurate with wind linear range and good separation results,which was suitable for the analysis of chlorogenic acid,protocatechuic acid in potato tuber.
HPLC;potato;chlorogenic acid;protocatechuic acid
2015-12-10
程丽林(1987-),女,硕士,研究方向:采后生理及技术,食品加工与安全,E-mail:chengll0816@163.com。
王庆国(1965-),男,硕士,教授,研究方向:采后生理及技术,E-mail:wqgyyy@126.com。
农产品品控物流关键技术装备研发与应用(2014zzcx02701);山东省科技发展计划“马铃薯物流保鲜关键技术及新产品研发与应用”(2014GNC113008);山东省现代农业产业技术体系薯类产业创新团队产后贮藏加工岗位专家(SDAIT-10-011-11)建设任务。
TS207.3
A
1002-0306(2016)13-0299-05
10.13386/j.issn1002-0306.2016.13.053
