红曲霉在类Camembert干酪生产中的应用研究
2016-09-13孙颜君孙颜杰
孙颜君,孙颜杰
(1.乳业生物技术国家重点实验室,光明乳业股份有限公司,上海乳业生物工程技术研究中心,上海 200436;2.新乡医学院三全学院,河南新乡 453000)
红曲霉在类Camembert干酪生产中的应用研究
孙颜君1,孙颜杰2
(1.乳业生物技术国家重点实验室,光明乳业股份有限公司,上海乳业生物工程技术研究中心,上海 200436;2.新乡医学院三全学院,河南新乡 453000)
从红曲类食品中分离出一株高产色素,不产桔霉素的红曲霉菌种R-15,以红曲霉R-15替代白霉用于类Camembert干酪生产。以传统Camembert干酪为对照,研究红曲霉R-15对类Camembert干酪成熟过程中(28 d)水分含量、pH、蛋白水解程度和挥发性风味物质的影响。结果表明,成熟过程中,对照和红曲霉干酪表皮和中心的水分含量不断降低,并在接近28 d时趋于稳定;两种干酪pH在干酪成熟过程中先降低后升高,且干酪表皮pH以及变化范围都显著大于中心部位(p<0.05);成熟后期,对照样品的表皮和中心处pH4.6 酸可溶性氮含量分别显著高于红曲霉干酪(p<0.05),且成熟14~21 d期间,两种干酪的12%三氯乙酸可溶性氮含量增加速率最快。红曲霉干酪成熟过程中产生主要挥发性物质共35种,包括酮类、醛类、酸类、醇类和酯类等,各类物质的种类和含量都有别于对照样品。
红曲霉,类Camembert干酪,蛋白水解,挥发性风味物质
Camembert干酪是世界上最著名的干酪之一,为一种软质的表面霉菌成熟干酪,起源于法国诺曼底。Camembert生产工艺包括原料乳杀菌、接种发酵、凝乳、切割、入模、排除乳清、盐浸、接种霉菌发酵剂和成熟等工序[1]。卡门培尔干酪青霉(Penicillium)和白青霉(Pencilliumcandidum)是Camembert干酪中特有的霉菌,用于促进干酪成熟,有助于干酪形成柔软的质地和特有的风味[2]。由于饮食和消费习惯差异,亚洲消费者对于天然干酪,尤其是天然霉菌干酪的接受程度较低,市场容量较小。
关于Camembert干酪,国内外已有大量的研究,主要集中于成熟过程中干酪的理化和风味变化。关于Camembert干酪成熟用霉菌也有一定的研究,刘南[3]等从中国传统食品——腐乳和臭豆腐中筛选出了六株霉菌,并确定了适合制作Camembert干酪的一株毛霉和帚状地霉,这两株霉菌混合成熟的干酪质地柔软,且比国外采用Penicillium和Pencilliumcandidum生产的干酪风味更柔和,更能被中国人接受。
红曲霉在中国已有上千年的应用历史,主要用于红曲米(粉)、红曲酒和醋等传统食品,红曲类产品因其天然红色的色泽、特有的风味广受中国消费者欢迎。近年来,红曲霉发酵产生的次级代谢产物由于具有降低胆固醇、降血压等功效而备受关注,主要次级代谢产物有莫纳克林K,γ氨基丁酸等[4]。因此可考虑将红曲霉替代其他霉菌用于Camembert干酪的生产,制作出一款适合亚洲消费者口味和具有中国特色的天然干酪产品。这不仅丰富了天然干酪的品类,且对于中国天然干酪的开发具有重要意义。目前尚未有任何关于红曲霉应用于天然干酪的研究。本实验从中国传统红曲产品中筛选出一株高色素无桔霉素毒素的菌株,研究其在干酪成熟过程中对Camembert干酪理化和风味的影响,为红曲霉在天然干酪中的应用研发提供基础。
1 材料与方法
1.1材料与仪器
新鲜牛乳光明乳业华东中心工厂;红曲米粉福建咕咕鲜食品有限公司;红曲米浙江农家采集;酵母粉葡萄糖氯霉素琼脂(YGC)培养基和马铃薯葡萄糖培养基(PDB)青岛瑞水生物科技有限公司;Camembert专用乳酸发酵剂(MA14),Camembert专用霉菌发酵剂(PC12 和GEO17)和凝乳酶Marzyme 150丹尼斯克(中国)有限公司。
干酪槽,干酪切割刀和干酪模具APV中国有限公司;恒温恒湿培养箱上海一恒科技有限公司;pH计梅特勒-托利多仪器(上海)有限公司;Foss2300全自动凯氏分析定氮仪瑞典福斯分析仪器有限公司;奥林巴斯光学显微镜IX71日本奥林巴斯株会社;水分测定仪奥豪斯仪器(上海)有限公司;5975GC/MS气质联用仪美国安捷伦科技有限公司。
1.2实验方法
1.2.1桔霉素含量测定参考标准GB/T 5009.222《红曲类产品中桔青霉素的测定》[5]。
1.2.2色价的测定参考标准GB 4926-2008 《食品添加剂红曲米(粉)中色价的测定方法》[6]。
1.2.3红曲霉的培养和形态学鉴定从不同地域采集的红曲产品中分离红曲霉15株,在YGC培养基上进行连续多次划线分离,挑选早期菌落为白色,后期为红色或者紫色的单菌落,编号分别为R1-R15,挑取单菌落于YGC平面培养基中培养3 d(30 ℃),观察菌体生长状态,并在显微镜下观察菌株形态。同时进行YGC斜面培养红曲霉菌株,30 ℃培养10 d,培养结束后在斜面上加入少量灭菌生理盐水,并用玻璃珠进行震荡以洗脱孢子,取孢子悬浮液稀释一定梯度后,吸取少量加入PDB培养基中,在30 ℃,180 r/min下培养10 d后取发酵液测定桔霉素和色素。
1.2.4菌株的鉴定采用聚合酶链式反应(Polymerase Chain Reaction,PCR)方法进行回收产物纯化后测序。根据杨成龙[7]已经报道的红曲霉特异性引物ITS 基因扩增:ITS 序列采用通用引物 ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGC TTATTGATATGC)进行扩增。PCR扩增28S rDNA转录间隔区目的片段。ITS-PCR扩增程序为:96 ℃预变性 1 min;96 ℃变性 30 s,50 ℃退火30 s,72 ℃延伸90 s,共35 个循环;72 ℃延伸 10 min;4 ℃保存。PCR产物回收后测定,PCR产物测序委托生工生物工程(上海)有限公司完成。
1.2.5表面霉菌成熟干酪的制作
1.2.5.1霉菌孢子悬浮液的制备Penicillium和R15都于PDA斜面培养基30 ℃培养7 d,直至孢子生成。用无菌水冲洗斜面,经八层无菌纱布过滤,并利用血球计数板将孢子浓度调为106/mL。
1.2.5.2干酪制作工艺传统Camembert干酪制作参考Boutrou和Linton[8]等的方法,工艺流程如下:
新鲜牛奶→巴氏杀菌(72 ℃,15 s)→冷却至32 ℃→接种发酵剂→待pH下降0.2后添加凝乳酶,凝乳30~40 min→切割排乳清→成型(15 ℃,相对湿度90%~95%过夜)→盐渍→接种霉菌(孢子数为106/mL)→成熟28 d(15 ℃,相对湿度90%~95%)。
如上工艺得到的Camembert干酪作为对照样品。红曲霉干酪制作参考如上工艺并略加调整,其接种霉菌孢子数为106/mL的R15发酵液,并于25 ℃,相对湿度90%~95%条件下成熟28 d。
1.2.6干酪成熟过程中指标的测定在Camembert干酪成熟过程中,霉菌只在干酪表面生长,因此干酪表面和内部呈现不同的性质。具体参考IDF NO 261[9]中干酪取样方法(图1),将一块干酪根据成熟情况分为中心(A处)和表皮(B处)两个部位,于A和B处分别取样进行分析。

图1 干酪取样示意图Fig.1 Schematic of sampling the cheese
本研究中,白霉干酪的中心部位简称CC,边缘部位CR;红曲霉干酪的中心部位RC,边缘部位RR。
1.2.6.1pH测定干酪的表皮和中心各取1 g样品,将样品与10 mL蒸馏水混合并用高速剪切机于12000 r/min下剪切1 min,成为干酪浆,测定干酪浆的pH。
1.2.6.2水分含量的测定采用水分测定仪进行测试,干酪表皮和中心分别取样3 g,置于干燥恒重的铝箔盘上。测定温度为180 ℃,读数稳定后,记录样品的水分含量,每个样品测定三次并取平均值作为最终测定结果。
1.2.6.3pH4.6酸可溶性氮(pH4.6 acid-soluble nitrogen,pH4.6 ASN)的测定方法参考孙卓等的方法略加改进[11]。准确称取1.5 g干酪,加入50 mL pH为4.6 的醋酸盐缓冲液,采用高速剪切机在12000 r/min条件下剪切1 min,再用50 mL的缓冲液冲洗,悬浮液在4000 r/min的离心机中离心20 min。取上清液进行凯氏微量定氮,并以占干酪总氮量的百分数表示。进行三次平行实验,结果为平均值。
1.2.6.412%三氯乙酸溶液中可溶性氮(12% Trichloroacetic acid,12% TCA-SN)的测定方法参考孙卓等的方法略加改进[11]。准确称取1.5 g干酪,加入25 mL 12%的TCA溶液,匀浆。再用25 mL的缓冲液充分冲洗,取上清液进行微量凯氏定氮,并以占干酪总氮量的百分数表示。进行三次平行实验,结果为平均值。
1.2.6.5干酪成熟期间风味物质的测定样品处理:分别在干酪成熟期的1、7、14、21和28 d取样,进行冷冻干燥后与等量的无水Na2SO4混合碾碎至样品混合物为粉状,迅速将样品装入15 mL的样品瓶内,制备后加盖封口。将SPME 萃取头在气相色谱进样口老化2 h(温度250 ℃),将老化好的萃取头插入样品瓶顶空部分,在60 ℃条件下超声波萃取30 min,按以下条件进行GC-MS 分析。
色谱条件:分离柱:OV1701,30 m×0.25 mm×0.25 μm;进样口温度:250 ℃;载气:He;载气流速:0.8 mL/min程序升温:33 ℃,3 min;以10 ℃/min升至42 ℃;以5 ℃/min升至140 ℃;以18 ℃/min升至240 min,保持8 min。质谱条件:离子源温度:200 ℃;传输线温度:250 ℃;检测气电压:350 V;离子化模式:EI+;发射电流200 μA;电子能:70 eV;数据采集:全扫描。
数据分析:采用Agilent G1701 MSD Productivity Chemstation工作站进行图谱的定量分析。
1.3数据分析和处理
每组实验重复测定3次,最后结果以均值+标准方差(mean±SD)表示。采用SPSS 18.0软件对实验结果在p<0.05水平上的显著性进行分析。
2 结果与分析
2.1红曲发酵液中桔霉素和色价测定
红曲米中分离出的15株红曲霉菌株发酵过程中产生的桔霉素和色价如表1。

表1 红曲霉发酵液中桔霉素和色素含量
注:“-”表示含量过低或未检出。
红曲色素作为添加剂在各类食品中有着广泛的应用。近年来,红曲色素广泛应用于发酵香肠中,用来替代亚硝酸盐,提高了产品的安全性[12]。早在1931年,桔霉素已被证实可损害人体健康,其毒性可与黄曲霉毒素B1相提并论[13]。由表1可知,相同培养条件下,不同红曲霉菌株的产色素和桔霉素能力不同。除菌株R-15外,其余菌株都产生桔霉素,R-13和R-8产桔霉素含量较高,分别为483 μg/L和247 μg/L。R-14产色素能力最好,R-13次之,两者色价分别为5.75 U/mL和5.69 U/mL。对不同红曲霉产桔霉素和色价含量进行方差分析,结果表明在0.05水平上差异显著(p<0.05)。R-15用于干酪生产,在28 d成熟周期中,并未有桔霉素检出,因此R-15认为是安全的,可用于干酪的成熟。
红曲色素和桔霉素都属于红曲霉发酵后期产生的次级代谢产物,两者的代谢途径开始都由一个乙酰辅酶A的参与下合成戊酮,随后分开为两条途径,一条由丁酮在丙二酰辅酶A的参与下合成戊酮,最后产生红曲色素;另一条途径由丁酮在乙酰辅酶A的参与下合成桔霉素中间体,最后产生桔霉素,因此红曲色素产生常伴随着桔霉素的产生[13]。
本研究中选用PDB培养基来研究红曲霉产桔霉素情况,但仅用一种培养基不足以评价红曲霉产毒素情况。不同的培养条件下,红曲霉产生红曲色素和桔霉素的能力也有差异。如改变培养基的氮源、加入短链酸[14]或改变培养过程的通风量等[15]。为确保红曲干酪产品的安全性,本研究中还主要跟踪了红曲霉在干酪成熟过程中产桔霉素情况,发现R-15在干酪成熟周期中并未有桔霉素产生。
2.2菌株鉴定
2.2.1菌种形态观察R-15于YGC培养基30 ℃培养,第5 d起该菌株开始产生色素物质,菌落中心的颜色由初期的白色慢慢向红色转变,菌落四周菌丝仍为白色。培养7 d后,菌落直径约为22 mm(图2中a)。菌落为圆形,平坦而稀疏,平板正面观察菌落中间微隆起,边缘整齐,有放射状条纹,质地致密,表面有绒毛状菌丝;反面观察菌落渗入周围培养基中。

图2 红曲霉菌落(a)和孢子(b)显微观察图Fig.2 Micro-morphology of Monascus colony(a)and spores(b)
显微特征:由图2中(b),分生孢子由菌丝生出,生在侧梗或者菌丝顶端;分生孢子排列呈链状,通常2~6个向基型生长,单个孢子呈圆形或者梨形;培养过程中有闭囊壳产生,呈椭球形,单生在类似柄菌丝上。根据R-15在培养基上的形态特征和孢子的显微特征,并与红曲霉属的特征相对比,两者基本吻合,初步判定R-15属于红曲霉属的真菌。
2.2.2菌株生物学鉴定以R-15基因组为模板进行PCR扩增,得到长度为544 bp的片段,与Genbank中其他红曲霉菌株进行比对和同源性分析,并筛选相似菌株的ITS序列进行系统发育树的构建(图3)。结果表明,该菌株与红色红曲霉(Monascusrubber)、紫色红曲霉(Monascuspurpureus)、丛毛红曲霉(Monascuspilosus)都有较高的同源性。综合形态特征和ITS序列分析,鉴定R-15为紫色红曲霉。

图3 基于ITS序列构建的系统发育树Fig.3 Phylogenetic tree based on ITS sequences
2.3干酪成熟过程中指标的测定
2.3.1水分含量测定结果成熟1~20 d期间,干酪表皮和中心的水分含量不断降低,且在1~7 d下降速率最快(图4)。成熟第7 d结束,CR,CC,RR和RC水分含量分别下降至57.24%,57.65%,56.49%和56.80%。随后至21 d,水分含量进一步下降,并在接近28 d时趋于稳定,此时RR和RC的水分含量分别为52.33%和53.65%,均低于白霉干酪。整个成熟期间,两种干酪的表皮水分含量显著低于中心部位(p<0.05)。

图4 干酪成熟期间水分含量的变化Fig.4 Change of water content during ripening period
干酪的水分含量不仅影响出品率,且对奶酪成熟过程中质量的控制具有重要意义。 在1~7 d成熟期,干酪表面水分迅速蒸发,导致表皮和中心水分含量大量下降,成熟7 d后霉菌逐渐覆盖干酪表面,从而降低了表面水分蒸发率,但由于霉菌生长消耗水分,所以水分还会进一步下降。在7 d以后成熟期中,白霉干酪表皮和中心水分含量都高于红曲霉干酪,这可能是因为白霉生长情况优于红曲霉,能够更好的覆盖干酪表面,防止水分挥发。成熟20 d后,霉菌进入缓慢生长期,且干酪表面开始形成一层薄壳,干酪的表皮和中心水分含量逐渐趋于稳定。
2.3.2成熟过程干酪pH变化pH是影响干酪品质的重要因素之一,pH与干酪成熟期间质构变化密切相关。图5为干酪在28 d内的pH变化情况。成熟1~7 d中,干酪表皮和中心的pH不断下降,降低至4.2~4.3左右开始升高。两种干酪的表皮pH变化范围显著大于中心部位,如整个成熟期间,CC的pH变化幅度为1.69,CR为1.29。在成熟终点处,RR的pH显著高于RC、CC和 CR(p<0.05),而RC、CC和 CR之间pH差异不显著(p>0.05)。

图5 成熟过程中干酪表皮和中心pH变化Fig.5 pH change of cheese rind and core during the ripening period
霉菌干酪成熟过程中,pH呈现先降低后升高的趋势。 霉菌干酪成熟初期,表皮和中心的乳酸菌优先开始生长,不断的消耗干酪中脂肪和乳糖,代谢产生乳酸盐和脂肪酸,造成pH降低[16]。随着成熟时间的增加,霉菌不断在表面生长并产生蛋白水解酶,促进蛋白水解并产生较多的NH4+,造成干酪表皮pH增加,干酪表面和内部的pH形成梯度差,内部乳酸向表皮扩散,同时NH4+也会由表皮向中心渗透,内部pH逐渐上升。P. camemberti菌丝生长和孢子萌发的过程中会消耗乳酸盐,但乳酸菌生长过程中会产生乳酸盐,因此干酪表面的乳酸盐浓度会受到乳酸和霉菌孢子数的影响[17]。Leclercq P[2]研究Camembert干酪成熟发现,成熟第6 d至终点,干酪表面和中心的pH不断上升,乳酸盐浓度降低,生物胺的含量增加。
由于霉菌主要在干酪表面生长,因此干酪表面的pH变化较中心部位有更大的变化。表面霉菌成熟干酪中,pH的变化会影响干酪的质构和持水性,大量关于Camembert干酪研究已经表明,pH升高有利于霉菌干酪形成较为柔软的质地。较高的pH条件下,磷酸钙很快超出其溶解阈而在干酪表面析出,形成磷酸钙浓度梯度,中心的可溶性磷酸钙开始不断向表皮扩散并析出,从而在干酪表面形成一层较硬的外壳。而干酪内部由于Ca2+浓度降低,质地变得柔软顺滑。一些中性蛋白酶和脂肪酶的活性与pH密切相关,因此pH的改变也会影响这些酶水解蛋白和脂肪的能力,从而影响干酪的风味。由图5可知,白霉干酪的中心和表皮pH都显著高于红曲霉干酪,这也可能是造成两种干酪风味存在差异性的原因之一。
2.3.3成熟过程干酪pH4.6 ASN值变化干酪成熟前,白霉和红曲霉干酪的pH4.6 ASN值差异不显著(p>0.05)。但是随着成熟进行,CR显著高于RR(p<0.05),且成熟前7 d中,CR和RR的pH4.6 ASN增加速率较快,随后趋于平缓。由图5可知,RR的pH4.6 ASN在整个成熟周期中都高于RC;在成熟前期,CR比CC有较高的pH4.6 ASN值,但在成熟终点时两者的pH4.6 ASN逐渐接近。
表面霉菌干酪中蛋白水解会受到不同种类的蛋白水解酶影响,包括发酵剂中微生物产生酶、凝乳酶、牛乳中纤溶酶,最重要的为成熟过程中霉菌产生的内源和外源性蛋白酶。酪蛋白被蛋白酶水解后产生的肽可溶于pH4.6醋酸缓冲溶液,其他形式的氮溶解量非常少,因此可用pH4.6 ASN反映干酪成熟过程中酪蛋白水解情况[18]。CR和RR在前15 d成熟周期中pH4.6 ASN速率先增加后降低,表明此期间,主要是酪蛋白水解为长链肽。由于白霉和红曲霉只在干酪表面生长,因此干酪内部的酪蛋白水解速率处于缓慢增加状态,CC和RC直至成熟28 d后pH4.6 ASN速率才开始下降,且低于表面酪蛋白水解值。由图5可知,白霉表面和中心的pH4.6 ASN分别高于红曲霉干酪,这表明白霉比红曲霉有更强的酪蛋白水解能力。
2.3.4成熟过程干酪12% TCA-SN值变化TCA-SN可反映干酪中酪蛋白水解产生的短肽和氨基酸氮的多少。白霉和红曲霉干酪的表皮TCA-SN值在1~7 d成熟期内迅速增加,中心部位TCA-SN变化较小;在14~21 d中,两种干酪的表皮和中心TCA-SN增长速率达到最大值。由图6可知,在前7 d成熟期中,两种干酪的表皮和中心 TCA-SN程度相近,随后白霉干酪TCA-SN值增加速率迅速升高,这表明白霉干酪中产生的肽酶和氨基酸酶的活力较红曲霉强。成熟14 d后,CR的TCA-SN值大于RR;在21~28 d成熟期中,RR和RC的TCA-SN值差异逐渐减小。
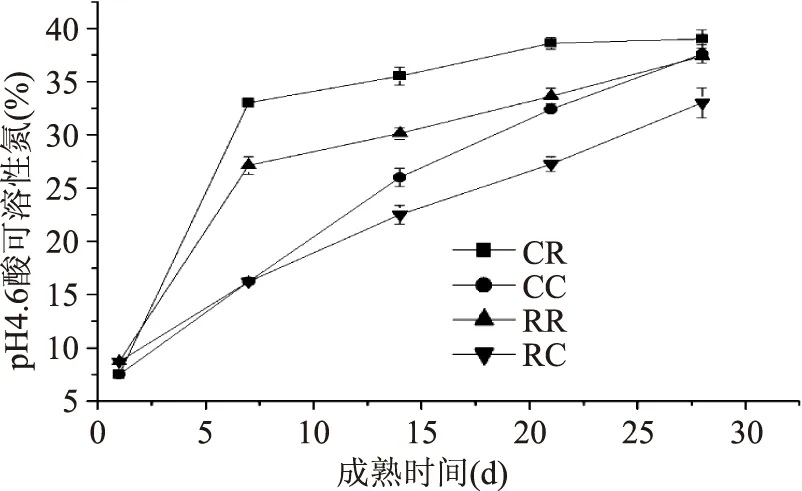
图6 成熟过程中干酪pH4.6可溶性氮含量变化Fig.6 pH4.6 acid-soluble nitrogen change of cheese during the ripening period
两种干酪的表皮和中心在成熟7~14 d周期中TCA-SN有较快的增加速率,表明此阶段酪蛋白水解产生的长链肽发生了近一步的水解,产生了短肽和氨基酸等。刘楠[3]采用毛霉和帚状地霉制作干酪,发现在0~20 d期间TCA-SN增加较为平稳,20~30 d期间增加速率最大,且在25~30 d期间增加速率大于pH4.6-SN,说明在成熟后期主要产生了短肽和小肽。酪蛋白降解产生的长链肽中,有部分疏水肽会产生苦味,从而对干酪风味产生不良影响,因此应避免这些长链肽在干酪中过高的积累,加速长链肽分解为相应的短肽和氨基酸的过程,以提高和改善干酪的风味[19]。
综上,penicillium比monascus有更强的蛋白水解能力,因此白霉干酪比红曲霉干酪有较高的TCA-SN值。霉菌产生的蛋白水解酶只在产生部位发生催化作用,而不会进行迁移,因此霉菌干酪中心部位的酪蛋白水解程度和水解速率通常较低,但肽酶等产生的小肽和氨基酸类却可以由干酪的表面向中心迁移,从而提高中心的TCA-SN值,这是红曲霉干酪成熟终点中心和表面TCA-SN逐渐接近的原因。

图7 成熟过程中干酪12%三氯乙酸可溶性氮含量变化Fig.7 12% trichloroacetic acid nitrogen change of cheese during the ripening period
2.3.5成熟过程中干酪中挥发性风味物质测定结果红曲霉干酪在成熟过程中产生的主要挥发性风味物质共35种,其中有酮类5种、醛类3种、酸类12种、醇类3种、酯类4种、内酯类3种,硫化物、杂环和烷烃类各一种。
关于白霉干酪成熟过程中风味的研究,已有大量文献报道。表2为1~4周成熟期中,红曲霉干酪各类挥发性风味物质成分所占比例。酸类物质在4周内占挥发性物质比例分别为79.62%,97.84%,93.24%和90.99%,在成熟2周时达到最大值。在4周成熟过程中,酮类物质含量先降低后增加,主要为2-辛酮。红曲霉干酪成熟初期,酯类物质占挥发性风味物质比例为16.338%,成熟4周后降低至1.565%。内酯类在整个成熟期内占比约为0.5%~2.08%,主要包括γ-十一内酯,δ-癸内酯和δ-戊内酯三种,这些内酯类在Camembert成熟期间对其风味有主要贡献,主要为水果香味,如桃子和杏的香味。在干酪成熟初期产生醛类物质,主要为苯乙醛、戊醛和十六醛三种,其中苯乙醛具有苦杏仁香味。红曲霉干酪中硫化物产生量较小,仅在成熟后期检出,约占所有挥发性风味物质比重的0.165%。酸类物质主要为肉豆蔻酸和棕榈酸,由于长链脂肪酸(>C12)的阈值较高,因此两者对于干酪的主题风味并没有主要影响。
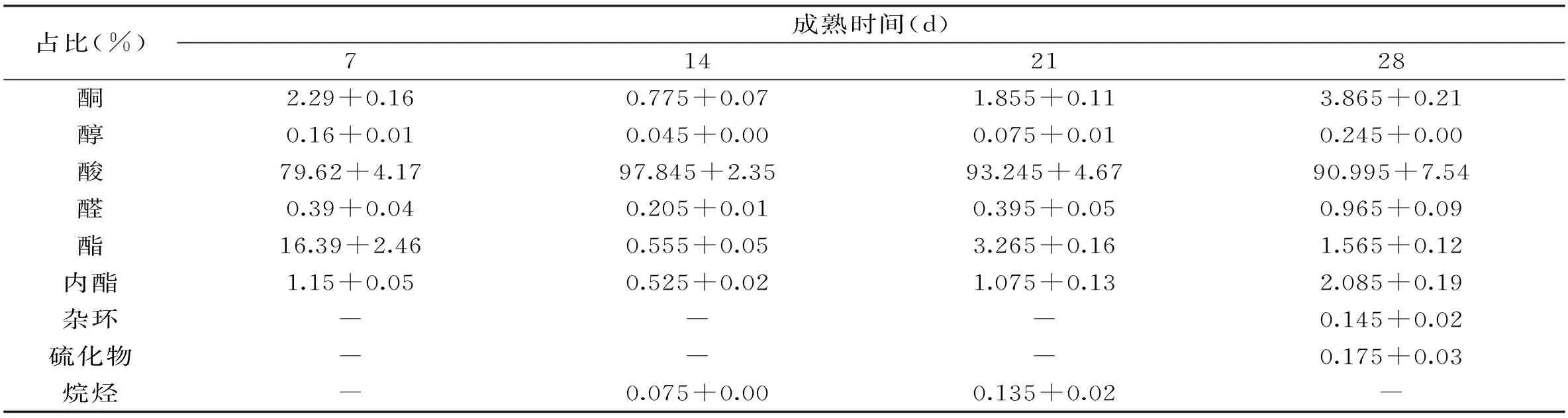
表2 红曲霉干酪成熟过程中挥发性风味物质含量
注:“-”表示含量过低或未检出。
对比文献中白霉干酪挥发性风味分析结果[20],主要是酮类、酯类和硫化物种类不同于红曲霉干酪。白霉成熟干酪如Camembert和布里干酪成熟一周后产生甲基酮。此外,Penicillium可通过β-氧化长链脂肪酸,产生2-壬酮和2-庚酮,2-庚酮会产生类似于蓝纹干酪的风味,2-壬酮具有水果香气,且白霉干酪成熟过程中产生的3-甲基-2-戊酮可赋予产品天然发酵的醇香;白霉干酪成熟过程中产生很多酯类物质,表征为水果和植物芳香,其中乙酸苯乙酯和丙酸苯乙酯对风味贡献较大。硫化物呈现大蒜的辛香味道,在Camembert干酪中,棒状杆菌被认为是产生硫化物的主要来源。硫化物含量的差异是红曲霉干酪风味较Camembert干酪风味柔和的主要原因。
3 结论
3.1红曲霉干酪成熟过程中并未检测到桔霉素含量,因此R-15可用于干酪的生产。
3.2红曲霉和Camembert干酪成熟过程中,由于蒸发作用,水分含量不断降低;白霉干酪蛋白水解速率较快,且蛋白水解率较高,这导致在成熟周期中两种干酪呈现出不同的pH、pH4.6 ASN和TCA-SN值。与白霉干酪相比,红曲霉干酪成熟过程中,产生的挥发性风味物质中主要酮类、酯类和硫化物种类不同于白霉干酪,其中硫化物产量低于白霉干酪。
[1]蒋爱民,杨小姣.卡门培尔(Camembert)干酪加工工艺研究[J]. 食品工业,2005,(1):21-23.
[2]Leclercq P,Thiverval G. Camembert,Brie,and Related varieties[J], Encyclopedia of Dairy Sciences(Second Edition),2011,773-782
[3]刘南. 毛霉和帚状地霉在类Camembert干酪中的应用[C].无锡:江南大学,2004:31-32.
[4]丘振宇,王亚琴,许喜林.红曲霉中MonacolinK的应用研究[J].中国酿造,2007,5:4-6
[5]GB/T 5009.222,红曲类产品中桔青霉素的测定[S]. 2008.
[6]GB 4926,食品添加剂红曲米(粉)中色价的测定方法[S].2008.
[7]杨成龙,陈章娥,吴小平,等. 基因组ITS序列分析鉴定红曲霉菌株[J],核农学报,2015,29(2):252-259.
[8]Boutrou R,Molle D,Leonil J. Action of the lactococal proteinase during Camembert-type curd making[J]. International dairy journal,2001(11):347-354.
[9]IDF No. 261,Chemical methods for evaluation of proteolysis in cheese maturation[S],1991.
[10]QB/T 2847,轻工标准:功能性红曲米(粉)[S],2007.
[11]孙卓. 切达干酪促进成熟方法及其质量控制技术研究[C]. 北京:青岛农业大学,2011:25-26.
[12]贾娟,张军. 红曲霉菌的应用研究[J],农产品加工:学刊,2005,1:25-28.
[13]Hassan H,Blancphili P,Grousac E,et al. Kinetic analysis of red Pigment and citrinin Production[J],Enzyme and Microbial Technology,2000,27:619-625.
[14]李燕萍,许杨,徐尔尼,等. 红曲菌的抑菌活性物质与桔青霉素[J],卫生研究,1998,27:75-78.
[15]Hassan H,Groussac E.,Gerard J,et al. Improvement of red pigment/citrinin production ratio as a function of environmental conditions by Monascus rubber[J],Biotechnology and Bioengineering,1999,64(4):497-501.
[16]Delgado F J,González C J,Cava R,et al. Changes in the volatile profile of a raw goat milk cheese treated by hydrostatic pressure at different stages of ripening[J]. International Dairy Journal,2011,21:135-141.
[17]Patrick F. Fundamentals of cheese Science[M],USA:Aspen publishers,1999:1154-1158.
[18]Sousa M J. Ardo Y,McSweeney P L H. Advances in the study of proteolysis during cheese ripening[J]. International Dairy Journal,2001,11:327-345.
[19]Hamilton J S,Hill R D,Leeuwen V. A bitter peptide from cheddar cheese[J]. Agriculture biology chemistry,1974,38(2):375-379.
[20]Sousa M J,Surface mold-ripened cheese variety, Encyclopedia of Food Microbiology(Second Edition)[M]. London:Elsevier Science Ltd.,2014:1122-1130.
Application ofMonascusin the production of camembert imitation
SUN Yan-jun1,SUN Yan-jie2
(1.State Key Laboratory of Dairy Biotechnology,Bright Dairy and Food Co.,Ltd.,Shanghai Engineering Research Center of Dairy Biotechnology,Shanghai 200436,China;2. San Quan College of XinXiang Medical University,Xinxiang 453000,China)
MonascusR-15 with high yield of red pigment and low content of citrinin was selected from monascus products. The objective of this study was to evaluate the effect of R-15 on the proteolysis and volatile of camembert imitation during the ripening period(28 days). The moisture content of all the cheeses decreased and came to a stable value at the end of ripening time. pH increased at the beginning of the ripening period and then decreased. Moreover,pH of the rind part was significantly higher than the core of the cheeses(p<0.05);As the ripening period was prolonged,camembert presented the higher value of pH4.6 ASN thanmonascuscheese;During the ripening period of 14~21 days,TCA-SN increased rapidly;About 35 kinds of volatile substances(including ketones,aldehydes,acids,alcohols and esters ect.)were produced by the monascus cheese and were quite different from the camembert.
Monascus;camembert imitation;proteolysis;volatile
2015-12-08
孙颜君(1988-),女,硕士,研究方向:乳品科学与加工,E-mail:15921569362@163.com。
“十二五”国家科技支撑计划课题(2013BAD18B02)。
TS201.3
A
1002-0306(2016)13-0167-06
10.13386/j.issn1002-0306.2016.13.025
