分散泛菌蔗糖异构酶在大肠杆菌中的表达及发酵优化
2016-09-13刘军彤吴敬陈晟
刘军彤,吴敬,陈晟
1 江南大学 食品科学与技术国家重点实验室,江苏 无锡 2141222 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
工业生物技术
分散泛菌蔗糖异构酶在大肠杆菌中的表达及发酵优化
刘军彤1,2,吴敬1,2,陈晟1,2
1 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122
2 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
刘军彤, 吴敬, 陈晟. 分散泛菌蔗糖异构酶在大肠杆菌中的表达及发酵优化. 生物工程学报, 2016, 32(8): 1070-1080.
Liu JT, Wu J, Chen S. Expression and production optimization of sucrose isomerase from Pantoea dispersa in Escherichia coli. Chin J Biotech, 2016, 32(8): 1070-1080.
为了提高分散泛菌Pantoea dispersa UQ68J来源的蔗糖异构酶产量,研究了不同信号肽及发酵条件对蔗糖异构酶在大肠杆菌中重组表达的影响。将携带天然信号肽的蔗糖异构酶基因优化后,转入大肠杆菌Escherichia coli BL21 (DE3) 构建重组表达菌株——ORI菌株,摇瓶发酵总酶活和胞外酶活分别为85 U/mL、65 U/mL。从天然信号肽开始第22位氨基酸作为成熟蛋白的起始,连接PelB或OmpA信号肽构建P22和O22菌株,其中P22菌株发酵总酶活提高至138 U/mL,是ORI菌株总酶活的1.6倍;而O22菌株发酵总酶活和ORI菌株无明显差别。采用3.0 g/L的乳糖诱导,P22菌株的蔗糖异构酶总酶活提高至168 U/mL。在3 L发酵罐中,研究甘氨酸浓度和诱导时间对蔗糖异构酶分泌的影响,当补加0.5%甘氨酸,DCW为18 g/L (OD600=30)开始诱导,P22菌株的蔗糖异构酶胞外酶活最高达1 981 U/mL,同时蔗糖异构酶总酶活达到2 640 U/mL,是已报道大肠杆菌重组表达蔗糖异构酶的最高水平。
蔗糖异构酶,信号肽,发酵优化
异麦芽酮糖 (6-O-a-D-吡喃葡糖基-D-果糖)是蔗糖的 1种同分异构体,其很多物理性质与蔗糖相似,如具有甜度、易溶于水等[1-2]。此外,异麦芽酮糖不易水解,被食用后,人体内葡萄糖和胰岛素浓度仍然维持在一定范围内,能够有效预防糖尿病,因此被看作糖尿病患者的理想食品[3-4]。目前,异麦芽酮糖作为食品添加剂,已经应用于糕点、糖果、饮料等食品领域,且需求量不断增加。然而,天然的异麦芽酮糖主要存在于蜂蜜、甘蔗汁中,其含量非常低,无法满足市场需求。工业上异麦芽酮糖主要通过蔗糖异构酶转化蔗糖来获得[5]。
蔗糖异构酶能催化蔗糖生成异麦芽酮糖和海藻酮糖,并生成少量的葡萄糖和果糖[5-7]。据文献报道,来源于大黄欧文氏菌 Erwinia rhapontici NCPPB1578[7]、大黄欧文氏菌E. rhapontici NX-5[8]、欧文氏杆菌属Erwinia sp. D12[9]、克雷伯氏肺炎菌Klebsiella pneumonia NK33-98-8[10]、红 色 精 朊 杆 菌Protaminobacter rubrum CBS574.77[11]、克雷伯氏杆菌属 Klebsiella sp. LX3[12]、普城沙雷氏菌Serratia plymuthica ATCC15928[13]、P. dispersa UQ68J[14]等的蔗糖异构酶转化蔗糖产生的主产物为异麦芽酮糖,转化率介于 65%-91%,其中来源于 P. dispersa UQ68J的蔗糖异构酶在大肠杆菌中表达,其纯酶转化率高达91.0%,是已报道的最高转化率[15]。
此外,目前报道的采用野生菌生产的蔗糖异构酶,大部分产量较低。因此,有人尝试构建重组菌株来表达蔗糖异构酶,以提高蔗糖异构酶的产量。目前,E. rhapontici NX-5[8]、Klebsiella sp. LX3[12]、P. rubrum CBS574.77[11]、E. rhapontici DSM 4484[16]、肠杆菌属Enterobacter sp.FMB-1[17]、K. pneumonia NK33-98-8[10]、植生克雷伯氏菌 Klebsiella planticola UQ14S[14]来源的蔗糖异构酶都已成功在大肠杆菌中重组表达。蔗糖异构酶的表达量介于15-654 U/m L。程胜等采用高密度发酵,胞外蔗糖异构酶酶活达到654 U/m L,是目前文献报道最高的酶活[15,18]。此外,来源于Enterobacter sp. FMB-1的蔗糖异构酶还在酿酒酵母Saccharomyces cerevisiae[19]和乳酸乳球菌Lactococcus lactis MG1363[20]中重组表达,但其表达量相对较低。
Wu 筛选获得的P. dispersa UQ68J,该菌株生产的蔗糖异构酶能够高效合成异麦芽酮糖。但将去除信号肽 (1-33位氨基酸) 的蔗糖异构酶在大肠杆菌中克隆表达,可溶性蔗糖异构酶的含量很低,不利于工业化生产[14]。因此,本实验以P. dispersa UQ68J来源的蔗糖异构酶为研究对象,尝试更换信号肽提高蔗糖异构酶在大肠杆菌中的表达量,同时采用高密度发酵实现蔗糖异构酶的高产。
1 材料与方法
1.1材料
1.1.1基因和菌株
根据大肠杆菌的密码子偏好性对来源于 P. dispersa UQ68J的蔗糖异构酶完整基因 (NCBI Accession Number AY223549.1,包括信号肽和成熟肽) 进行基因优化并合成 (Generay,上海)。将合成的基因与 pMD-18T连接,转入 E. coli JM 109扩增重组质粒,利用NdeⅠ和XhoⅠ限制性内切酶酶切,经核酸电泳和基因片段纯化后,连接无信号肽的表达载体 pET-24a (+) 构建重组质粒,再将重组质粒转入E. coli JM 109进行扩增,基因测序正确后,将重组质粒转入表达宿主E. coli BL21 (DE3),获得ORI菌株 (表2)。
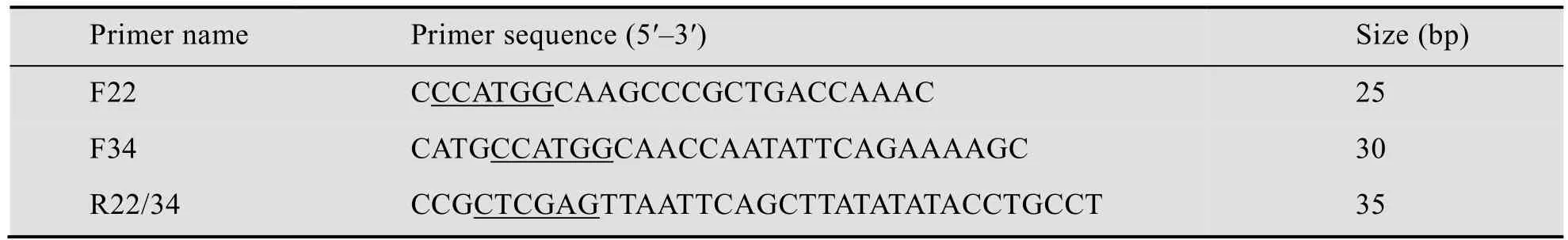
表1 更换信号肽引物Table 1 Primers used in changing signal pep tides

表2 构建的菌株及其特征Tab le 2 The recombinant stains and the property
1.1.2试剂
质粒小提试剂盒 (天根生化科技有限公司);蛋白电泳试剂和蛋白分子量标准 (南通碧云天技术研究所);卡那霉素 (上海生工生物有限公司);蛋白胨、酵母粉 (英国Oxoid公司);异麦芽酮糖、海藻酮糖标样 (Sigma公司);其他试剂为国产分析纯。
1.1.3培养基
LB种子培养基 (g/L):蛋白胨 10.0,酵母粉 5.0,和NaCl 10.0。
TB培养基 (g/L):蛋白胨 12.0,酵母粉24.0,甘油 5.0,KH2PO4·3H2O 2.3,K2HPO416.4。
3 L发酵罐培养基 (g/L):(NH4)2HPO44.0,KH2PO4·3H2O 13.5,柠檬酸·H2O 1.7,MgSO40.8,工业蛋白胨 1.0,工业酵母粉 2.0,甘油 8.0;并添加微量元素10 m L/L,用氨水调节pH至 7.0。
微量元素液 (g/L):Al2(SO4)3·18H2O 2.0,CoSO4·7H2O 0.75,H3BO30.5,MnSO4·H2O 14.6,Na2MoSO43.0,NiSO4·6H2O 2.5,ZnSO4·7H2O 15.0。
补加培养基 (g/L):甘油600.0,MgSO49.0,工业酵母粉4.8,工业蛋白胨 2.4。
诱导剂为20 g/L的乳糖。
1.1.4主要仪器
凝胶成像仪、蛋白电泳仪 (美国Bio-Rad公司);Agilent 1 100 高效液相色谱仪 (美国安捷伦公司);细胞破碎仪 (浙江宁波新芝生物科技股份有限公司);3 L-Infors 全自动发酵罐 (伊孚森生物技术有限公司)。
1.2方法
1.2.1信号肽的更换
PelB信号肽,其碱基序列为:5′-ATGAAAT ACCTGCTGCCGACCGCTGCTGCTGGTCTGCT GCTCCTCGCTGCCCAGCCGGCGATGGCC-3′。OmpA信号肽,其碱基序列为:5′-ATGAAAAA GACAGCTATCGCGATTGCAGTGGCACTGGC TGGTTTCGCTACCGTAGCGCAGGCC-3′。PelB、OmpA信号肽前期已经连接到表达载体pET-24a (+) 上,同时两信号肽的碱基序列末端和pET-24a (+) 载体间插入了ATGG 4个碱基来添加Nco I限制性酶切位点。
根据蔗糖异构酶基因序列,分别设计以22、34位点为起始氨基酸的上游引物F22和F34,及下游引物R22/34。
以P22重组菌株的构建为例:设计引物F22 和R22/34,以优化的蔗糖异构酶基因作为模板,经PCR获得22位点为起始氨基酸的碱基序列,将其与 pMD18T-simple载体连接,重组质粒转入E. coli JM 109进行扩增,经Nco I和Xho I限制性内切酶酶切,采用核酸电泳和基因片段纯化获得目的碱基序列,将纯化后的目的序列与含有PelB信号肽的表达载体pET-24a (+) 连接,转入E. coli JM 109扩增质粒,基因测序正确后,转入表达宿主E. coli BL21 (DE3) 中,即获得表达菌株P22。按照同样方法通过PCR扩增、限制性酶切等分子操作获得起始氨基酸分别为 22 和34位点的两个目的片段的碱基序列,将其分别与携带 PelB、OmpA信号肽的表达载体pET-24a (+) 连接。将构建正确的重组质粒转入E. coli BL21 (DE3),则分别获得P22、P34、O22、O34重组菌株。
1.2.2摇瓶发酵培养
将构建好的重组菌株接种到LB培养基中,根据载体的抗性添加抗生素 (卡那霉素终浓度30 μg/m L,氨苄青霉素终浓度 100 μg/m L),37 ℃、200 r/m in培养8 h。将上述培养的表达菌株的种子培养液按 5%接种量,转接到含有50 m L TB培养基的摇瓶中,并补加终浓度为30 μg/m L的卡那霉素。37 ℃培养至OD600=1.0,根据需要添加诱导剂IPTG (终浓度0.1 mmol/L)、乳糖 (终浓度1.0、2.0、3.0、4.0、5.0、6.0 g/L)诱导,或者不添加诱导剂,25 ℃条件下继续培养 24 h。定时取样,分别测定样品的 OD600、DCW (细胞干重) 和蔗糖异构酶的酶活。
1.2.3生物反应器发酵培养
在3 L发酵罐中,按照10%的接种量添加种子培养液到半合成培养基中,并补加终浓度为30 μg/m L的卡那霉素。37 ℃培养至DCW达到9 g/L (OD600=15) 时,补加不同浓度的甘氨酸。继续37 ℃培养,直到DCW达到诱导所需的浓度时,降低温度到30 ℃,并采用0.1 g/(L·h)的乳糖诱导。整个发酵过程中,通过仪器自动补加氨水维持pH 7.0;同时,通过调节搅拌桨转速 (200-900 r/min) 和空气的流速 (1.5-4.0 L/min)控制DO在30%。
1.2.4生物量测定
细胞生长通过测定发酵液在 OD600的吸光度进行实时监控。DCW的测定:5 m L发酵液经10 000 r/m in离心15 m in。离心沉淀用去离子水清洗后,10 000 r/m in再次离心10 m in,离心沉淀在105 ℃条件下烘干至恒重。
1.2.5发酵液及细胞中蔗糖异构酶的分布及SDS-PAGE电泳
发酵液经过离心处理,获得发酵上清和沉淀,发酵上清的酶活称为胞外酶活。含有细胞的离心沉淀回收后,用50 mmol/L的Na2HPO4-柠檬酸 (pH 6.0) 清洗后悬浮,并用缓冲液稀释至 OD600=5.0。吸取 1 m L悬浮液 (OD600=5.0)放置冰上预冷20 m in,超声破碎处理。离心处理获得胞内上清和沉淀,胞内上清的酶活称为胞内酶活;沉淀即为胞内不溶物。
将上述处理获得的发酵上清、胞内上清取出20 μL,并加入5 μL的加样缓冲液;胞内不溶物加入20 μL的加样缓冲液,煮沸处理。上述两种上清处理样品各加8 μL,胞内不溶物处理样品加2 μL,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE) 处理,并采用考马斯亮蓝R-250染料染色,获得蛋白质图谱。
1.2.6酶活测定
发酵样品采用50 mmol/L的Na2HPO4-柠檬酸 (pH 6.0) 适当稀释后,取100 μL稀释后的样品加入到900 μL含有蔗糖的上述缓冲液中,蔗糖终浓度为 200 g/L。迅速混匀后,30 ℃反应15 m in,沸水煮沸使其失活。利用HPLC检测,采用Syncronis Am ino Column (Thermo) 柱子,流动相为 78%的乙腈,经示差检测后,根据样品峰面积,计算异麦芽酮糖的含量。
酶活单位定义:上述条件下,每分钟释放1 μmol异麦芽酮糖所需要的酶量,定义一个酶活力单位。
2 结果与讨论
2.1带有天然信号肽的蔗糖异构酶基因在大肠杆菌中重组表达
将P. dispersa UQ68J来源的带有天然信号肽的蔗糖异构酶原始基因,在保证氨基酸不变的前提下,根据大肠杆菌密码子偏好性进行优化。优化后的基因与原始基因同源性为81.6%,共替换283个密码子,其中包括58个在大肠杆菌中使用频率低于10‰的稀有密码子。
将优化后的蔗糖异构酶基因与无信号肽的表达载体pET-24a (+) 连接,构建重组质粒转入E. coli BL21 (DE3) 获得ORI菌株。采用不添加IPTG或IPTG终浓度为0.1 mmol/L两种方式进行表达,结果显示不添加IPTG时蔗糖异构酶的总酶活和胞外酶活分别达到 85 U/m L 和65 U/m L (图1);添加0.1 mmol/L的IPTG时,蔗糖异构酶总酶活和胞外酶活分别降到10 U/m L和4 U/m L。将胞内不溶物进行SDS-PAGE电泳分析发现,无论是否添加IPTG,细胞内均形成大量包涵体,这可能是由于蔗糖异构酶表达量过大,在胞内不能及时折叠从而形成错误构象。因此,后续实验选择不添加IPTG。
本实验中,携带自身信号肽的蔗糖异构酶基因在大肠杆菌中表达的总酶活达到85 U/m L,远远高于文献报道的不含信号肽的蔗糖异构酶基因表达的总酶活 (大约20 U/m L)[14]。其中,蔗糖异构酶胞外酶活达到65 U/m L,占总酶活的76.5%,说明信号肽对总酶活的提高起到关键性作用,并可将重组酶成功分泌至胞外。这可能是由于蔗糖异构酶携带信号肽后,信号肽能引导蔗糖异构酶快速通过细胞内膜进入周质空间。由于天然蔗糖异构酶是一种胞外酶,周质环境可能更利于其正确折叠,最终使蔗糖异构酶的胞外酶活和总酶活升高。
然而,ORI菌株在不添加IPTG时仍然形成大量包涵体,这可能是因为来源于P. dispersa的蔗糖异构酶信号肽不是大肠杆菌常用信号肽,当目的蛋白大量表达时,无法高效引导目的蛋白分泌到细胞外。因此,尝试使用大肠杆菌常用信号肽,来研究不同信号肽对蔗糖异构酶总酶活的影响。
2.2不同信号肽对蔗糖异构酶总酶活的影响
在大肠杆菌中,OmpA、PelB信号肽经常用于重组蛋白的胞外表达。其中,OmpA信号肽成功实现了 α-CGTase[21]、exoglucanase[22]和TEM-в-lactanase[23]等重组蛋白的胞外表达;PelB 信号肽对角质酶[24]、Pectate lyase[25]和Protein A-PhoA fusion protein[26]等重组蛋白具有良好的分泌效果。因此,本实验分别研究了OmpA、PelB信号肽对蔗糖异构酶总酶活的影响。
更换信号肽涉及到蔗糖异构酶成熟蛋白的起始位点,文献中Wu预测认为该蔗糖异构酶的成熟蛋白起点为34位点[14]。本研究采用不同的软件重新预测成熟蛋白起点,其中 SignalP 4.1 Server和predisi预测认为22位点为成熟蛋白起点;SPEPLip和TatP 1.0 Server预测认为34位点为成熟蛋白起点。据文献报道,信号肽切点需满足-3,-1原则——即-1、-3位点的氨基酸(信号肽切点前第1和第3个氨基酸) 必须含有一个小的中性侧链,而且信号肽的-1位点通常是A la,有利于被信号肽酶识别切割[27]。观察蔗糖异构酶的氨基酸序列发现,21、33位点的氨基酸都是A la;19和31位点氨基酸分别为Tyr、Pro,都是含有小的中性侧链的氨基酸,符合-1、-3原则。由于两个预测位点都具有信号肽切点的特征,因此本实验将外源信号肽分别与以22、34位点为起始位点的氨基酸序列连接。
将以22、34位点为起始位点的氨基酸序列对应的基因与分别携带OmpA、PelB信号肽的pET-24a(+) 表达载体连接,转入大肠杆菌E. coli BL21 (DE3),获得不同的重组菌株O22、O34、P22、P34菌株,不添加IPTG培养24 h。其结果如图1所示。
ORI、O22、O34、P22、P34菌株表达蔗糖异构酶的总酶活分别达到85、88、53、138和92 U/m L。其中,OmpA、PelB信号肽与 22位点连接获得O22、P22菌株表达的蔗糖异构酶总酶活,均明显高于O34、P34菌株的总酶活。说明22位点氨基酸更可能是蔗糖异构酶成熟蛋白的起始位点。
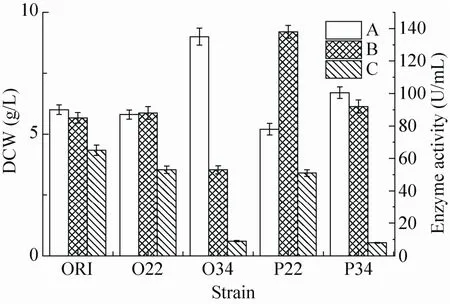
图1 不同菌株在无IPTG条件下培养24 h的发酵结果Fig. 1 The fermentation results of strains w ithout IPTG after 24 h of culture. DCW (A), total sucrose isomerase activity (B) and extracellular sucrose isomerase activity (C).
进一步分析信号肽对蔗糖异构酶总酶活的影响。与PelB信号肽连接获得P22菌株的总酶活最高达138 U/m L,是ORI和O22菌株总酶活的1.6倍。SDS-PAGE显示,P22菌株几乎不形成包涵体。P34、O22和O34菌株仍然形成大量的包涵体 (图2)。综上说明,采用PelB信号肽并与22位点氨基酸连接,能明显提高蔗糖异构酶在大肠杆菌表达的总酶活。
2.3发酵条件对蔗糖异构酶胞外酶活和总酶活的影响
2.3.1不同浓度乳糖对蔗糖异构酶的影响
上述研究表明,P22菌株其蔗糖异构酶总酶活最高,可作为进一步发酵优化研究的菌株。为在发酵罐中对产酶条件进行研究,首先在摇瓶中考察了不同浓度的乳糖诱导对蔗糖异构酶的影响。
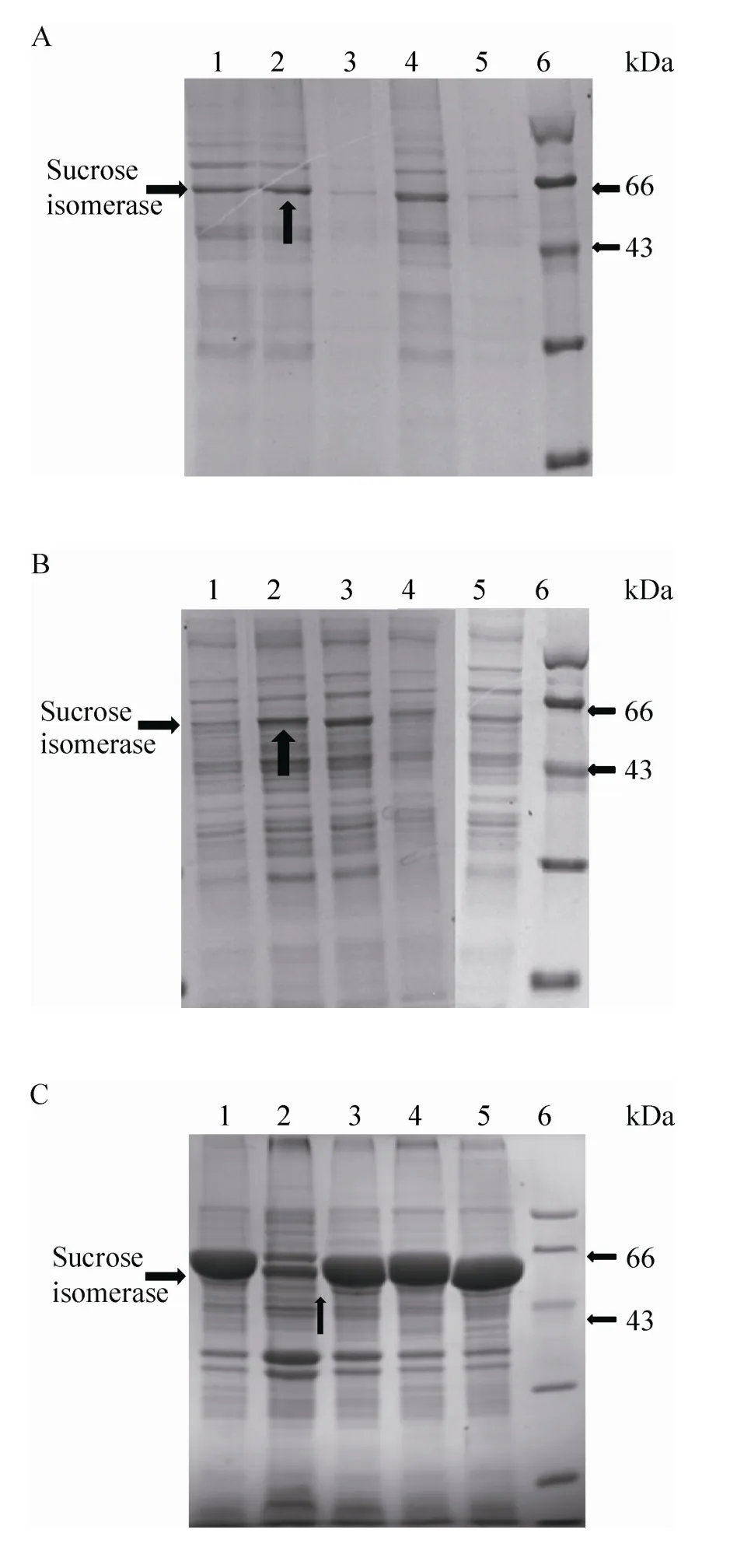
图 2 各菌株发酵上清、胞内上清及胞内不溶物的SDS-PAGE图谱Fig. 2 SDS-PAGE analysis of fermentation supernatant, intracellular supernatant and intracellular insoluble protein. (A) Fermentation supernatant. (B)Intracellular supernatant. (C) Intracellular insoluble protein. 1: ORI strain; 2: P22 strain; 3: P34 strain; 4: O22 strain; 5: O34 strain; 6: marker.
实验中,添加一定量乳糖诱导 (浓度低于4.0 g/L) 时,蔗糖异构酶总酶活比不添加诱导剂的总酶活明显提高。其中添加终浓度3.0 g/L的乳糖诱导,蔗糖异构酶总酶活最高,达到168 U/m L,比不添加乳糖提高约21.7% (图3)。但其胞外酶活较低,仅为蔗糖异构酶总酶活的35.7%。因此,如何促进蔗糖异构酶分泌到发酵液中,对蔗糖异构酶的生产应用具有重要意义。
2.3.2甘氨酸浓度对蔗糖异构酶胞外酶活和总酶活的影响
甘氨酸,是一种空间结构简单的氨基酸。当细胞壁上的氨基酸被甘氨酸替代,会引起细胞壁的结构松散。这有利于合成蛋白分泌到发酵液中,但也降低了细胞壁对细胞的保护作用,对细胞生长产生不利影响,进而可能影响酶产量[28-29]。因此,寻找适宜的甘氨酸浓度,对提高蔗糖异构酶的胞外酶活具有重要意义。
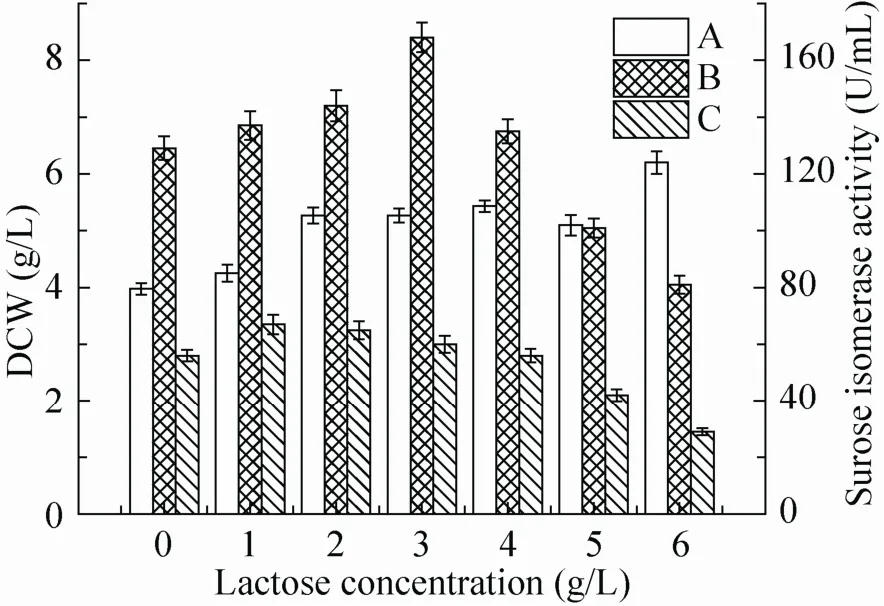
图3 P22菌株在不同浓度乳糖诱导下培养24 h的发酵结果Fig. 3 The fermentation results of P22 strain w ith different concentration of lactose after 24 h of culture. DCW (A), total sucrose isomerase activity (B) and extracellular sucrose isomerase activity (C).
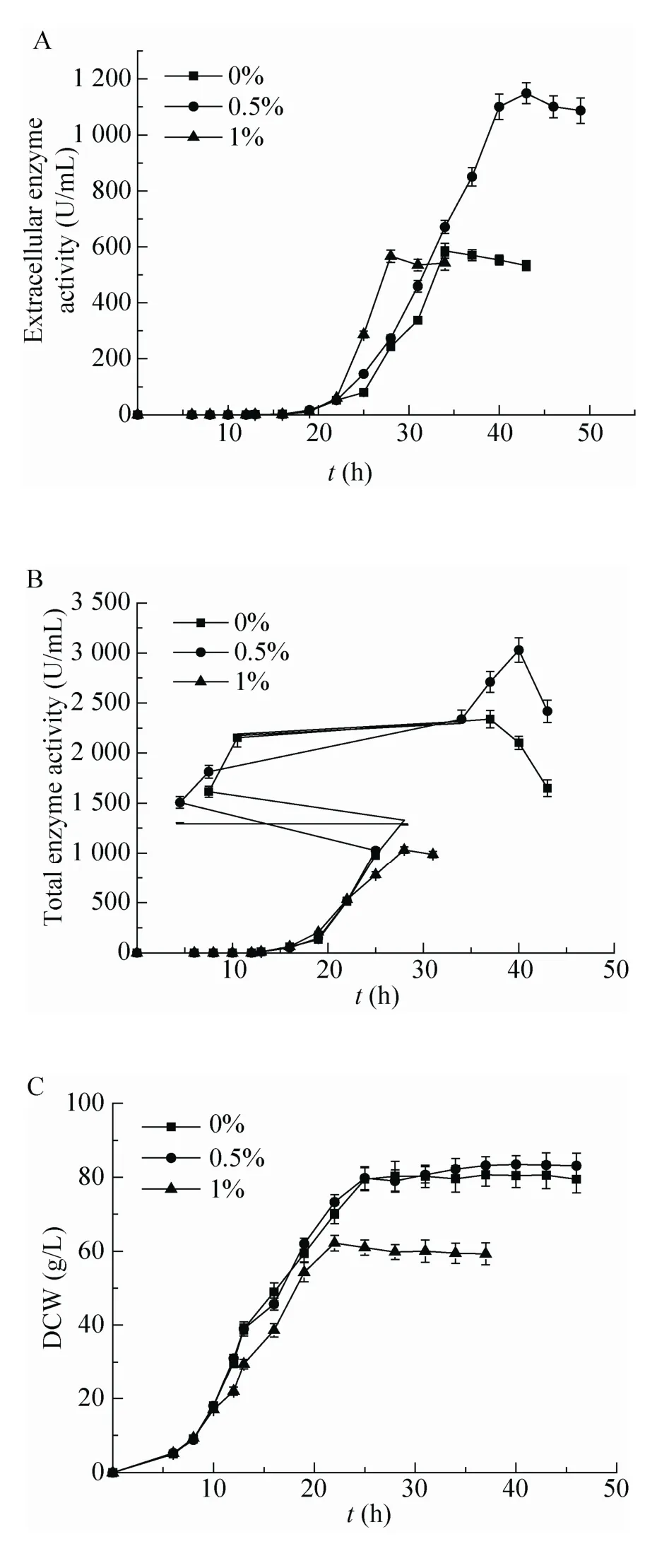
图4 甘氨酸浓度对蔗糖异构酶胞外酶活、总酶活和生物量 (DCW) 的影响Fig.4 The effect of different glycine concentrations on extracellular sucrose isomerase activity (A), total sucrose isomerase activity (B) and biomass (C).
在3 L罐中,补加不同浓度的甘氨酸 (0%、0.5%和1%) 时,蔗糖异构酶的分泌效率随甘氨酸浓度的增加而不断提升,胞外酶活和总酶活分别达到586、1 148、566 U/m L和2 339、3 029、1 032 U/m L (图4)。其中,补加甘氨酸浓度为0.5%时,蔗糖异构酶的总酶活和胞外酶活最高,分别是不补加甘氨酸的2.0和1.3倍;同时,细胞生长也未受到影响,DCW达到83.5 g/L。当补加甘氨酸浓度为1.0%时,蔗糖异构酶的分泌效率最高 (54.8%);但细胞生长受到明显影响,DCW为62.2 g/L,是不补加甘氨酸时DCW的77.1%。因此,补加0.5%甘氨酸最适。
2.3.3诱导时间对蔗糖异构酶胞外酶活和总酶活的影响
补加甘氨酸能促进蔗糖异构酶的分泌,但仍有大量的蔗糖异构酶未能分泌到发酵液中,需要采用其他策略进一步提高分泌效率。文献报道,重组蛋白的表达会对细胞生长产生代谢压力,导致细胞生长速率、生物量及蛋白表达量降低[28]。为减轻这种不利影响,采用不同的诱导时间,发现重组酶的分泌效率不同。当诱导时间提前,分泌效率逐渐提高,但对细胞的伤害愈加明显[28-29]。因此,研究了不同诱导时间对蔗糖异构酶分泌效率的影响,以获得最佳诱导时间,来提高蔗糖异构酶的胞外酶活。
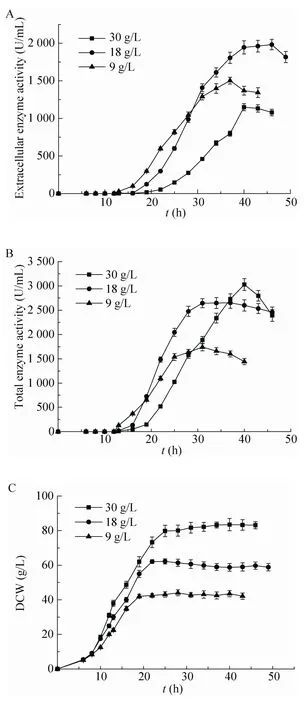
图5 诱导时间对蔗糖异构酶胞外酶活、总酶活和生物量 (DCW) 的影响Fig. 5 The effect of different induction time on extracellular sucrose isomerase activity (A), total sucrose isomerase activity (B) and biomass (C).
实验中,分别采用DCW为30 g/L、18 g/L 及9 g/L (OD600=50、30及15) 时开始诱导,蔗糖异构酶的分泌效率随诱导时间提前分泌效率不断提升,胞外酶活和总酶活分别达到1 148、1 981、1 501 U/m L和3 029、2 654、1 742 U/m L(图5)。当DCW为30 g/L (OD600=50) 时开始诱导,蔗糖异构酶总酶活和生物量最高,但其胞外酶活仅占总酶活的37.9%。将诱导时间提前至DCW为18 g/L (OD600=30) 时,蔗糖异构酶的分泌效率达到74.6%,胞外酶活达到最高 (1981 U/m L),是DCW为30 g/L (OD600=50) 开始诱导胞外酶活的1.7倍。当DCW为9 g/L (OD600=15)诱导,蔗糖异构酶分泌效率最高 (86.2%),但其细胞生长受到严重抑制,DCW最低只有44.0 g/L,仅为DCW 为 30 g/L (OD600=50) 开始诱导生物量的52.7%。综合比较,当DCW为18 g/L (OD600=30)时,蔗糖异构酶胞外酶活最高。
通过实验确定了最优发酵条件为:补加0.5%甘氨酸,DCW为18 g/L (OD600=30) 时进行诱导。该条件下,蔗糖异构酶胞外酶活最高,达到1 981 U/m L,是不补加甘氨酸时胞外酶活(586 U/m L) 的2.4倍,也是目前蔗糖异构酶在大肠杆菌中表达的最高胞外酶活。
3 结论
本文研究了不同信号肽及发酵条件,对P. dispersa蔗糖异构酶在大肠杆菌中重组表达的影响。采用携带天然信号肽及基因优化策略,蔗糖异构酶的总酶活明显升高。更换PelB信号肽并与22位点的氨基酸连接,使蔗糖异构酶的总酶活进一步提升。3 L发酵罐中,采用最适的甘氨酸浓度和诱导时间,蔗糖异构酶分泌效率得到大幅提高,胞外酶活最高达1 981 U/m L,总酶活达到2 640 U/m L,该研究为其他蔗糖异构酶的高效生产提供参考。
REFERENCES
[1] Low NH, Sporns P. Analysis and quantitation of m inor di-and trisaccharides in honey using capillary gas chromatography. J Food Sci, 1988,53(2): 558-561.
[2] Hamada S. Role of sweeteners in the etiology and prevention of dental caries. Pure Appl Chem,2002, 74(7): 1293-1300.
[3] Lina BA, Jonker D, Kozianow ski G. Isomaltulose (Palatinose): a review of biological and toxicological studies. Food Chem Toxicol, 2002,40(10): 1375-1381.
[4] Godshall MA. How carbohydrates influence food flavors. Food Technol, 1997, 51: 63-66.
[5] Tang WZ, Chen F, Li XZ. Advances in isomaltulose production catalyzed by sucrose isomerase. M icrobiol China, 2012, 39(9): 1314-1322 (in Chinese).
唐文竹, 陈放, 李宪臻. 蔗糖异构酶催化生产异麦芽酮糖研究进展. 微生物学通报, 2012, 39(9): 1314-1322.
[6] Ravaud S, Watzlaw ick H, Haser R, et al. Overexpression, purification, crystallization and prelim inary diffraction studies of the Protaminobacter rubrum sucrose isomerase SmuA. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2006, 62(1): 74-76.
[7] Cheetham PS. The extraction and mechanism of a novel isomaltulose-synthesizing enzyme from Erwinia rhapontici. Biochem J, 1984, 220(1): 213-220.
[8] Ren B, Li S, Xu H, et al. Purification and characterization of a highly selective sucrose isomerase from Erwinia rhapontici NX-5. Bioprocess Biosyst Eng, 2011, 34(5): 629-637.
[9] Kawaguti HY, Sato HH. Characterization of a glucosyltransferase from Erwinia sp. D12 and the conversion of sucrose into isomaltulose by immobilized cells. Biochem Eng J, 48: 211-217.
[10] Aroonnual A, Nihira T, Seki T, et al. Role of several key residues in the catalytic activity of sucrose isomerase from Klebsiella pneumoniae NK33-98-8. Enzyme M icrob Technol, 2007,40(5): 1221-1227.
[11] Lee HC, Kim JH, Kim SY, et al. Isomaltose production by modification of the fructose-binding site on the basis of the predicted structure of sucrose isomerase from “Protaminobacter rubrum”. Appl Environ M icrobiol, 2008, 74(16): 5183-5194.
[12] Zhang D, Li X, Zhang LH. Isomaltulose synthase from Klebsiella sp. strain LX 3: gene cloning and characterization and engineering of thermostability. Appl Environ M icrobiol, 2002,68(6): 2676-2682.
[13] Véronèse T, Perlot P. M echanism of sucrose conversion by the sucrose isomerase of Serratia plymuthica ATCC 15928. Enzyme M icrob Technol, 1999, 24: 263-269.
[14] W u L, Birch RG. Characterization of the highly efficient sucrose isomerase from Pantoea dispersa UQ68J and cloning of the sucrose isomerase gene. Appl Environ M icrobiol, 2005, 71: 1581-1590.
[15] Mu WM, Li WJ, Wang X, et al. Current studies on sucrose isomerase and biological isomaltulose production using sucrose isomerase. Appl M icrobiol Biotechnol, 2014, 98: 6569-6582.
[16] Bornke F, Hajirezaei M, Sonnewald U. Cloning and characterization of the gene cluster for palatinose metabolism from the phytopathogenic bacterium Erwinia rhapontici. J Bacteriol, 2001,183: 2425-2530.
[17] Cha J, Jung JH, Park SE, et al. Molecular cloning and functional characterization of a sucrose isomerase (isomaltulose synthase) gene from Enterobacter sp. FMB-1. J Appl M icrobiol, 2009,107(4): 1119-1130.
[18] Cheng S, Duan XG, W u J. Fermentation optim ization of recombinant sucrose isomerase and its application. Food Ferment Ind, 2015, 5: 41-47 (in Chinese).
程胜, 段绪果, 吴敬. 重组蔗糖异构酶的制备及应用条件优化. 食品与发酵工业, 2015, 5: 41-47.
[19] Lee GY, Jung JH, Seo DH, et al. Isomaltulose production via yeast surface display of sucrose isomerase from Enterobacter sp. FMB-1 on Saccharomyces cerevisiae. Bioresour Technol,2011, 102(19): 9179-9184.
[20] Park JY, Jung JH, Seo DH, et al. M icrobial production of palatinose through extracellular expression of a sucrose isomerase from Enterobacter sp. FMB-1 in Lactococcus lactis MG1363. Bioresour Technol, 2010, 101(22): 8828-8833.
[21] Li B, Wu J, Chen J. The effects of signal peptide on extracellular expression of CGTase from Paenibacillus macerans in E. coli. Ind M icrobiol,2011, 41(3): 54-59 (in Chinese).
李彬, 吴敬, 陈坚. 信号肽对浸麻类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中胞外表达的影响. 工业微生物, 2011, 41(3): 54-59.
[22] Lam TL, W ong RS, Wong WK. Enhancement of extracellular production of a Cellulomonas fimi exoglucanase in Escherichia coli by the reduction of promoter strength. Enzyme M icrob Technol,1997, 20: 482-488.
[23] Wan EW, Baneyx F. TolAIII co-expression facilitates the recovery of periplasm ic recombinant proteins into the grow th medium of Escherichia coli. Protein Expr Purif, 1998, 14(1): 13-22.
[24] Chen S, Li B, Hong, RY. The number of signal peptide cleavage site is critical for extracellular production of recombinant Thermobifida fusca cutinase. Process Biochem, 2011, 46(9): 1867-1870.
[25] Matsumoto T, Katsura D, Kondo A, et al. Efficient secretory overexpression of Bacillus subtilis pectate lyase in Escherichia coli and single-step purification. Biochem Eng J, 2002, 12(3): 175-179.
[26] Chowdhury PS, Kushwaha A, Abrol S, et al. An expression system for secretion and purification of a genetically engineered thermostable chimera of protein A and alkaline phosphatase. Protein Expr Purif, 1994, 5: 89-95.
[27] Choi JH, Lee SY. Secretory and extracellular production of recombinant proteins using Escherichia coli. Appl M icrobiol Biotechnol,2004, 64: 625-635.
[28] Cheng J, Wu D, Chen S. High-level extracellular production of alpha-cyclodextrin glycosyltransferase w ith recombinant Escherichia coli BL21 (DE3). J Agric Food Chem, 2011,59(8): 3797-3802.
[29] Zou C, Duan XG, W u J. Enhanced extracellular production of recombinant Bacillus deramificans pullulanase in Escherichia coli through induction mode optim ization and a glycine feeding strategy. Bioresour Technol, 2014, 172: 174-179.
(本文责编 陈宏宇)
November 17, 2015; Accepted: January 19, 2016
Sheng Chen. Tel/Fax: +86-510-85326653; E-mail: chensheng@jiangnan.edu.cn
Expression and production optim ization of sucrose isomerase from Pantoea dispersa in Escherichia coli
Juntong Liu1,2, Jing Wu1,2, and Sheng Chen1,2
1 State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
2 Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122,Jiangsu, China
To improve the yield of sucrose isomerase from Pantoea dispersa UQ68J, we studied the effect of different signal peptides and fermentation conditions on sucrose isomerase expression in Escherichia coli. The gene of sucrose isomerase was optim ized and expressed in E. coli BL21 (DE3) w ith native signal peptide which was named as ORI strain. The total and extracellular enzyme activity was 85 and 65 U/m L in the flask, respectively. The mature protein, which started from the 22th am ino acid, was connected w ith the PelB and OmpA signal peptide to construct P22 and O22 strain,respectively. The total activity of P22 reached 138 U/m L, which was 1.6 times of ORI strain. The total activity of O22 strain was sim ilar to that of ORI strain. Induced by 3.0 g/L lactose, the total activity of P22 strain increased to 168 U/m L. In 3 L fermentor, the effects of glycine concentration and induction time were studied. Induction when the DCW reached 18 g/L (OD600=30), w ith 0.5% glycine, the extracellular enzyme activity reached 1 981 U/m L, and the total enzyme activity reached 2 640 U/m L, which is the highest activity of sucrose isomerase that was expressed in recombinant E. coli.
sucrose isomerase, signal peptides, fermentation optim ization
Supported by: National Science Fund for Distinguished Young Scholars (No. 31425020), The Project of Outstanding Scientific and Technological Innovation Group of Jiangsu Province (Jing Wu, 111 Project) (No. 111-2-06), Natural Science Foundation of Jiangsu Province (No. BK20140132), The Fundamental Research Funds for the Central Universities (No. JUSRP51304A).
国家杰出青年基金 (No. 31425020),江苏高校优秀科技创新团队项目 (吴敬,111计划) (No. 111-2-06),江苏省自然科学基金 (No. BK20140132),中央高校基本科研业务费专项资金 (No. JUSRP51304A) 资助。
