具有抗菌效应的聚羟基脂肪酸酯生物塑料的制备与功能表征
2016-09-13娄秋莉马一鸣车雪梅钟瑾孙小霞张浩千
娄秋莉,马一鸣,车雪梅,钟瑾,孙小霞,张浩千
1 福建农林大学 生命科学学院,福建 福州 3500022 蓝晶 (北京) 生物科技有限公司,北京 1000843 中国科学院微生物研究所,北京 100101
工业生物技术
具有抗菌效应的聚羟基脂肪酸酯生物塑料的制备与功能表征
娄秋莉1,马一鸣2,车雪梅2,钟瑾3,孙小霞1,张浩千2
1 福建农林大学 生命科学学院,福建 福州 350002
2 蓝晶 (北京) 生物科技有限公司,北京 100084
3 中国科学院微生物研究所,北京 100101
娄秋莉, 马一鸣, 车雪梅, 等. 具有抗菌效应的聚羟基脂肪酸酯生物塑料的制备与功能表征. 生物工程学报, 2016,32(8): 1052-1059.
Lou QL, Ma YM, Che XM, et al. Preparation and characterization of polyhydroxyalkanoate bioplastics with antibacterial activity. Chin J Biotech, 2016, 32(8): 1052-1059.
聚羟基脂肪酸酯 (Polyhydroxyalkanoates, PHAs) 作为一类新型的生物高分子材料,因其多样的材料性质与高度的生物可降解性日益受到关注。使用乳酸链球菌素 (Nisin),一种被公认为安全的天然食品防腐剂,制备了具有高效、持久抗菌效应的PHA塑料。首先采用溶剂浇铸的方法将Nisin整合到正3-羟基丁酸-3羟基己酸共聚酯 (PHBHHx),一种具备高度生物相容性的PHA中,从而获得了具有抗菌效应的PHBHHx薄膜。激光共聚焦显微镜观察表明Nisin在PHBHHx中呈颗粒状均匀分布。随后以条件致病菌藤黄微球菌Micrococcus luteus为测试菌株,通过琼脂扩散法,测定PHBHHx薄膜抗菌效应对Nisin含量的依赖关系;在液体培养条件下测量PHBHHx薄膜的Nisin释放效果与抗菌效应。结果表明Nisin可从PHBHHx薄膜顺利释放且Nisin的含量高于25 μg/g时即表现出显著的抑菌效果且可长时间维持。该研究为工业化生产具有抗菌效应的PHA奠定了重要的技术基础,拓展了PHA在医学和食品领域的应用潜力。
聚羟基脂肪酸酯,乳酸链球菌素,抑菌塑料,藤黄微球菌
随着石油资源的不断消耗和石化产品尤其是不可降解的传统塑料所造成的白色污染日益严重,可天然降解的绿色生物塑料正在受到越来越多的关注[1]。不同于生产过程仍需化工缩聚反应的聚乳酸 (Polylactic acid,PLA),聚羟基脂肪酸酯 (Polyhydroxyalkanoates,PHAs) 作为1种新型的可降解生物塑料可由微生物利用可再生的生物质原料进行全程的发酵生产,其环境污染指数低,更为环保[2-3]。更为重要的是,PHA种类繁多 (仅其单体就超过150种),化学性质和材料性能差异极大,在不同的环境中均表现出很高的生物可降解性,其潜在的应用前景因此更为广泛[4-5]。特别是在医疗和食品领域,聚 (3-羟基丁酸-3-羟基己酸酯)[6]和聚 (3-羟基丁酸酯-co-4-羟基丁酸酯) (Poly(3-hydroxybutyric acid-co-4-hydroxybutyric acid), P(3HB-co-4HB))这两种PHA因其极强的生物相容性和人体可植入性展现出极大的应用潜力,可用作手术缝合线、骨钉、人造骨骼、食品包装等,其相关研究亟需展开[7-9]。
乳酸链球菌素 (Nisin) 是由乳酸乳球菌Lactococcus lactis subsp. lactis产生的一种阳离子多肽,可以有效抑制多种引起食品腐败和医学感染的革兰氏阳性菌[10-11],对沙门氏菌Salmonella等部分革兰氏阴性菌同样有抑制效果[12]。Nisin可被人体肠道分泌的α-胰凝乳蛋白酶有效降解,因此对人体安全无毒,是目前唯一大规模商业化应用的高效天然防腐剂[10,13],被广泛应用于欧盟、中国、美国等多个国家和地区的食品行业中[14-15]。特别值得注意的是,除了作为食品防腐剂之外Nisin亦可被应用到多种材料中以达到抗菌效果。Qi等[16]利用PEG 1000 将Nisin稳固结合到碳纳米管上,从而使碳纳米管具备了抗菌活性。Jin等[17]则将Nisin整合入聚乳酸 (PLA) 以生产具有抗菌效应的食品包装袋。进一步研究表明,在带有Nisin-PLA涂层的牛奶灌装瓶中,李斯特菌Listeria monocytogenes的生长被显著抑制,并且抑制效果在 4 ℃保存条件下可维持70 d[18]。
在本试验中,我们首先利用溶剂浇铸的方法将Nisin整合入PHA (PHBHHx),从而获得了具有抗菌效应的PHBHHx薄膜;激光共聚焦显微镜的观察表明Nisin在PHBHHx薄膜内部呈颗粒状均匀分布[19];随后的功能实验表明,仅仅25 μg/g的Nisin浓度就足以使得PHBHHx薄膜对于典型条件致病菌——藤黄微球菌Micrococcus luteus NCIB 8166的生长起到显著抑制,且抑制效果可长时间持续。本试验成功使用乳酸链球菌素制备了具有高效、持久抗菌效应的PHA塑料,并且通过详细的功能表征与显微镜观察,为PHA生物塑料在医学与食品领域的应用打下基础。
1 材料与方法
1.1材料
1.1.1菌株与试剂
用于抗菌效应检测的菌株为藤黄微球菌M icrococcus luteus NCIB 8166。培养基为SI培养基,培养条件为 30 ℃,静置或 200 r/m in。PHBHHx塑料粉料由北京蓝晶生物科技有限公司提供。乳酸链球菌素 (Nisin) 样品由中国科学院微生物研究所提供,纯度为2.5%,剩余杂质为无机盐和蛋白粉。其余所需试剂均购自Sigma-A ldrich公司。
1.1.2含有Nisin的PHBHHx塑料薄膜
选取二氯甲烷作为溶剂浇铸的溶剂;这是因为二氯甲烷具备化学惰性和高挥发性且已有工作表明PHA在二氯甲烷中可高效溶解[20]。称取不同质量梯度的Nisin,各自加入一份溶解了1 g PHBHHx粉料的15 m L二氯甲烷中;Nisin样品的用量分别是0.01、0.1、1、4、16、64和256 mg,换算为 Nisin纯净物则为 0.25 μg、2.5 μg、25 μg、100 μg、400 μg、1.6 mg和6.4 mg(后文中Nisin浓度与用量皆指纯净物)。用磁棒搅拌直至 Nisin样品粉末完全分散到聚合物溶液中,将混匀的溶液浇铸到9 cm的玻璃培养皿中,通风橱内静置24 h。待二氯甲烷完全挥发,PHBHHx成膜;塑料膜的厚度约1 mm,面积约为63.5 cm2,因此Nisin在薄膜中的分布浓度为(x×2.5%) μg/63.5 cm2即 (x×0.394) μg/cm2,x代表含有 Nisin的混合物样品的质量的数值 (以mg单位记)。用6 mm直径的打孔器将塑料膜加工为圆形薄膜,保存在密闭容器中待用。
1.2方法
1.2.1利用琼脂扩散法测试PHBHHx-Nisin薄膜的抑菌效应
将藤黄微球菌单克隆菌落接种到5 m L SI液体培养基中;30 ℃、200 r/m in条件下培养16 h,获得种子液 (OD600=1.9)。取500 μL种子液加到50 m L SI固体培养基中,混匀以制备琼脂扩散法所需的平板,每个平板含有约25 m L的SI固体培养基。将6 mm直径的 PHBHHx-Nisin圆形薄膜平放在 SI固体培养基表面,每种 Nisin含量的薄膜有6个重复,30 ℃静置培养24 h;对照组为不含Nisin、等直径的PHBHHx薄膜。用卡尺测量每个抑菌圈的大小并记录。
1.2.2Nisin在PHBHHx薄膜中的物理分布
将直径6 mm的PHBHHx-Nisin薄膜固定在载玻片上,Nisin的浓度分别为 100 μg/g和25 μg/g。PHBHHx-NaCl薄膜和PHBHHx薄膜分别作为对照组;PHBHHx-NaCl薄膜中的NaCl浓度为0.975 mg/g (与25 μg/g Nisin含量的膜片所对应的非Nisin量相同)。采用Leica TCS SP2激光共聚焦显微镜,层扫观察 Nisin的分布情况。Nisin在425 nm波长的激发光 (EX) 下可发出475 nm波长 (EM) 的自发荧光[17]。
1.2.3液体培养条件下测量PHBHHx-Nisin的抑菌效应
获得种子液的方法同琼脂扩散法。所用Nisin的浓度为100、25和2.5 μg/g。将种子液稀释104倍,即每毫升稀释过的菌液约含105个菌落形成单位 (Colony-form ing unit,CFU),加入3片加工好的PHBHHx-Nisin薄膜到5 m L SI液体培养基中,30 ℃、200 r/m in培养。每隔一段时间取样,从培养液中取出200 μL菌液测量OD600,根据OD600数值用新鲜的SI培养基将取出样品进行不同倍数的稀释后涂板,30 ℃静置培养20 h后计算活菌数目得出统计结果。每种Nisin含量的薄膜进行3次实验重复,对照组为不含Nisin的PHBHHx薄膜和不含Nisin的纸片。
2 结果与分析
2.1琼脂扩散法测定PHBHHx-Nisin薄膜的抑菌效应
藤黄微球菌是一种广泛分布于空气、土壤、水及动植物表面的条件致病菌,被用作抑菌素(如 Nisin) 的指示菌株[21-22]。使用纸片和不含Nisin的PHBHHx薄膜的对照组并没有抑菌效应(图1A和图1B的0 μg/g),说明抑菌效应的来源正是Nisin。Nisin含量达到25 μg/g以上时表现出稳定大小的抑菌圈 (图 1A);Nisin含量在2.5 μg/g及以下时的抑菌效果则不稳定 (图1B);这暗示Nisin在PHBHHx薄膜内部的分布并不均匀,因此Nisin浓度越低则抑菌效果平行性越差。随着Nisin浓度的增加,PHBHHx薄膜抑菌效果显著增强,详细统计的变化趋势见图2。
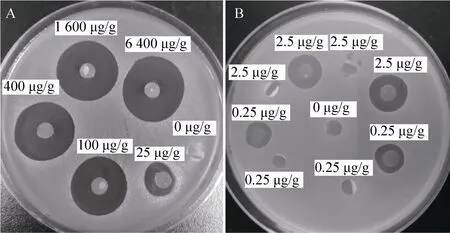
图1 琼脂扩散法测量含有乳酸链球菌素的PHBHHx膜片的抑菌效应Fig. 1 Antibacterial activity of Nisin-embedded PHBHHx films quantified using agar diffusion method. (A)Inhibition of M icrococcus luteus (NCIB 8166) grow th using PHBHHx films containing Nisin at six different concentrations (0, 25, 100, 400, 1 600, and 6 400 μg/g, respectively). (B) The inhibitory effect of PHBHHx films containing Nisin at three different concentrations (0, 0.25, and 2.5 μg/g, respectively). The diameter of the films is 6 mm.
2.2Nisin在PHBHHx薄膜中的物理分布
图3展示了100 μg/g和25 μg/g两种Nisin浓度的PHBHHx薄膜的显微成像结果。图中的绿色亮点即为Nisin蛋白质颗粒的自发荧光,直径约10-70 μm,密度随掺入的Nisin浓度增加而增大。图中直径较大的暗色斑点可能是随Nisin一起掺入的无机盐等杂质:仅向PHBHHx中掺入NaCl即可使其具有相同的显微特征 (结果未列出)。
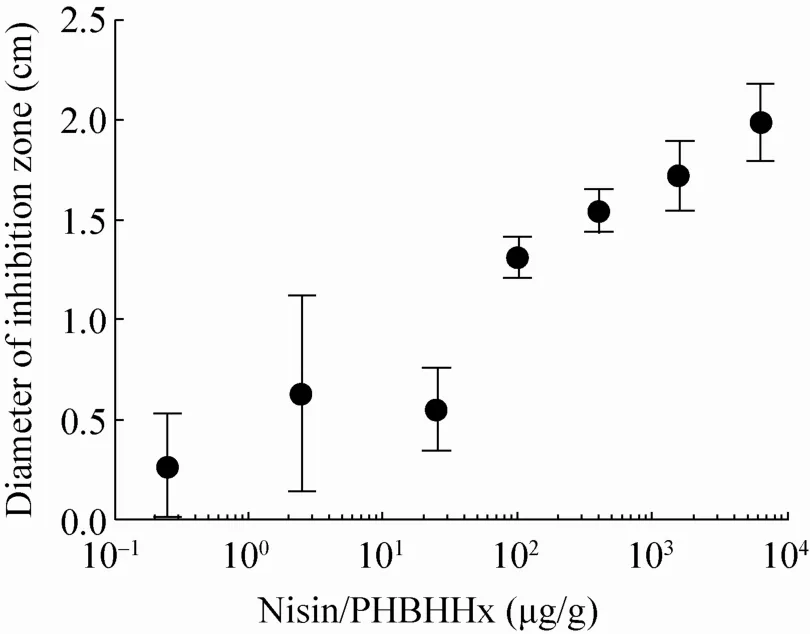
图2 PHBHHx膜片抗菌效应对Nisin含量的依赖关系Fig. 2 Nisin-dependent antibacterial activity of PHBHHx films. The Nisin concentrations are 0.25, 2.5,25, 100, 400, 1 600 and 6 400 μg/g, respectively. Error bars represent the standard deviation of the mean from six separate tests.
2.3PHBHHx薄膜中Nisin的释放情况
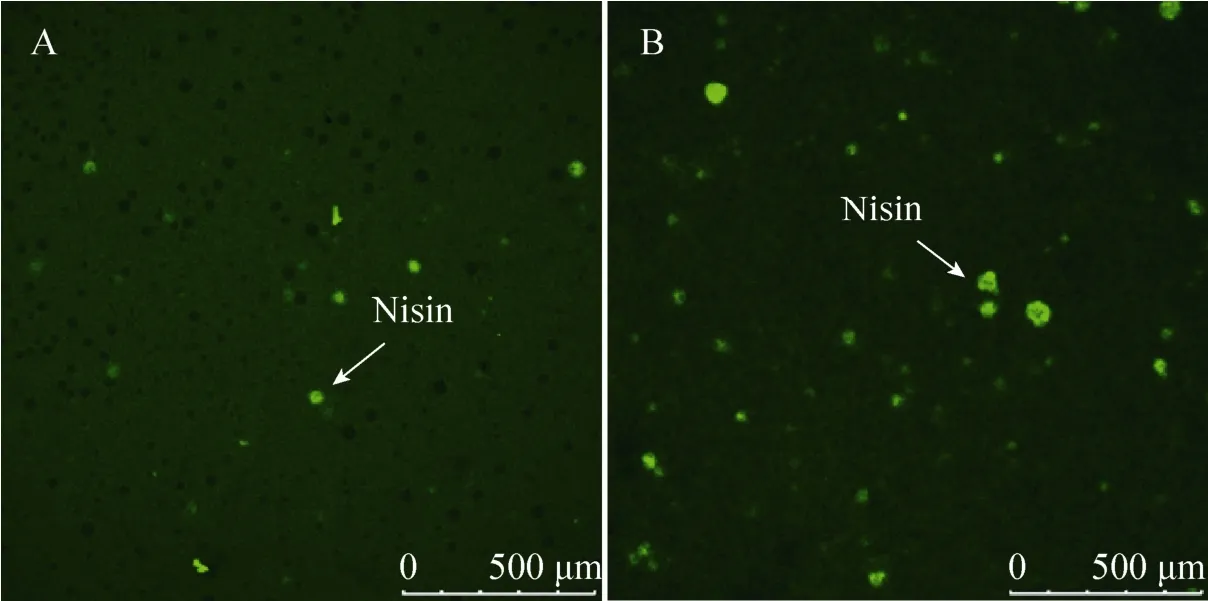
图3 激光共聚焦显微镜观察Nisin颗粒在PHBHHx膜片内部的物理分布Fig. 3 The distribution of Nisin particles in PHBHHx matrices imaged by confocal laser m icroscopy in cross-section view. The green dots are Nisin particles. (A) 25 μg/g Nisin. (B) 100 μg/g Nisin.
根据琼脂扩散法的实验测量结果,选取 4 种 Nisin浓度 (100、25、2.5、0.25 μg/g) 的PHBHH x薄膜做液体培养抑菌实验。将PHBHHx-Nisin薄膜加到藤黄微球菌生长所需的SI液体培养基中进行细菌培养,在特定时间点取样后用新鲜SI培养液将样品稀释不同的倍数后涂板,30 ℃静置培养20 h,统计平板上的活菌数目。结果图4所示,对照组 (加入了不含Nisin的PHBHHx薄膜的培养基) 在培养22 h时达到稳定期 (约8.8 log CFU/m L)。含有2.5 μg/g PHBHHx-Nisin薄膜的样品中,菌的密度在早期生长中急速下降约 3个数量级,原因可能是大量菌体被薄膜释放的Nisin杀死;但由于含量不高的Nisin被耗尽,少数幸存的活菌导致8 h后菌体密度迅速上升,在22 h也达到了稳定期 (图4)。25 μg/g与100 μg/g的PHBHHx-Nisin薄膜所在培养液没有出现藤黄微球菌菌体复苏的现象,说明薄膜释放的 Nisin可以在细菌生长早期就将其完全杀灭 (图 4)。这些结果证明了分布在薄膜中的 Nisin可以被顺利释放出来且抑菌效应能得到长时间的维持。
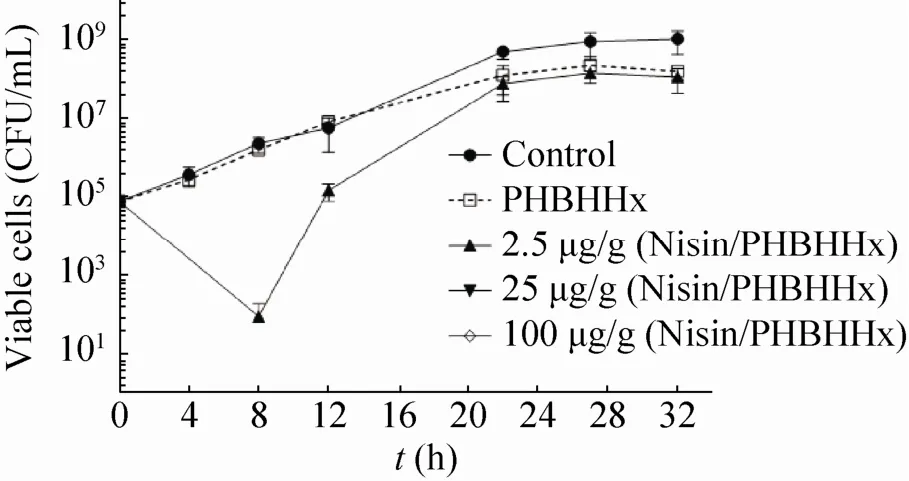
图 4 液体培养条件下 PHBHHx-Nisin膜片的抗菌活性随时间的变化Fig. 4 Inhibitory effect of PHBHHx-Nisin on the grow th of Micrococcus luteus in liquid media. Note that when Nisin concentration is higher than 25 μg/g,the bacterial grow th was inhibited throughout the incubation time, so the corresponding curves overlap w ith the horizontal axis. Error bars represent the standard deviation of the mean from three separate tests.
3 讨论
本研究首次将 Nisin经过溶剂浇铸的方法嵌入到PHBHHx中,使得PHBHHx具有抗菌活性,其生产方法简便,极易应用于工业放大。当前国内外的同类研究将目光集中在 PLA和PBS系列的生物塑料上,而针对性能更为多样化、生物降解性与相容性更高的PHA系列的工作则是空白。为了进一步说明本文方法对于PHA系列的通用性,我们采用另外 3种 PHA (PHB、PHBV、P3HB4HB) 分别制备了PHB-Nisin、PHBV-Nisin与P3HB4HB-Nisin共3种抗菌PHA材料,并进行了琼脂扩散法实验。实验结果表明,虽然不同的材料间表现出一定的差异,但3种含有Nisin的PHA材料均呈现出灵敏的、显著的抗菌活性 (结果未列出)。
Nisin可以通过共价和非共价的方式整合到其他介质中。考虑到Nisin需要被充分释放才能最大程度发挥抑菌活性,因此我们选择溶剂浇铸这一非共价结合的方法将 Nisin整合到 PHA中。本研究中 Nisin以“不溶颗粒”的形式混在PHA中;实验结果也表明利用此种方法,在5 m L液体培养基中仅仅 0.33 μg的 Nisin (换算为Nisin浓度则为 0.07 μg/m L) 就足以抑制细菌的生长;这是截止到目前已报道的抑菌活性最高的抗菌塑料。
验证 PHA-Nisin薄膜在液体培养条件下的抑菌情况时我们观察到,25 μg/g和 100 μg/g Nisin含量的 PHA薄膜在藤黄微球菌生长初期就没有了生长迹象。然而,当 Nisin的含量为2.5 μg/g时,在生长前8 h活菌数急剧下降后,菌体密度反而出现复苏现象。这说明此时被释放到液体中的Nisin尚不足以杀灭全部的菌体,且后续释放乏力。因此,2.5 μg/g的Nisin含量对于液体培养条件下的抑菌来说是不够的。关于固体与液体之间的抑菌浓度差别,有两个潜在的影响因素:一是Nisin的扩散方式不同,在液体振荡的条件下Nisin比在固体平板上更容易扩散稀释;二是不同的生长条件导致细菌的代谢物不同,而后者会显著影响Nisin的活性[23]。
Nisin是由 34个氨基酸组成的、硫醚键形成 5个内环的短肽,常为二聚体或四聚体[24]。Nisin作为食品防腐剂的实践经验表明其在偏酸性条件下保存时间长,高压处理后活性保持良好,在合适的条件下甚至可以忍受一定程度的高温。前人报道,在pH 5-7时,经历巴氏消毒后Nisin可保持至少80%的活性[10]。在偏酸性条件下,常规高压蒸汽灭菌后Nisin的活性仍能保持 50%以上;一些 Nisin突变体甚至可以忍受100 ℃及以上的高温处理10 m in而保持80%抑菌活性[25]。这些物理条件符合工业实践中PHA的加工窗口,因此抗菌PHA塑料的工业生产过程Nisin的降解失活很可能不是难题。
本研究为工业化生产具有抗菌效应的生物可降解塑料PHA提供了重要参考。特别值得注意的是,这里使用Nisin这一被公认为安全食品防腐剂的天然产物作为抗菌成分,可以有效遏制食品腐败菌和条件致病菌的生长。因此抗菌PHA塑料在医学和食品领域可预见的应用范围相当可观,包括食品包装袋、饮水机接口、电冰箱内置塑料等等。
REFERENCES
[1] Leong YK, Show PL, Ooi CW, et al. Current trends in polyhydroxyalkanoates (PHAs) biosynthesis: insights from the recombinant Escherichia coli. J Biotechnol, 2014, 180: 52-65.
[2] Nath A, Dixit M, Bandiya A, et al. Enhanced PHB production and scale up studies using cheese whey in fed batch culture of Methylobacterium sp. ZP24. Bioresour Technol, 2008, 99(13): 5749-5755.
[3] Li ZJ, Wei XX, Chen GQ. M icrobial cell factories for production of polyhydroxyalkanoates. Chin J Biotech, 2010, 26(10): 1426-1435 (in Chinese).
李正军, 魏晓星, 陈国强. 生产聚羟基脂肪酸酯的微生物细胞工厂. 生物工程学报, 2010, 26(10): 1426-1435.
[4] Chen GQ, Wu Q. The application of polyhydroxyalkanoates as tissue engineering materials. Biomaterials, 2005, 26(33): 6565-6578.
[5] Ojumu TV, Yu J, Solomon B. Production of polyhydroxyalkanoates, a bacterial biodegradable polymer. A fr J Biotechnol, 2004, 3: 18-24.
[6] Song LH, Wang YW. The study progress of Nisin. Food Res Dev, 2004, 25: 18-20 (in Chinese).
宋连花, 王彦文. 乳链菌肽(Nisin)研究进展. 食品研究与开发, 2004, 25: 18-20.
[7] Bugnicourt E, Cinelli P, Lazzeri A, et al. Polyhydroxyalkanoate (PHA): review of synthesis,characteristics, processing and potential applications in packaging. Expr Polym Lett, 2014,8(11): 791-808.
[8] Castilho LR, M itchell DA, Freire DM. Production of polyhydroxyalkanoates (PHAs) from waste materials and by-products by submerged and solid-state fermentation. Bioresour Technol, 2009,100(23): 5996-6009.
[9] Chen GQ. Current status and industrialization of biopolyesters polyhydroxyalkan oate (PHA). New Chem M ater, 2010, 38: 1-6(in Chinese).
陈国强. 生物高分子材料聚羟基脂肪酸酯(PHA)开发现状及产业化前景分析. 化工新型材料,2010, 38: 1-6.
[10] Delves-Broughton J, Blackburn P, Evans RJ, et al. Applications of the bacteriocin, nisin. Antonie van Leeuwenhoek, 1996, 69(2): 193-202.
[11] Lubelski J, Rink R, Khusainov R, et al. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell M ol Life Sci, 2008, 65: 455-476.
[12] Stevens KA, Sheldon BW, K lapes NA, et al. Nisin treatment for inactivation of Salmonella species and other gram-negative bacteria. Appl Environ M icrobiol, 1991, 57(12): 3613-3615.
[13] M ierau I, K leerebezem M. 10 years of the nisin-controlled gene expression system (NICE) in Lactococcus lactis. Appl M icrobiol Biotechnol,2005, 68: 705-717.
[14] van Kraaij C, de Vos WM, Siezen RJ, et al. Lantibiotics: biosynthesis, mode of action and applications. Nat Prod Rep, 1999, 16(5): 575-587.
[15] de Oliveira Junior AA, de Araújo Couto H, Barbosa AAT, et al. Stability, antim icrobial activity, and effect of nisin on the physico-chem ical properties of fruit juices. Int J Food M icrobiol, 2015, 211:38-43.
[16] Qi XB, Poernomo G, Wang K, et al. Covalent immobilization of nisin on multi-walled carbon nanotubes: superior antimicrobial and anti-biofilm properties. Nanoscale, 2011, 3(4): 1874-1880.
[17] Jin T, Zhang H. Biodegradable polylactic acid polymer w ith nisin for use in antim icrobial food packaging. J Food Sci, 2008, 73(3): M 127-M 134.
[18] Jin T. Inactivation of Listeria monocytogenes in skim m ilk and liquid egg white by antimicrobial bottle coating w ith polylactic acid and nisin. J Food Sci, 2010, 75(2): M 83-M 88.
[19] Ji SW, J Lu, Liu ZG, et al. Dynamic encapsulation of hydrophilic nisin in hydrophobic poly (lactic acid) particles w ith controlled morphology by a single emulsion process. J Colloid Int Sci, 2014,423: 85-93.
[20] Jacquel N, Lo CW, Wu HS, et al. Solubility of polyhydroxyalkanoates by experiment and thermodynamic correlations. AIChE J, 2007,53(10): 2704-2714.
[21] M eng FQ, Zhao HZ, Zhang C, et al. Expression of a novel bacteriocin-the plantaricin Pln1-in Escherichia coli and its functional analysis. Prot Exp Purif, 2015, 119: 85-93.
[22] de la Fuente-Salcido NM, Castañeda-Ramírez JC,García-A lmendárez BE, et al. Isolation and characterization of bacteriocinogenic lactic bacteria from M-Tuba and Tepache, two traditional fermented beverages in México. Food Sci Nutr,2015, 3(5): 434-442.
[23] Rocha M, Ferreira FA, Souza MM, et al. Antimicrobial films a review//Méndez-Vilas A, ed. M icrobial pathogens and strategies for combating them: science, technology and education. Formatex Research Center, 2013: 23-31.
[24] Zhong J, Liu G, Huan LD. Genetic analysis of lantibiotic biosynthetic gene clusters. Chin J Antibiotics, 2006, 31: 513-517 (in Chinese).
钟瑾, 刘刚, 还连栋. 羊毛硫细菌素生物合成基因簇的遗传分析. 中国抗生素杂志, 2006, 31: 513-517.
[25] Lu Y, Jiang LK, Chen ML, et al. Improving heat and pH stability of nisin by site-directed mutagenesis. Acta M icrobiol Sin, 2010, 50(11): 1481-1487 (in Chinese).
路遥, 蒋立科, 陈美玲, 等. 通过定点突变提高乳链菌肽对热及 pH的稳定性. 微生物学报,2010, 50(11): 1481-1487.
(本文责编 郝丽芳)
November 17, 2015; Accepted: February 1, 2016
Preparation and characterization of polyhydroxyalkanoate biop lastics w ith antibacterial activity
Qiu li Lou1, Yim ing M a2, Xuem ei Che2, Jin Zhong3, Xiaoxia Sun1, and Haoqian Zhang2
1 College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China
2 BluePHA (Beijing) Co., Ltd, Beijing 100084, China
3 Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Polyhydroxyalkanoates (PHAs), as a novel class of biopolymer, are attracting more attention due to their diverse material properties and environment-independent biodegradability. Here we report the preparation of PHA exhibiting efficient antibacterial activity by embedding Nisin, a food additive generally recognized as safe, into poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) (PHBHHx), a type of PHA w ith high biocompatibility. We first prepared Nisin-containing PHBHHx films using solvent casting method. Confocal laser scanning m icroscopy analysis showed that a well-mixed integrated structure of the films w ith an even distribution of the Nisin particles in the PHBHHx matrices. Then the antim icrobial activity of PHBHHx/Nisin films against M icrococcus luteus was quantified on agar plate by measuring the size of inhibition zone. Cultivation in liquid media further confirmed the releasing of Nisin from the films and the long-time antibacterial activity. Results showed that the threshold of Nisin concentration for long-time and effective inhibition against bacteria grow th is 25 μg/g. These results altogether establish a technological foundation for the application of PHA in biomedicine and food industry.
polyhydroxyalkanoate, Nisin, antibacterial plastics, M icrococcus luteus
Corresponding authors: Xiaoxia Sun. Tel: +86-591-83789367; E-mail: joesxiaox@163.com Haoqian Zhang. Tel: +86-10-62757544; E-mail: zhanghaoqian@bluepha.com
