拟南芥阿拉伯糖-5-磷酸异构酶的原核表达、纯化及酶催化特性
2016-09-13屈亚平张智俊王超莉王蕾吴林军
屈亚平,张智俊,王超莉,王蕾,吴林军
浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300
工业生物技术
拟南芥阿拉伯糖-5-磷酸异构酶的原核表达、纯化及酶催化特性
屈亚平,张智俊,王超莉,王蕾,吴林军
浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300
屈亚平, 张智俊, 王超莉, 等. 拟南芥阿拉伯糖-5-磷酸异构酶的原核表达、纯化及酶催化特性. 生物工程学报, 2016,32(8): 1060-1069.
Qu YP, Zhang ZJ, Wang CL, et al. Expression, purification and characterization of arabinose-5-phosphate isomerase from Arabidopsis thaliana. Chin J Biotech, 2016, 32(8): 1060-1069.
阿拉伯糖-5-磷酸异构酶 (KdsD) 是 2-酮-3-脱氧辛糖酸 (KDO) 生物合成途径的第一个关键限速酶,通过无缝克隆技术将拟南芥KdsD基因构建至原核表达载体pET-HTT,经过IPTG诱导,在大肠杆菌BL21 (DE3)中获得了大量重组蛋白的可溶性表达;表达产物经Ni-NTA亲和层析和分子筛层析 (SEC) 方法进行酶蛋白的分离纯化步骤,得到纯度85%以上的高纯度酶;分子筛层析结果发现纯化后的目的蛋白KdsD在溶液中主要以多聚体、二聚体和单体形式存在,这同微生物来源KdsD酶在溶液中以四聚体形式存在很大差异;进一步使用Western blotting和MALDI-TOF MASS技术对纯化的蛋白进行鉴定;测定了拟南芥KdsD酶学性质,证明该酶催化反应的最适pH值为8.0,最适作用温度为37 ℃,各种金属离子在低浓度均对酶活性存在不同程度的抑制作用,其中以Co2+、Cd2+对酶活性的抑制作用最强,而5 mmol/L金属螯合剂EDTA对酶有激活作用。此外,以阿拉伯糖-5-磷酸 (A5P) 为底物时,拟南芥KdsD酶动力学常数Vmax和Km值分别为0.18 mmol/(L·min)、0.16 mmol/L,比较发现该酶与底物的亲和性高于大肠杆菌KdsD。以上研究结果为KdsD蛋白结构与功能及其在新型抗生素研制领域中的工业化应用奠定了基础。
拟南芥,阿拉伯糖-5-磷酸异构酶,重组表达,分离纯化,MALDI-TOF MASS,酶学性质
阿拉伯糖-5-磷酸异构酶 (Arabinose-5-phosphate isomerase,KdsD,EC 5.3.1.13),在自然界中分布广泛,参与生物体糖代谢,在微生物和植物糖代谢方面具有重要价值。KdsD是2-酮-3-脱氧辛糖酸 (KDO) 生物合成途径中的关键酶,可以催化核酮糖-5-磷酸 (D-ribulose 5-phosphate,Ru5P) 的异构化,从而产生KDO生物合成途径中的第一个中间产物 D-阿拉伯糖-5-磷酸(D-arabinose 5-phosphate,A5P)[1]。因此,该酶是KDO生物合成途径中的上游关键限速 酶[2]。最初研究发现,KDO是革兰氏阴性菌 (G¯) 脂多糖 (LPS) 中的八碳糖[3-5],可将LPS中O-抗原与类脂A链接并共同嵌入到细胞外膜形成完整的细胞壁[6]。此外,在酵母及动物细胞中还未有KDO存在的证据。因此,阻断细胞壁中 KDO的合成会导致G¯细胞生长的停滞,最终可达到抑制G¯细胞生长的目的[4]。鉴于该途径在G¯细胞中非常保守,以KdsD为靶标及KDO衍生物的药物分子设计和开发,可达到抑制G¯细胞生长并降低病原菌耐药性,这就为新型抗生素的研发提供了新的思路。已有研究报道,KDO类似物具有抑制G¯细胞生长的作用;而基于KDO代谢途径中 KdsD及其他相关酶作为药物靶标进行药物开发的研究也日益受到重视[6]。
近年来发现KDO同样存在于高等植物与藻类植物果胶多糖中[4,7-9],主要参与植物细胞壁的构成[10]。果胶作为植物体内含量丰富的一种多糖,具有优良的乳化性和凝胶性及多种生理功效,可以作为一种新的药物资源和保健食品功能因子,在医学及食品等行业有着很广泛的用途[11]。果胶类多糖中的鼠李半乳糖醛酸聚糖-II (Rhamnogalacturonans II,RG-II)[12-13]至少由12种不同成分的糖基残基组成,尽管KDO是一种少见的八碳糖,但其却是RG-II构成所必需的组分[5]。因此,在植物细胞中KdsD酶对于果胶类多糖的合成具有重要作用。类似的,为了减轻病原菌及其耐药性对农作物产量的影响,减少经济损失,基于KdsD及其相关酶为靶标的新型农药开发,对于保证农业健康发展具有重要意义,但植物KdsD相关研究尚处于起步阶段,阻碍了KdsD酶的进一步的应用。
在大肠杆菌Escherichia coli中,旁系同源KdsD和GutQ基因可编码KdsD,该酶具有328个氨基酸残基,通过对大肠杆菌和绿脓杆菌KdsD基因定点突变确定了与催化相关的重要的保守残基:大肠杆菌的Lys59、His88和His193对应于绿脓杆菌的Lys56、His85和His190[14-16]。进一步利用原核表达及分离纯化,该酶晶体结构于2010年已经被成功解析,空间为同源四聚体[17]。每个KdsD亚基包含两个不同的结构域:N-末端糖异构酶 (SIS) 结构域,主要参与磷糖异构化作用,以及一个未知功能的胱硫醚-β-合酶 (CBS) 结构域。自 2000年拟南芥全基因组测序完成之后,利用拟南芥突变体来研究果胶多糖的合成和功能开始受到重视[18-20]。其中植物KDO途径中拟南芥基因 (AtKdsD,At3g54690)已被确定[6],但同大肠杆菌KdsD基因序列差异很大,且由于植物中KdsD蛋白尚未纯化出来,基于植物来源的 KdsD酶功能及催化作用机制、酶的催化特性及其应用等科学问题仍需深入研究。
本研究在拟南芥KdsD基因克隆的基础上,着重进行了该基因的原核表达、蛋白纯化和酶学性质研究,研究结果不仅为后续植物来源KdsD基因功能及晶体学结构的研究奠定了基础,而且对于今后植物果胶类多糖生物合成及新型植物农药研发具有重要参考价值。
1 材料与方法
1.1材料
1.1.1菌株与试剂
大肠杆菌 Escherichia coli菌株 DH5α和BL21 (DE3)、原核表达载体pET-HTT均由本实验室保存;Super efficiency fast seam less cloning kit购自上海德聚生物科技有限公司;DNA胶回收试剂盒和质粒抽提试剂盒购自上海生工生物工程股份有限公司。A5P与Ru5P购自Sigma (美国);其他试剂均为国产分析纯。
1.1.2仪器与设备
高压蒸汽灭菌器 (SANYO MLS-3750)、PCR仪 (Gene Amp®PCR System 9700)、离心机(Himac CF 16RX versatile Compact Centrifuge)、PYX-DH350恒温培养箱、GL-25M高速冷冻离心机 (上海卢湘仪离心机仪器有限公司);AKTA纯化仪器、酶标仪。
1.2方法
1.2.1KdsD表达载体的构建
从NCBI数据库中获得拟南芥的KdsD基因序列,设计无缝克隆引物。上游Bam HⅠ酶切位点引物 5′-GTATTTTCAGGGATCC ATGGGAT CTCTTCCACCGCC-3′;下游Hin d Ⅲ酶切位点引物 5′-GTGCGGCCGCAAGCTT GAGACCAG CTGAAACCAAAC-3′ (下划线为酶切位点)。以拟南芥的cDNA为模板进行PCR扩增 (20 μL):cDNA 1.0 μL,10×缓冲液2.0 μL,dNTPs (2.5 mmol/L)2.0 μL,上、下游引物 (10 μmol/L)各1 μL,Easy Taq DNA聚合酶 (5 U/μL)0.2 μL,补充ddH2O 至20 μL。PCR扩增程序:94 ℃预变性5 m in;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸10 m in。经PCR扩增,纯化回收,连接pET-HTT表达载体 (该载体带有His标签),得到重组质粒。转化至E. coli DH 5α,筛选PCR阳性克隆送上海生工进行DNA测序。
1.2.2KdsD基因的表达和重组酶的分离纯化
将构建好的重组表达质粒转化到 E. coli BL21 (DE3) 中,挑取阳性单克隆,接种在2 m L LB液体培养基 (K+) 中,37 ℃摇床培养,OD600达到0.5-0.8时,加入终浓度为0.4 mmol/L的IPTG诱导,分别在 37 ℃摇床上诱导 3 h,在20 ℃摇床上过夜诱导,最后收集菌体。超声破碎,用SDS-PAGE胶检测蛋白表达情况。进一步将菌株接种于 1 L LB培养基中进行扩大培养。加入诱导剂后,菌液在20 ℃、220 r/m in条件下过夜培养。4 000 r/m in离心收集菌体,细胞沉淀使用含1 mol/L NaCl,20 mmol/L Tris-HCl 及 5%甘油缓冲液复溶后,在超声仪上破碎细胞,然后20 000 r/m in、4 ℃条件下离心45 m in收集上清液,并将上清转移至镍柱,置于摇床缓慢结合1 h后,分别用低浓度咪唑缓冲液 (20、30、40 mmol/L咪唑,200 mmol/L NaCl,20 mmol/L Tris-HCl) 除去杂蛋白,用高浓度咪唑缓冲液 (200 mmol/L咪唑,200 mmol/L NaCl,20 mmol/L Tris-HCl) 洗脱目的蛋白,经过超滤管浓缩脱盐后收集目的蛋白的组分;配置 20 mmol/L Tris-HCl (pH 8.0),200 mmol/L NaCl缓冲溶液,平衡分子筛层析柱 (SEC) SuperoseTM12 10/300 GL柱子后,取500 μL超滤浓缩蛋白样品上样。SEC洗脱流速为0.5 m L/m in,并分别按照每管0.5 m L收集各洗脱峰,经SDS-PAGE胶检测蛋白的纯度,超滤浓缩后置于-80 ℃保存。
1.2.3KdsD的Western blotting检测及MALDITOF MS分析
Western blotting检测:取100 μL蛋白样品进行12% SDS-PAGE电泳,之后将分离后的蛋白从凝胶转移到PVDF 膜上。浸泡于20 m L的1×Detector Block solution封闭缓冲液,摇床振荡1 h;加入10 μL his DetectorTMNickle-Ap,室温振荡孵育1 h;1×TBST洗膜3次,各5 min;最后用10 m L BCIP/NBT显色1-15 m in,一旦出现蛋白条带,立即用去离子水终止反应,至膜干燥拍照。
MALDI-TOF MS分析:将目的蛋白通过电泳分离、考马斯亮蓝染色,脱色液脱色后,切割目的条带,送上海博苑生物科技有限公司做多肽指纹图谱鉴定分析。蛋白定量采用BCA法,以牛血清蛋白作为标准蛋白。
1.2.4酶活性测定
酶活性测定采用半胱氨酸-咔唑法[21-22]。在96孔板中进行活力测定,200 μL反应混合液包括 100 mmol/m L Tris-HCl (pH 8.0),25 μL At KdsD,25 μL 2 mmol/L A 5P ,50 μL 12.5 mol/L H2SO4。At KdsD和缓冲液在37 ℃预温育3 m in,然后加入A5P开始反应5 m in,最后加入50 μL 12.5 mol/L H2SO4终止反应,采用半胱氨酸-咔唑法显色,用酶标仪测定540 nm吸光值。酶活力单位 (U)定义为:在37 ℃、pH 8.0条件下,以A5P为底物,每分钟催化产生1 μmoL的Ru5P所需的酶量。所有酶活性测定结果均为 3次重复平均试验数据的平均值。
1.2.5重组酶的性质分析
最适反应温度测定:将反应温度控制在25-65 ℃范围内,每间隔10 ℃下进行酶促反应(pH 8.0),然后测定酶活,测定结果取3次重复平均试验数据的平均值。最高酶活性设为100%,用来计算相对酶活性的变化。
最适pH测定:在37 ℃条件下,pH 6.0-9.0范围内每隔0.5测定酶活,每个样品设3个平行组,结果取平均值。以最高酶活力为100%,计算相对酶活力。
金属离子及酶抑制剂对酶活性的影响:分别取浓度为100 mmol/L的Cu2+、Zn2+、Se2+、Li+、Na+、Ca2+、M n2+、M g2+、K+、Fe3+、Co2+等12种金属离子及金属蛋白酶抑制剂EDTA分别与酶液混合,使离子终浓度为5 mmol/L,在最适反应条件下测定酶活,酶活测定结果为 3次重复平均试验数据的平均值。以未经处理的酶液的酶活力为100%,绘制酶活力金属离子曲线。
酶的动力学常数的测定:以A5P为底物,分别配制 0.2-10 mmol/L的底物,缓冲液选取100 mmol/L Tris-HCl (pH 8.0),然后在最适温度37 ℃下反应,测定酶活。利用Lineweaver-Burk双倒数作图法,以1/[S]为横坐标,1/V为纵坐标绘制曲线,通过米氏方程计算动力学常数。
2 结果与分析
2.1原核表达质粒的构建
以拟南芥的cDNA为模板进行无缝PCR扩增,将PCR扩增产物电泳分析后经DNA胶回收试剂盒回收,获得的目的 DNA片段直接与pET-HTT表达载体连接,产物转化入DH5α,挑取阳性菌落进行菌液PCR及测序,成功构建了原核表达载体pET-HTT-KdsD。
2.2KdsD在E. coli中的表达及纯化
将 pET-HTT-KdsD重组载体转化到表达菌株BL21 (DE3) 感受态细胞,经小量诱导表达后,SDS-PAGE检测蛋白表达及可溶性情况 (图1)。发现一条明显的表达条带,接近理论分子量39 kDa,对比不同温度蛋白的表达情况,发现蛋白在20 ℃表达量较高,故在后续试验中使用20 ℃为蛋白最佳诱导表达温度。
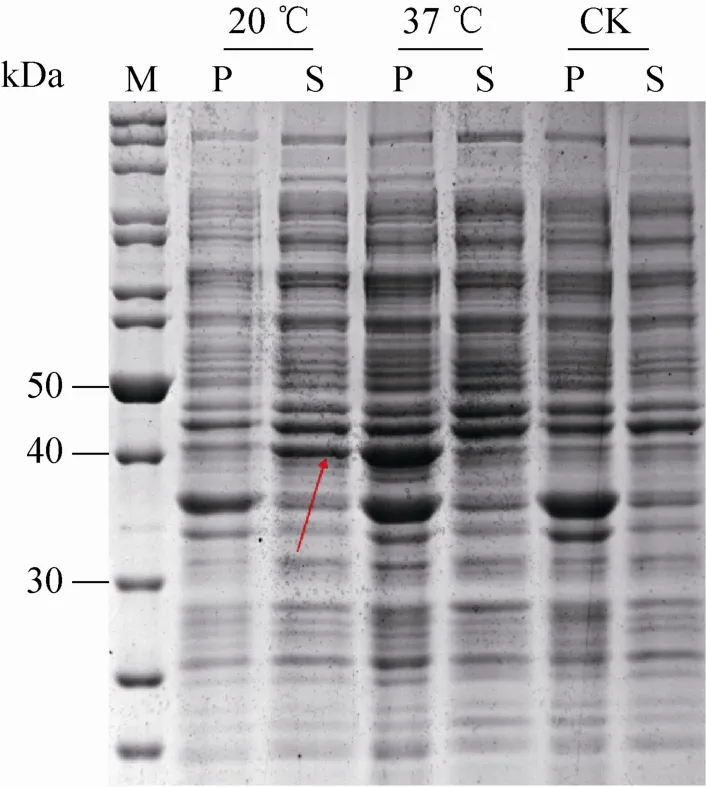
图1 At KdsD在表达菌株BL21 (DE3) 中的表达Fig. 1 Prokaryotic expression of At KdsD in BL (DE3)cell. M: molecular mass standards (kDa); 20 ℃ (P/S): cell pellet/supernatant induced by IPTG at 20 ℃; 37 ℃(P/S): cell pellet/supernatant induced by IPTG at 37 ℃ ;CK (P/S): cell pellet/supernatant not induced by IPTG.
重组蛋白使用 Ni-NTA亲和层析和分子筛层析两步法进行纯化,At KdsD Ni-NTA亲和层析SDS-PAGE检测表明 (图2):在低浓度咪唑洗脱条件下可以很好地去除杂蛋白。在高浓度咪唑200 mmol/L洗脱条件下,可以很好洗脱出条带单一的目的条带。对得到的蛋白进一步纯化,SEC结果显示:At KdsD蛋白在溶液中存在多聚体、二聚体和单体状态 (图3A)。因水溶液中 BSA分子之间快速可逆自聚可形成少量的BSA二聚体,所以BSA是一个很好的标记物。经Superose TM 12 10/300 GL层析后,对比小牛血清BSA出峰位置 (二聚体D峰对应分子量为134 kDa,单聚体E峰对应分子为67 kDa)。分子筛层析后分管收集蛋白,经SDS-PAGE胶检测 (图3B),发现不同的KdsD蛋白聚合状态的电泳条带均同KdsD理论分子量39 kDa一致,纯度为85%以上。
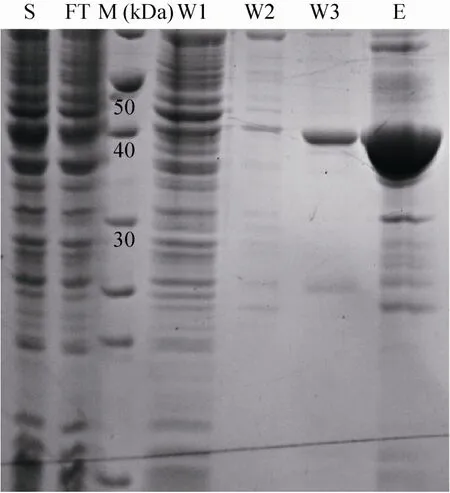
图2 At KdsD Ni-NTA亲和层析SDS-PAGE检测Fig. 2 SDS-PAGE analysis from Ni-NTA affinity chromatography of At KdsD. S: cell supernatant after induced; FT: liquid of protein and Ni-beads; M: molecular mass standards (kDa); Lanes W 1-W 3: wash in the presence of 20, 30, 40 mmol/L im idazole; E: elution w ith 200 mmol/L im idazole.
2.3KdsD的W estern blotting检测及MALDI -TOF MS分析
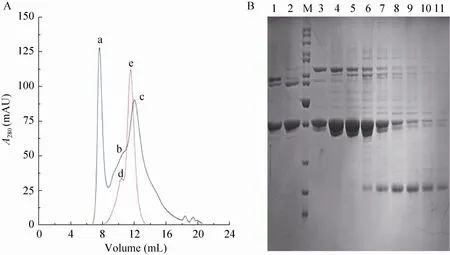
图3 At KdsD分子筛层析图 (A) 及其SDS-PAGE检测 (B)Fig. 3 Purification of At KdsD and BSA by size exclusion chromatography (A) and SDS-PAGE of SEC (B). (A) The peak of A is polymers of At KdsD, the peak of B is dimers or trimers of At KdsD, the peak of C is monomers of At KdsD, the peak of D is dimmers of BSA, the peak of E is monomers of BSA. (B) M: protein marker; 1-11: fractions of every 0.5 m L starting from 8 m L.
为确定获得的融合蛋白是目的蛋白,利用his DetectorTMNickel-Ap抗体,Western blotting检测获得的融合蛋白,结果显示有两条条带,大小约在39 kDa,基本符合上述SDS-PAGE检测的表达条带大小 (图4A)。 进一步MALDI-TOF MS分析,通过获得肽质量指纹图 (PMF) 比对后发现(图 4B):来自粗带的样品肽段序列数据库检索结果比对得分615,分子量为38.124 kDa,等电点为6.56,且与目的蛋白序列匹配度更高 (用下划线显示),说明大量纯化获得的重组蛋白是目的蛋白At KdsD。
2.4重组酶的酶学性质
酶活性测定结果表明该酶最适温度为37 ℃,在37-45 ℃范围内酶活力较高,45 ℃以上酶活力急剧下降,而在 25 ℃时仍保持在70%以上 (图5);温度为37 ℃时,该酶最适pH为8.0,属于弱碱性酶。在pH 6.0-8.0范围酶活性迅速增加,pH 7.0-8.5之间酶的活性稳定在60%以上 (图6),超出这一范围,则酶活迅速下降。

图4 At KdsD的Western blotting (A) 和质谱检测 (B)Fig. 4 Identification of recombinant protein by Western blotting (A) and mass spectrometry analysis (B). (A)Western blotting. M: protein marker; 1: purified recombinant protein. (B) M ass spectrometry results. M atched peptides underlined were identified as At KdsD.
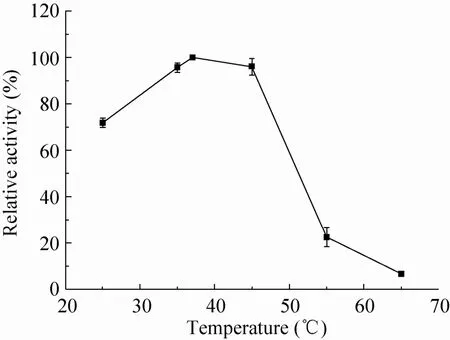
图5 温度对酶活性的影响Fig. 5 Effect of temperature on activities of recombinant enzyme. The optimal temperature of At KdsD was estimated at various temperature (25-65 ℃) in Tris-HCl buffer (100 mmol/L, pH 8.0), and the maximum activity was taken as 100%. Results are the average of three replicates.
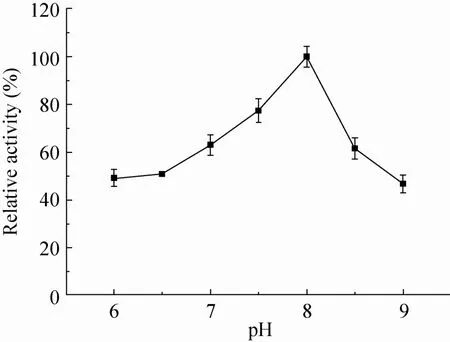
图6 pH对酶活性的影响Fig. 6 Effect of pH on activities of recombinant enzyme. The optimal pH of At KdsD was estimated at various pH (6.0-9.0). The maximum activity was taken as 100%. Results are the average of three replicates.
金属离子及金属蛋白酶抑制剂 EDTA对KdsD酶活影响结果显示 (图7),各种金属离子对酶活性存在不同程度的抑制作用。其中以Co2+、Cd2+对酶活的抑制作用最强;Cu2+、Zn2+抑制作用较弱。而EDTA对酶活性有激活作用,分析认为EDTA是通过其螯合作用减弱了金属离子对酶活性的影响,从而对酶活性起到激活作用。以A5P为底物时,在37 ℃、pH 8.0条件下,KdsD的酶促动力学常数 Vmax值为 0.18 mmol/(L·m in),Km值为0.16 mmol/L。
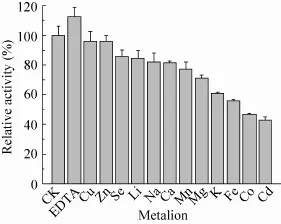
图7 金属离子及EDTA对酶活性的影响Fig. 7 Effcet of different metal ions and EDTA on At KdsD activity. Activity of KdsD as isolated was measured at 37 ℃ in the presence of various metal or EDTA (100 mmol/L Tris-HCl, pH 8.0, 2 mmol/L A5P,5 mmol/L metal or EDTA). Results are the mean of three replicates.
3 讨论
无 缝 克 隆 (Seam less cloning/in-fusion cloning)[23]是一种新的、快速、简单的克隆方法,突破传统的双酶切再连接,只需一步重组法,即可得到高效率克隆的重组载体,唯一的区别在于引物末端和载体末端具有 13-20个同源碱基,无需酶连通过碱基互补配对成环即可直接用于转化。本文通过无缝克隆技术[24]成功构建了拟南芥KdsD基因表达载体,首次实现了植物该基因在大肠杆菌内的成功表达和活性测定。研究所得 At KdsD蛋白序列,与其他文献已报道的微生物序列比对分析,发现大肠杆菌序列中关键的催化残基Lys59、His88和His193对应拟南芥的 Lys78、His107、His212是完全保守的[14-16],但是拟南芥蛋白序列与微生物蛋白序列相似度不足30%[12](图8)。推测植物KdsD与微生物中的 KdsD蛋白空间结构和催化特性可能存在一定的差异。
在酶的分离纯化过程中,通过两步法快速获得了该蛋白的纯酶液,纯度达85%以上。SEC结果显示,拟南芥KdsD在30 mmol/L Tris-HCI (pH 8.0)、200 mmo/L NaCl溶液条件下,以多种聚体、二聚体和单聚体形式存在,而微生物中KdsD的分子筛层析目的峰单一,且主要以四聚体形式存在,分析认为植物 KdsD与微生物KdsD在溶液中存在的聚体形式不同,可能与它们之间的序列差异性有关。在溶液中At KdsD蛋白究竟是以哪种聚体形式存在还需分析超速离心 (AUC)等实验做进一步的分析验证。此外,在蛋白晶体生长方面,通过KdsD晶体的初步筛选 (实验结果未发表),获得了部分蛋白晶体,但晶体形状不规则,质量尚不能达到X-ray衍射要求,究其原因与拟南芥KdsD在溶液中存在不同种类多聚体混合状态有一定关系,因为在溶液中拟南芥KdsD易形成不同多聚体状态,很大程度上会干扰均一晶核的形成,最终影响晶体质量。而微生物来源的KdsD在结晶时,其溶液中蛋白聚体状态单一,晶体均一性好,有利于获得X衍射结果并解析出结构信息。
At KdsD经酶学性质测定,该蛋白的最适反应温度为 37 ℃,与已报道的微生物中大肠杆菌CFT073的阿拉伯糖-5-磷酸异构酶性质类似[22];酶的最适pH为8.0,与大肠杆菌KdsD酶最适pH 8.4亦近似,属于偏碱性蛋白。当溶液中存在各种金属阳离子时均对酶活性有不同程度的抑制作用,其中 Cu2+、Zn2+对酶活性的抑制作用较弱,而 Co2+、Cd2+对酶活性的抑制作用最强。这说明At KdsD具有较差的金属离子耐受性。Km值表示酶与底物之间的亲和能力,Km值越大,亲和能力越弱,反之亦然。At KdsD动力学常数 Vmax值为0.18 mmol/(L·min),Km值为0.16 mmol/L,而微生物中大肠杆菌KdsD的Km为0.61 mmol/L[25-27]。两者比较发现,拟南芥KdsD的 Km值远小于大肠杆菌Km值,说明拟南芥的KdsD酶与底物之间的亲和能力更强,这种差异推测与植物和微生物之间 KdsD一级结构序列差异性和聚体存在形式所产生的空间构象不同有关。本文研究结果为后期研究 At KdsD蛋白的结构与功能奠定了基础,同时也为果胶多糖保健食品和植物新型农药的研发提供十分重要的参考。
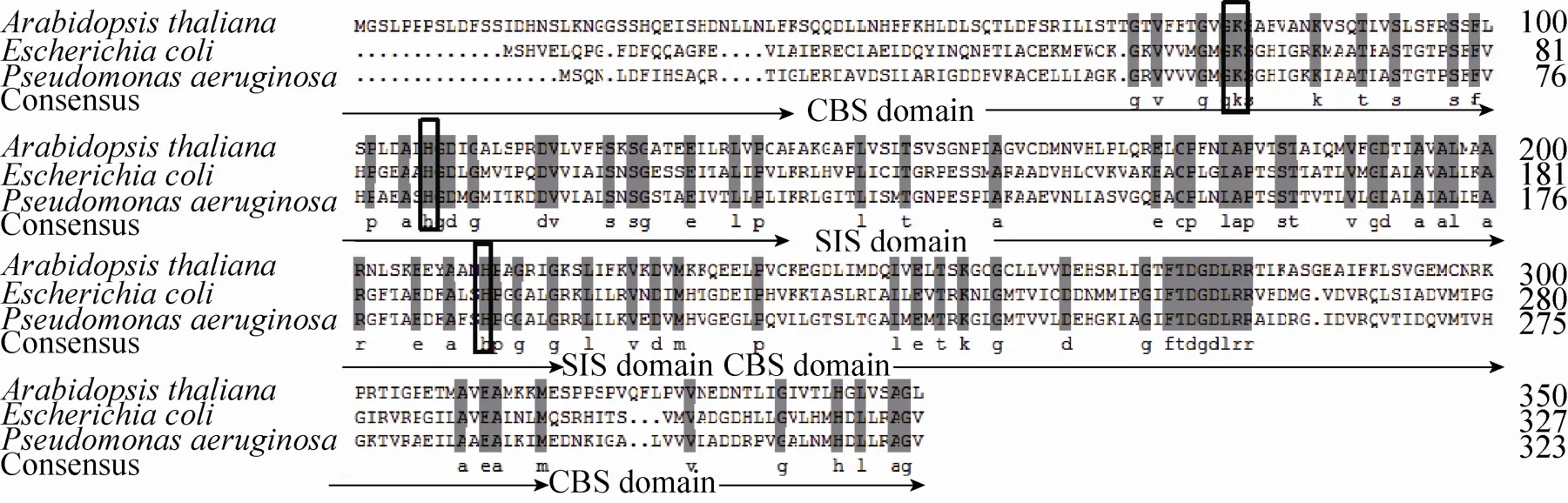
图8 不同物种KdsD氨基酸序列比对Fig. 8 A lignment of am ino acid sequence of KdsD from different species. Arabidopsis thaliana (Accession No. NP_191029.1); Escherichia coli (Accession No. NP_417664.1); Pseudomonas aeruginosa (Accession No. KGB88562.1). The unique SIS domain, CBS domain of KdsD and conserved residues of the active site are indicated by arrow and box, respectively.
REFERENCES
[1] Yin-Ling T, Anup D, Christy S, et al. KpsF is the arabinose-5-phosphate isomerase required for 3-deoxy-D-manno-octulosonic acid biosynthesis and for both lipooligosaccharide assembly and capsular polysaccharide expression in Neisseria meningitides. Biochem J, 2002, 277: 24103-24113.
[2] Delmas F, Seveno M, Northey JG, et al. The synthesis of the rhamnogalacturonan(II) component 3-deoxy-D-manno-2-octulosonic acid (Kdo) is required for pollen tube grow th and elongation. J Exp Bot, 2008, 59(10): 2639-2647.
[3] Raetz CR, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem, 2002, 71(1): 635-700.
[4] Raetz CR. Biochemistry of endotoxins. Annu Rev Biochem, 1990, 59(1): 129-170.
[5] York WS, Darvill AG, M ichael M, et al. 3-deoxy-d-manno-2-octuLosonic acid (KDO) is a component of rhamnogalacturonan II, a pectic polysaccharide in the primary cell walls of plants. Carbohydr Res, 1985, 138(85): 109-126.
[6] Smyth KM, Marchant A. Conservation of the 2-keto-3-deoxymanno-octulosonic acid (Kdo)biosynthesis pathway between plants and bacteria. Carbohydr Res, 2013, 380(2): 70-75.
[7] Edashige Y, Ishii T. Hemicellulosic polysaccharides from bamboo shoot cell-walls. Phytochemistry,1998, 49(6): 1675-1682.
[8] Guillen R, York WS, Pauly M, et al. M etabolism of xyloglucan generates xylose-deficient oligosaccharide subunits of this polysaccharide in etiolatedpea. Carboydr Res, 1995, 277(2): 291-311.
[9] Shin KS, Kiyohara H, Matsumoto T, et al.Rhamnogalacturonan II from the leaves of Panax ginseng C.A. Meyer as a macrophage Fc receptor expression-enhancing polysaccharide. Carbohydr Res, 1997, 300(3): 239-249.
[10] Becker B, Feja N, M elkonian M. Analysis of expressed sequence tags (ESTs) from the scaly green flagellate Scherffelia dubia Pascher emend. Melkonian et Preisig. Protist, 2001, 152(2): 139-47.
[11] Sun YL, Tang J. Rsearch progress in pectic polysaccharides. Food Machiney, 2004, 20(6): 60-63 (in Chinese).
孙元琳, 汤坚. 果胶类多糖的研究进展. 食品与机械, 2004, 20(6): 60-63.
[12] Schols HA, Bakx EJ, Schipper D, et al. A xylogalacturonan subunit present in the modified hairy regions of apple pectin. Carbohydr Res, 1995,279(1995): 265-279.
[13] W illats WGT, M cCartney L, Mackie W, et al. Pectin: cell biology and prospects for functional analysis. Plant Mol Biol, 2001, 47(1/2): 9-27.
[14] Silvia S, Luca De G, Paolo T, et al. Structure prediction and functional analysis of KdsD, an enzyme involved in lipopolysaccharide biosynthesis. Biochem Biophys Res Commun, 2009, 388(2): 222-227.
[15] Airoldi C, Sommaruga S, Merio S, et al. Targeting bacterial membranes: identification of Pseudomonas aeruginosa D-arabinose-5P isomerase and NMR characterisation of its substrate recognition and binding properties. ChemBioChem, 2011, 12(5): 719-727.
[16] Hsiu-Ju C, Grant JC, Farr CL, et al. Structural analysis of arabinose-5-phosphate isomerase from Bacteroides fragilis and functional implications. Acta Crystallogr, 2014, 70(Pt10): 2640-2651.
[17] Gourlay LJ, Silvia S, Macro N, et al. Proing the active site of sugar isomerase domain from E. coli arabinose-5-phosphate isomerase via X-ray crystallography. Protein Sci, 2010, 19(12): 2430-2439.
[18] Reiter WD. Arabidopsis thaliana as a model system to study synthesis, structure, and function of the plant cell wall. Plant Physiol Biochem, 1998, 36(1): 167-176.
[19] Thierry D, M ichal J, Elizabeth Faris C, et al. Organization of cellulose synthase complexes involved in primary cell wall synthesis in Arabidopsis thaliana. Proc Nati Acad Sci USA,2007, 104(39): 15572-15579.
[20] Wu J, Patel MA, Woodard R. Functional and biochem ical characterization of a recombinant Arabidopsis thaliana 3-deoxy-D-manno-octulosonate 8-phosphate synthase. Biochem J, 2004, 381(4): 185-193.
[21] Dische Z, Borenfreund E. A new spectrophotometric method for the detection and determ ination of keto sugars and trioses. J Biol Chem, 1951, 912(2): 583-587.
[22] Mosberg JA, Alejandra Y, Meredith TC, et al. A unique arabinose 5-phosphate isomerase found w ithin a genom ic island associated w ith the uropathogenicity of Escherichia coli CFT073. J Bacteriol, 2011, 193(12): 2981-2988.
[23] Zhang YW,Werling U,Edelmann W. Seam less ligation cloning extract (SLiCE) cloning method. Methods Mol Biol, 2014, (1116): 235-244.
[24] Zhang JM, Yang GH, Cheng Y, et al. One step to construct the homologous arm vector containing multi-DNA fragments. Biotechnol Lett, 2013, 24(3): 385-389 (in Chinese).
张金脉, 杨冠恒, 程艳, 等.一步法快速构建多片段连接的同源臂载体. 生物技术通讯, 2013,24(3): 385-389.
[25] Meredith TC, Woodard RW. Characterization of Escherichia coli D-arabinose 5-phosphate isomerase encoded by kpsF: implications for group 2 capsule biosynthesis. Biochem J, 2006, 395(Part2): 427-432.
[26] Meredith TC, Woodard RW. Identification of GutQ from Escherichia coli as a D-arabinose 5-phosphate isomerase. J Bacteriol, 2005, 187(20): 6936-6942.
[27] Meredith TC, Woodard RW. Escherichia coli YrbH is a D-arabinose 5-phosphate isomerase. J Biol Chem, 2003, 278(35): 32771-32777.
(本文责编 陈宏宇)
November 13, 2015; Accepted: December 30, 2015
Zhijun Zhang. Tel: +86-571-63741297; E-mail: 397942805@qq.com
Expression, purification and characterization of arabinose-5-phosphate isomerase from Arabidopsis thaliana
Yaping Qu, Zhijun Zhang, Chaoli Wang, Lei Wang, and Linjun Wu
The Nurturing Station for the State Key Laboratory of Subtropical Silviculture, Zhejiang A & F University, Lin’an 311300,Zhejiang, China
Arabinose-5-phosphate isomerase (KdsD) is the first key lim iting enzyme in the biosynthesis of 3-deoxy-D-manno-octulosonate (KDO). KdsD gene was cloned into prokaryotic expression vector pET-HTT by seam less DNA cloning method and the amount of soluble recombinant protein was expressed in a soluble form in E. coli BL21 (DE3)after induction of Isopropyl β-D-1-thiogalactopyranoside (IPTG). The target protein was separated and purified by Ni-NTA affinity chromatography and size exclusion chromatography, and its purity was more than 85%. Size exclusion chromatography showed that KdsD protein existed in three forms: polymers, dimmers, and monomers in water solution,different from m icrobial KdsD enzyme w ith the four polymers in water solution. Further, the purified protein was identified through Western blotting and MALDI-TOF MASS technology. The results of activity assay showed that the optimum pH and temperature of At KdsD isomerase activities were 8.0 and 37 ℃, respectively. The enzyme was activated by metal protease inhibitor EDTA (5 mmol/L) and inhibited by some metal ions at lower concentration, especially w ith Co2+and Cd2+metal ion. Furthermore, when D-arabinose-5-phosphate (A 5P) was used as substrate, Kmand Vmaxof At KdsD values were 0.16 mmol/L, 0.18 mmol/L·m in. The affinity of At KdsD was higher than KdsD in E. coli combined w ith substrate. Above results have laid a foundation for the KdsD protein structure and function for its potential industrial application.
Arabidopsis thaliana, arabinose-5-phosphate isomerase, heterologous expression, purification, MALDI-TOF MASS, enzyme properties
Supported by: Natural Science Foundation of Zhejiang Province (No. Y14C160039).
浙江省自然科学基金 (No. Y14C160039) 资助。
网络出版时间:2016-01-15 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20160115.1716.001.html
