图像引导组织间持续低剂量率近距离治疗在头颈恶性肿瘤中的应用及优势
2016-09-13钱莉文综述王俊杰审校北京大学第三医院肿瘤治疗中心北京1191
钱莉文 综述 王俊杰审校北京大学第三医院肿瘤治疗中心,北京1191
图像引导组织间持续低剂量率近距离治疗在头颈恶性肿瘤中的应用及优势
钱莉文综述王俊杰#审校0
北京大学第三医院肿瘤治疗中心,北京100191
图像引导的组织间持续低剂量率近距离治疗是经典放射治疗在现代跨学科的发展。该技术在给予靶区高剂量的同时,能有效地降低或者避免不良反应的发生,从而达到改善患者预后的目的。在头颈恶性肿瘤中,尤其是口底、面部、鼻旁窦、鼻咽、口咽部的肿瘤中应用广泛;复发的头颈部肿瘤及不能完全切除的肿瘤也是其适应证。依据治疗的目的不同,图像引导的组织间持续低剂量率近距离治疗可分为:根治性治疗、辅助性治疗、围手术期补充治疗及姑息治疗。
持续低剂量率近距离治疗;头颈部恶性肿瘤;应用;优势
头颈部肿瘤发病率较高,发病率在全球最常见肿瘤中排第六位。头颈部重要软组织多、解剖复杂、功能繁多、对人体外观的影响较大,故头颈部恶性肿瘤的治疗一直是临床难点,其治疗方法有手术、放疗、化疗、靶向治疗等,不同的患者在不同时期因肿瘤类型、部位、分期及自身状况各异,选择其中一种或多种治疗方式。
图像引导的组织间持续低剂量率近距离治疗是经典放射治疗在现代跨学科的发展。该技术在给予靶区高剂量的同时,能有效地避免不良反应的发生,从而达到改善患者预后的目的。在头颈恶性肿瘤中,尤其是口底、面部、鼻旁窦、鼻咽、口咽部的肿瘤中应用广泛;复发的头颈部肿瘤及不能完全切除的肿瘤也是其适应证。
本文通过查阅近10年来发表的头颈部肿瘤组织间近距离放疗的文献,对图像引导组织间插植近距离放疗在头颈恶性肿瘤中的应用、优势及相关进展做一综述。
1 历史
1898年居里夫妇发现镭,1903年Godberg等[1]用镭盐管贴近患者皮肤治疗基底细胞癌,1914年Pasteau等[2]首次使用镭管经尿道插入治疗前列腺癌,组织间植入近距离治疗已有100余年的历史。
但现代图像引导的组织间持续低剂量率放疗是近几十年随着影像技术的发展、治疗计划系统的完善开展起来的一项跨学科的新技术。目前临床最常见的图像引导方式有超声、CT、MR、内镜等。图像引导技术的发展极大提高了组织间放射源植入的准确性。
现代组织间近距离治疗常用的放射性核素见表1。用于组织间插植近距离治疗肿瘤的放射性核素,必须满足以下条件[3]:①核素衰变时放射出的射线对组织有足够的穿透力;②核素的半衰期较短;③易于制成微型粒子;④易于防护。其中198Au、125I、192Ir在临床中应用最广。
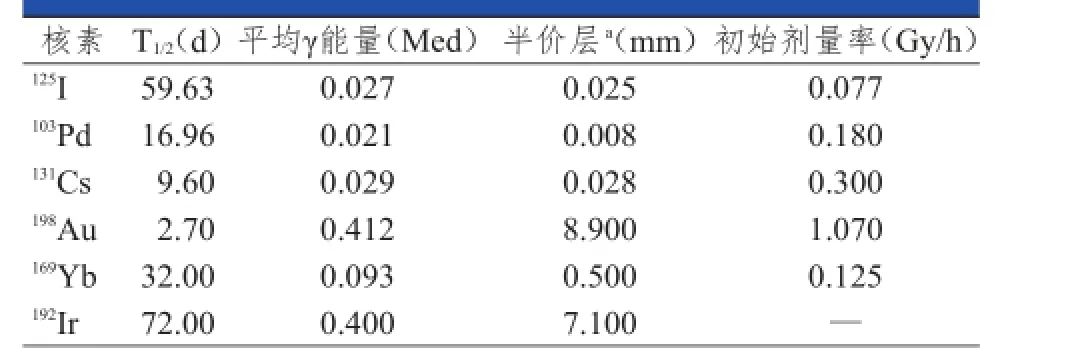
表1 常用于组织间近距离治疗的放射性核素的物理特性
2 优势
图像引导的组织间持续低剂量率近距离治疗因放射性粒子植入肿瘤部位,无组织屏蔽,能有效增加靶区的剂量,周围正常组织剂量陡降,高度适形,明显降低了放射损伤发生率。同时持续低剂量率的放疗模式:射线作用时间较长,能有效杀死肿瘤细胞,同时减少对正常组织的损伤;持续的照射对肿瘤细胞破坏更完全,生物效应更高。
在头颈部肿瘤的治疗中,图像引导的组织间持续低剂量率近距离治疗有着其他放疗技术无可比拟的优势:①功能保存完整及外形美观。因头颈部重要的软组织较多,涉及患者的基本生活功能如语言、咀嚼、吞咽、呼吸,同时头颈部是人体外观形象最主要的组成部分,故头颈部肿瘤的治疗在治疗疾病的同时,需兼顾患者功能的保存及外形的美观,尽量减少对患者生活质量及社交的影响。②不良反应较小。图像引导的组织间持续低剂量率近距离治疗属于微创的操作,且避免了周围正常组织的放射,故操作并发症及放疗相关不良反应小,患者生活质量高。Yoshimura等[4]研究显示接受持续低剂量率近距离放疗的口腔癌患者,在治疗后的第1年患者的生理和心理功能未见明显改变,生活质量较高,不良反应以轻度的黏膜炎为主,未见其他严重的不良反应。③患者适应性好。图像引导的组织间持续低剂量率放疗,操作时间较短,一般只需要局部麻醉,高龄、一般情况差或有严重合并症的患者也能很好地耐受,且不良反应的发生率未见增加[5-8]。
3 应用
3.1单一根治性放疗
图像引导的组织间持续低剂量率近距离治疗,在给予局部高剂量的同时避免周围组织的照射,是一种非常有效的早期头颈部肿瘤的局部治疗手段,其疗效与手术相当,并且在结构功能的保存和治疗相关不良反应方面优于手术,其治疗相关的严重软组织(舌、口底)损伤和下颌骨损伤的发生率为4%~15%,且随着引导技术、计划系统、布源措施的进展,其不良反应的发生率呈下降趋势[9]。以图像引导的组织间持续低剂量率近距离治疗作为单一治疗模式的患者,其生活质量较高[10]。图像引导的组织间持续低剂量率近距离治疗作为单一根治性放疗模式主要应用如下。
3.1.1首程放疗(早期病灶、局部晚期病灶) 组织间持续低剂量率近距离治疗局部疗效佳,远期不良反应较小,是早期病灶首程治疗的一种选择。该技术在早期舌癌的治疗中应用广泛,2007年日本有2/3的舌癌患者选择接受组织间持续低剂量率的放疗[9]。Nakashima等[11]比较了早期舌癌手术及组织间持续低剂量率放疗的疗效相当,5年局部复发率分别为10%、13%,区域淋巴结转移率23%、24%,总生存率为87.0%、90.7%,优先选择何种治疗方式应视患者的年龄、一般状况及可能的不良反应决定。Abdalmear等[12]报道了187例早期舌癌组织间持续低剂量率近距离放疗长期随访的结果,其15年、20年总生存率分别为88.4%、76.2%,主要不良反应为舌组织的溃疡(26%)、坏死(3%)、萎缩(2%),骨裸露(15%),放射性骨髓坏死(4%),未见口腔干燥及味觉异常。
组织间持续低剂量率近距离治疗在局部晚期病灶中也有应用。Zhang等[13]用125I放射性粒子治疗了43例不可切除的唾液腺癌,1年、2年的局部控制率为84%、77%,无3级以上放射损伤。
3.1.2再程放疗局部复发是头颈部肿瘤治疗失败的主要模式,也是头颈部肿瘤最常见的死因[14]。有20%~50%的患者在首程治疗后局部复发,且绝大部分发生在治疗后的2年内[15]。复发的头颈部肿瘤中,受限于病灶的位置、累及的范围、手术可能的并发症及患者处于自身的顾虑,只有20%左右的患者可能接受姑息性手术,其5年生存率16%~ 36%[16-18]。
头颈部肿瘤复发模式以放射野内复发为主,有80%的复发病灶位于既往放疗的高剂量区[15],另外复发病灶的放射敏感性下降,再程放疗需要更高的放疗剂量,因而头颈部肿瘤的再程放疗是一大临床挑战。目前最新的外放疗技术IMRT与SRT,与普通外照射相比能更好地保护正常组织,降低不良反应的发生,但其结果仍不尽如人意。Sulman等[19]报道IMRT治疗头颈部复发肿瘤84例,中位剂量60 Gy,2年生存率为58%,严重放疗晚期反应发生率为20%,治疗相关死亡率为1.4%。Roh等[20]使用SRT技术治疗35例头颈部复发肿瘤,中位剂量30 Gy,有效率为80%,2年生存率为30.9%,严重晚期不良反应发生率为8.6%,治疗相关死亡率为2.9%。
组织间持续低剂量率近距离治疗因其特有的物理剂量学特点,在头颈部肿瘤的再程放疗有着无可取代的地位,其疗效肯定,耐受性良好。Kwong等[21]用198Au粒子治疗106例外放疗后局部残存或复发的鼻咽癌,其中残存病灶45例、首次局部复发53例、二次局部复发8例,其5年局部控制率分别为87.2%、62.7%、23.4%(P=0.0004),5年总生存率分别为79.1%、53.6%、42.9%(P=0.0047),主要不良反应包括头痛(28.3%)、腭瘘(18.9%)、黏膜放射性坏死(16%)。Yoshimura等[22]用198Au粒子治疗62例首次198Au粒子近距离治疗后残存或复发的口腔癌,2年的局部控制率为53%、总生存率为66%,3、4级不良反应的发生率为8%。
Zheng等[23]报道15例外放疗后局部复发腮腺癌行125I放射性粒子植入术,3年、5年局部控制率为67%、53.6%;总生存率分别为76.2%、66.7%;不良反应包括皮肤溃疡(26.7%)、皮下组织纤维化(13.3%)、听力丧失(13.3%)。
3.1.3特殊部位(口周、眼睑、唇) 组织间持续低剂量率近距离治疗局部损伤小,外观保存良好,是口周眼睑部皮肤肿瘤的常用的治疗手段。Ducassou等[24]回顾性地总结了147例口周皮肤肿瘤行组织间持续低剂量率近距离治疗的疗效及外观影响,基底细胞癌和鳞癌的5年局部无复发生存率分别为90.4%、70.8%,1、2级不良反应的发生率为28.6%、7.5%,未见3级及以上不良反应,常见的不良反应为皮肤色素脱失(12.9%)、皮肤萎缩(12.9%)、毛细血管扩张(12.9%)、眼睑功能障碍(7.5%)。Krengli等[25]用192Ir线源治疗眼睑癌60例(基底细胞癌86.7%、鳞癌11.7%、梅克尔细胞癌1.7%),中位随访时间92个月,局部控制率为96.7%,2级以上不良反应发生率为3%,有68.4%的患者眼睑功能和外形良好。
在唇癌的治疗中,组织间持续低剂量率近距离治疗因简单有效并能完好的保存唇的结构和功能而得到了广泛引用。Lock等[26]用198Au治疗51例唇鳞癌,其中49例外观良好,2年无病生存率为94.1%。Rio等[27]用192Ir线源治疗89例下唇癌,5年局部控制率95%,无病生存率为82%,其中有61例患者接受了功能和外观评分,11例患者出现轻度功能障碍,外观评分(包括畸形、毛细血管扩张、色素异常、皮肤质地)良好、一般、差各占77%、21%、2%。Guibert等[28]长期随访了172例经192Ir线源治疗的唇癌,8年无复发总生存率为80%(鳞癌75%、基底细胞癌85%),各有99%和92%的患者对唇部的功能和外观保存感觉良好,治疗相关的最大的不良反应为2级。
3.1.4特殊人群①高龄、一般状况差或有严重伴随疾病的患者:图像引导组织间持续低剂量率近距离治疗,治疗过程短,手术损伤小,是高龄、一般状况差或伴有严重伴随疾病不能进行手术的肿瘤患者的一种有效的治疗手段[5-8]。Khalilur等[8]使用组织间持续低剂量率近距离治疗125例,年龄高于75岁,分期为Ⅰ~Ⅱ期的舌癌患者,3年、5年局部控制率均为86%,其疗效与年轻患者相当。Yamazaki等[6]治疗21例80岁以上的高龄舌癌患者,5年局部控制率为91%,疾病特异性生存率为83%。Ryu等[7]报道198Au放射性粒子治疗96例年龄大于75岁或一般状况差(ECOG≥2分)的Ⅰ~Ⅱ期舌癌患者,5年疾病特异性生存率为71%,局部控制率68%。Yoshimura等[5]对180例口腔癌行持续低剂量率近距离治疗的患者,按伴随疾病的严重程度分为0、1、2、3级,发现伴随疾病的严重程度不影响疾病特异性生存率、局部控制率和并发症的发生率。②青少年儿童:在青少年儿童头颈部恶性肿瘤的治疗中,图像引导组织间持续低剂量率近距离治疗也有一定的探讨。Zheng等[29]用125I粒子治疗12例青少年儿童腮腺癌(8例T2期,4例T4b),3年、5年无病生存率为91.7%、91.7%。Mazeron等[30]使用192Ir治疗16例儿童鼻唇沟横纹肌肉瘤,中位随访4.4年,中位无复发生存期为6.5个月。Zhang等[31]用125I粒子治疗8例儿童头颈部横纹肌肉瘤,中位随访43个月,5例达到完全缓解,2例部分缓解,1例死亡。
3.2与外放疗的结合
对于没有手术机会或无法耐受手术的患者,放疗是根治肿瘤或延长生存期的主要手段,提高外放疗的剂量可以提高局部控制率,但会加重正常组织的放射性损伤,增加放疗并发症。联合运用外放疗和近距离治疗是提高肿瘤照射剂量,改善实体肿瘤局部控制率和减少放疗并发症的有效模式之一。文献报道外照射联合组织间持续低剂量率近距离治疗的局部控制率随头颈部肿瘤的类型、部位、临床分期、研究方法的不同而不同,其中舌癌的5年局部控制率为64%~92%[32]。
3.3围手术期辅助治疗
组织间持续低剂量率近距离治疗是手术治疗的补充。术前、术中或术后伴有如下因素:肿瘤残存或复发的病灶、局部进展期的病变、术中出现肿瘤外溢、术后病理提示神经浸润或切缘阳性的患者,是组织间持续低剂量率近距离治疗的绝对适应证,大大地改善了患者的预后[33]。Mao等[33]报道29例腮腺腺泡癌术后14天(中位时间),对术区行组织间125I粒子植入治疗,3年、5年、10年的局部控制率分别为93.1%、88.7%、88.7%,总生存率分别为96.6%、92%、92%,所有患者未见淋巴结转移,面神经功能恢复良好,未见放疗相关并发症。
3.4挽救治疗
头颈部肿瘤复发患者经过手术根治切除、足量放疗、化疗后,部分患者不能耐受再次手术或外放疗。对这部分患者,化疗成了最主要的挽救治疗手段,然而化疗的中位生存期只有5~9个月,有效率在10%~40%[16,34-35]。与最佳支持治疗相比未能延长患者的中位生存期[36]。国内北医三院王俊杰教授领导的近距离治疗团队较早开展了头颈部复发肿瘤的超声或CT引导125I放射性粒子挽救治疗,其报道的中位生存期在11~20个月,且未见治疗相关的皮肤反应、出血及神经病变,改善了患者的症状,提高了患者的生活质量,在一定程度上延长了患者的生存期[37-39]。
4 进展与展望
图像引导组织间持续低剂量率近距离治疗具有高度“适形”(肿瘤内部照射剂量高而周围正常组织照射剂量低)、微创、简便,是治疗头颈部肿瘤的有效手段。近年来,图像引导组织间持续低剂量率近距离治疗随着影像与计划系统的改进,其布源及放射剂量更加准确可控。特异性数字模板(含有针道及面部特征信息)[40]、义齿基托布源器[41]的出现,提高了治疗精度,简化了操作,有利于图像引导组织间持续低剂量率近距离治疗的推广。
[1]Goldberg SW,London ES.XXIV.Zur frage der beziehungen zwischen becquerel-strahlen und hautaffectionen[J].Dermatologische Zeischrift,1903,10(5):457-462.
[2]Pasteau O,Degrais P.TheRadium treatment of cancer of the prostate[J].ArchRoentgenRay,1914,28(4):396-410.
[3]李忠勇,高惠波,金小海,等.近距离治疗肿瘤的放射性粒子研究进展[J].同位素,2011,24(2):118-123.
[4]YoshimuraR,Shibuya H,Miura M,et al.Quality of life of oral cancer patients after low-dose-rate interstitial brachytherapy[J].Int JRadiat Oncol Biol Phys,2009,73(3):772-778.
[5]YoshimuraR,Shibuya H,Hayashi K,et al.Disease control using low-dose-rate brachytherapy is unaffected by comorbid severity in oral cancer patients[J].Br JRadiol,2011,84 (1006):930-938.
[6]Yamazaki H,Yoshida K,Kotsuma T,et al.Age is not a limiting factor for brachytherapy for carcinoma of the node negative oral tongue in patients aged eighty or older[J].Radiat Oncol,2010,5:116.
[7]Ryu Y,Shibuya H,Hayashi K.198Au grain implantation for early tongue cancer in patients of advanced age or poor performance status[J].JRadiatRes,2013,54(6):1125-1130.
[8]KhalilurR,Hayashi K,Shibuya H.Brachytherapy for tongue cancer in the very elderly is an alternative to external beamRadiation[J].Br JRadiol,2011,84(1004):747-749.
[9]Shibuya H.Current status and perspectives of brachytherapy for head and neck cancer[J].Int J Clin Oncol,2009,14 (1):2-6.
[10]Tayier A,Hayashi K,YoshimuraR.Low-dose-rate interstitial brachytherapy preserves good quality of life in buccal mucosa cancer patients[J].JRadiatRes,2011,52(5):655-659.
[11]Nakashima T,Nakamura K,Shiratsuchi H,et al.Clinical outcome of partial glossectomy or brachytherapy in earlystage tongue cancer[J].Nihon Jibiinkoka Gakkai Kaiho, 2010,113(5):456-462.
[12]Abdalmear MM,Tomita M,Shibuya H.Long-termResults of brachytherapy in early mobile tongue cancer with 10-year minimal follow-up[J].AnticancerRes,2013,33(1): 317-324.
[13]Zhang J,Zheng L,Huang MW,et al.Radioactivity seeds interstitial brachytherapy treating malignant salivary gland tumors[J].Beijing Da Xue Xue Bao,2011,43(2):272-275.
[14]Vokes EE,WeichselbaumRR,Lippman SM,et al.Head and neck cancer[J].N Eng J Med,1993,328(3):184-194.
[15]Dawson LA,Anzai Y,Marsh L,et al.Patterns of local-regionalRecurrence following parotid-sparing conformal and segmental intensity-modulatedRadiotherapy for head and neck cancer[J].Int JRadiat Oncol Biol Phys,2000,46 (5):1117-1126.
[16]Kao J,Garofalo MC,Milano MT,et al.Rirradiation ofRecurrent and second primary head and neck malignancies:a comprehensiveReview[J].Cancer TreatRev,2003,29:21-30.
[17]De CrevoisierR,Domenge C,Wibault P,et al.Full doseReirradiation combined with chemotherapy after salvage surgery in head and neck carcinoma[J].Curr Opin Oncol, 2001,91(11):2071-2076.
[18]Temam S,Pape E,Janot F,et al.Salvage surgery after failure of very acceleratedRadiotherapy in advanced head-andneck squamous cell carcinoma[J].Int JRadiat Oncol Biol Phys,2005,62(4):1078-1083.
[19]Sulman EP,Schwartz DL,Le TT,et al.IMRTReirradiation of head and neck cancer-disease control and morbidity outcomes[J].Int JRadiat Oncol Biol Phys,2009,73(2):399-409.
[20]Roh KW,Jang JS,Kim MS,et al.Fractionated stereotacticRadiotherapy asreirradiation for locallyRecurrent head and neck cancer[J].Int JRadiat Oncol Biol Phys,2009,74(5): 1348-1455.
[21]Kwong DL,Wei WI,Cheng AC,et al.Long termResults ofRadioactive gold grain implantation for the treatment of persistent andRecurrent nasopharyngeal carcinoma[J].Cancer,2001,91(6):1105-1113.
[22]YoshimuraR,Shibuya H,Hayashi K,et al.Repeat brachytherapy for patients withResidual orRecurrent tumors of oral cavity[J].Int JRadiat Oncol Biol Phys,2012,83(4): 1198-1204.
[23]Zheng L,Zhang J,Song T,et al.PreliminaryResults of (125)I interstitial brachytherapy for locallyRecurrent parotid gland cancer in previously irradiated patients[J].Head Neck,2012,34(10):1445-1449.
[24]Ducassou A,David I,Filleron T,et al.Retrospective analysis of local control and cosmetic outcome of 147 periorificial carcinomas of the face treated with low-doseRate interstitial brachytherapy[J].Int JRadiat Oncol Biol Phys, 2011,81(3):726-731.
[25]Krengli M,Masini L,Comoli AM,et al.Interstitial brachytherapy for eyelid carcinoma.Outcome analysis in 60 patients[J].Strahlenther Onkol,2014,190(3):245-249.
[26]Lock M,Cao JQ,D'Souza DP,et al.Brachytherapy with permanent gold grain seeds for squamous cell carcinoma of the lip[J].Radiother Oncol,2011,98(3):352-356.
[27]Rio E,Bardet E,Mervoyer A,et al.Interstitial brachytherapy for lower lip carcinoma:global assessment in aRetrospective study of 89 cases[J].Head Neck,2013,35(3): 350-353.
[28]Guibert M,David I,Vergez S,et al.Brachytherapy in lip carcinoma:long-termResults[J].Int JRadiat Oncol Biol Phys,2011,81(5):e839-843.
[29]Zheng L,Zhang J,Song T,et al.125I seed implant brachytherapy for the treatment of parotid gland cancers in children and adolescents[J].Strahlenther Onkol,2013,189(5): 401-406.
[30]MazeronR,Oberlin O,Dumas I,et al.Brachytherapy in children withRhabdomyosarcomas of the nasolabial fold [J].Pediatr Blood Cancer,2014,61(7):1162-1167.
[31]Zhang Y,Guo F,Zhang WL,et al.Clinical application of 125I particle implantation in children withRhabdomysarcoma of the head and neck[J].Zhongguo Dang Dai Er Ke Za Zhi,2012,14(6):437-440.
[32]Karakoyun-Celik O,Norris CM Jr,TishlerR,et al.DefinitiveRadiotherapy with interstitial implant boost for squamous cell carcinoma of the tongue base[J].Head Neck, 2005,27(5):353-361.
[33]Mao MH,Zhang JG,Zhang J,et al.Postoperative[125I] seed brachytherapy in the treatment of acinic cell carcinoma of the parotid gland:with associatedRisk factors[J].Strahlenther Onkol,2014,190(11):1008-1014.
[34]Forastiere AA,Metch B,Schuller DE,et al.Randomized comparison of cisplatin plus fluorouracil and carboplatin plus fluorouracil versus methotrexate in advanced squamous-cell carcinoma of the head and neck:a Southwest Oncology Group study[J].J Clin Oncol,1992,10(8): 1245-1251.
[35]Wong SJ,Machtay M,Li Y.LocallyRecurrent,previously irradiated head and neck cancer:concurrentReirradiation and chemotherapy,or chemotherapy alone?[J].J Clin Oncol,2006,24(17):2653-2658.
[36]Langer CJ,Harris J,Horwitz EM,et al.Phase II study of low-dose paclitaxel and cisplatin in combination with splitcourse concomitant twice-dailyreirradiation inRecurrent squamous cell carcinoma of the head and neck:results ofRadiation Therapy Oncology Group Protocol 9911[J].J Clin Oncol,2007,25(30):4800-4805.
[37]Jiang P,Jiang Y,Wang JJ,et al.Percutaneous ultrasonography-guided permanent iodine-125 implantation as salvage therapy forRecurrent head and neck carcimonas[J].Cancer BiotherRadiopharm,2011,26(6):753-757.
[38]Jiang YL,Meng N,Wang JJ,et al.Percutaneous computed tomography/ultrasonography-guided permanent iodine-125 implantation as salvage therapy forRecurrent squamous cell cancers of head and neck[J].Cancer Biol Ther, 2010,9(12):959-966.
[39]Jiang YL,Meng N,Wang JJ.CT-guided iodine-125 seed permanent implantation forRecurrent head and neck cancers[J].Radiat Oncol,2010,30,5:68.
[40]Huang MW,Liu SM,Zheng L,et al.A digital model individual template and CT-guided 125I seed implants for malignant tumors of the head and neck[J].JRadiatRes, 2012,53(6):973-977.
[41]Tan J,Wang B,Huang Mw,et al.Denture-like applicators withRadioactive seeds for treatment of palatal malignant tumors[J].Beijing Da Xue Xue Bao,2011,43(1):145-147.
R739.91
A
10.11877/j.issn.1672-1535.2016.14.01.05
(corresponding author),邮箱:junjiewang_edu@sina.cn
2015-03-24)
