巴戟天多糖对骨质代谢相关基因的影响
2016-09-13朱孟勇吴洋洋
朱孟勇 吴洋洋
巴戟天多糖对骨质代谢相关基因的影响
朱孟勇 吴洋洋
目的 研究巴戟天多糖对骨质代谢相关基因的影响。方法 使用双能量X射线吸光测定法(DEXA)测定骨矿质元素含量(BMC)和使用一个Hologic QDR 1000和Hologic’s小动物程序测定骨矿质元素密度(BMD)。按照RNA分离试剂盒的说明分离RNA。结果 药理学分析表明能显著提高鼠骨的矿质元素密度和含量,巴戟天多糖处理能够增加骨相关基因 (BMP-2、Cbfal、Dmp1、rRANKL、rALP、rOPG、rPPARγ2 mRNA) 的表达。结论 药理学试验表明巴戟天多糖能刺激骨代谢相关基因的表达及提高骨矿质元素密度和含量。
巴戟天多糖 骨代谢相关基因
骨质疏松症是以骨质损失和骨组织微结构退行性变化为特点的骨病,伴随高龄人口的增加,发病率不断上升,是目前影响老年人生活质量的重要疾病之一,骨质疏松的发生与环境、遗传、内分泌系统变化及体内氧自由基的损伤有关。中医药防治骨质疏松具有一定的作用,巴戟天是亚洲地区治疗骨科疾病的传统中药,对于免疫反应引起的骨损伤及退行性骨病具有良好的治疗作用,其中多糖是发挥药理作用的主要成分,本文作者自2012年6月至2014年6月研究巴戟天多糖对骨矿质元素密度和含量的影响,探讨其对骨基因表达的影响。报道如下。
1 材料与方法
1.1 材料 2013年3月,作者于省内一药店购得巴戟天多糖样品。
1.2 动物和处理 32只健康雌性wistar大鼠来自浙江中医药大学试验动物中心。试验开始前,鼠养育于笼中,温度24℃,相对湿度 50%~60%,试验期间维持12h 光/暗循环,在药物处理前7d以实验鼠适应试验条件。将大鼠随机分成4组:对照组(I组)、模型组(II组)、低剂量组(III组)、高剂量组(IV组),每组各8只。模型组、低剂量组及高剂量组大鼠切除双侧卵巢后饲养4周建立骨质疏松大鼠模型,对照组及模型组灌胃生理盐水2ml/(kg·d),低剂量组及高剂量组灌胃巴戟天多糖溶液2ml/(kg·d),浓度分别为50mg/ml及150mg/ml,连续给药30d后处死大鼠,取下胫骨,胫骨组织样本立即冷冻在液氮中,贮藏温度-80℃。
1.3 骨质测定 使用双能量X射线吸光测定法(DEXA)测定骨矿质元素含量(BMC),使用Hologic QDR 1000和Hologic's小动物程序测定骨矿质元素密度(BMD)。在不同测试中心由不同的检测者使用Hologic QDR 1000对鼠后腿重复检测。然后鼠腿燃烧成灰,余矿物质称重,即测定鼠腿骨矿质元素合量。后将骨灰溶解于0.1mol/L盐酸中,由不同检测者用标准比色法测定钙、镁、磷的浓度。DEXA的测试精度由灰重量与骨矿物质浓度间的相关系数及重量比较决定。
1.4 mRNA表达 按照RNA分离试剂盒的说明分离RNA。在260/280下,通过分光光度计分析RNA纯度,RNA数量在260 nm下确定。在热模拟实体中(Gene Amp® PCR system 2400,Perkin-Elmer,Roche,NJ,USA),cDNA 由240ng的总RNA经两步逆转录聚合酶链式反应合成试剂盒 (RT-PCR) 合成。特异的寡核苷酸序列是:BMP-2 F:5'-TCAGCGAGTTTGAGTTGAGG-3'。R:5'-GATGGCTTCTTCGTGATGG-3';Cbfal F:5'-CCAAGAAGGCACAGACAGAA-3'。R:5'-TGGCTCAGATAAGAGGGGTAAG-3';Dmp1 F:5'-CTGTCCTGTGCTCTCCCTGT-3'。R:5'-TCGTCTTCATCCTCCTCCTT-3';rRANKL F:5'-GGCTGGGCCAAGATCTCTAAC-3'。R:5'-GTGTCCAACCCTTCCCTGTTG-3';rALP F:5'-CCTTGAAAAATGCCCTGAAA-3'。R:5'-CTTGGAGAGAGCCACAAAGG-3';rOPGF:5'-CTGTGAAAGCAGTGTGCAACG-3'。R:5'-AGGTTCTTGCACAGCTTCACC-3';rPPARγ2 F:5'-CCCTGGCAAAGCATTTGTAT-3'。R:5'-ACTGGCACCCTTGAAAAATG-3';GAPDH F:5'-CAAGTTCAACGGCACAGTCAA-3'。R:5'-TGGTGAAGACGCCAGTAGACTC-3'。为测定合成产品的线性范围和精确的半定量分析,使用PCR动态测试和循环测定法。在95℃维持2min有30~35变性循环。在TA退火1min,72℃底物延长。反应最后在72℃延长10 min。伴随RT-PCR 反应,排除空白对照 (无RNA 模板RT-PCR) 和RT(-) 反应 (无逆转录PCR)。PCR 产品在1.5%琼脂糖硅胶中经电泳分析,并经溴化乙锭显色。使用photographs和图像分析软件(Gel Documentation InGenius® L,Bio-Rod Lab,Hercules,CA,USA)进行定性分析。The relative amount of BMP-2,Cbfal,Dmp1,rRANKL,rALP,rOPG,rPPARγ2 mRNA表达的相对量通过与GAPDH比较计算。
1.5 统计学方法 采用SPSS17.0统计软件。计量资料以(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 巴戟天多糖对大鼠体重、BMD和BMC的影响 见表1。
表1 巴戟天多糖对卵巢切除鼠体重、BMD和BMC的影响(±s)
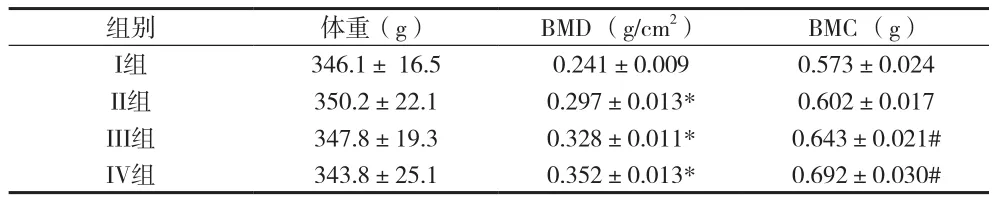
表1 巴戟天多糖对卵巢切除鼠体重、BMD和BMC的影响(±s)
注:与I组比较,*P<0.01;与II组比较,#P<0.01
组别体重(g)BMD (g/cm2)BMC (g)I组346.1± 16.50.241±0.0090.573±0.024 II组350.2±22.10.297±0.013*0.602±0.017 III组347.8±19.30.328±0.011*0.643±0.021# IV组343.8±25.10.352±0.013*0.692±0.030#
2.2 巴戟天多糖对鼠骨代谢相关基因表达的影响 与正常对照组大鼠比较,巴戟天多糖处理能够增加骨相关基因 (BMP-2、 Cbfal、Dmp1、 rRANKL、rALP、rOPG、rPPARγ2 mRNA) 的表达。在这些表达中,BMP-2、Cbfal、rRANKL、rALP 和 rPPARγ2 mRNA表达水平随巴戟天多糖处理浓度的增加而升高。
3 讨论
与其他骨形态发生蛋白类似,BMP-2 在骨与软骨发育过程中发挥着重要的作用[1]。其与hedgehog、TGF beta 信号路径及 cytokine-cytokine 受体相互作用,亦与心肌细胞分化和内皮细胞向间叶细胞过渡相关。Core-binding 因子(Cbfal)也称作Pebp2aA(多瘤病毒提升蛋白) 或AML3 (急性骨髓性白血病),属于runtdomain 基因家族的转录因子之一[2]。Cbfal/Pebp2aA 控制成骨细胞中大量基因的表达[3],Cbfal/Pebp 2a A-缺乏会导致骨发育延缓[4,5]。DMP1 是一个骨矿化的主要调节因子,其在成骨细胞向骨细胞过渡中发挥着重要作用。可能通过矿化调节,DMP1在骨细胞调节机械应力方面发挥着重要作用[6]。核因子 kappa-B 配体(RANKL)的受体也称为肿瘤坏死因子,TNF-相关激活细胞因子 (TRANCE)、骨保护素配体 (OPGL)和骨细胞分化因子 (ODF)、核因子 kappa-B 配体 (RANKL)的受体激活是一个编码人体TNFSF11基因的蛋白质[7,8]。RANKL 在骨代谢过程中和必需的表面分子 (也称作 CD254)能在骨细胞中发现,其能激活破骨细胞,破骨细胞与骨再吸收相关。ALP是成骨细胞表型信号,这一基因的时间表达说明在机械张力下MSCs向成骨细胞短期分化[9]。在骨微环境中,ODF mRNA/OPG mRNA决定了骨代谢的方向[10](合成代谢或分解代谢)。过氧化物酶体增殖激活受体 γ2 (PPARγ2)是核受体转录因子家族的成员,其能诱导多能性成骨细胞脂肪形成。如果PPARγ2在破骨细胞中表达,能抑止成熟破骨细胞表型和诱导脂肪细胞相关基因的表达[11]。
近年来,从生物中(蘑菇、藻类、地衣、高等植物)分离的多糖由于低毒性和较好的药用价值,受到生物医药科研人员的广泛关注[12]。虽然尚未完全理解这些物质的作用机制,但可以确定这些机制与免疫力相关[12]。这些生物多糖的免疫刺激、抗肿瘤、抗菌和其他的治疗效果是机体通过刺激巨细胞和调节补体系统实现的[13]。
巴戟天是一种著名的中草药,在古代中国,用其治疗一系列的病症,包括消化不良、高血压、呼吸系疾病及免疫力低下等[14]。巴戟天的主要生物活性物质是蒽醌类,此成分具有抗HIV病毒、抗炎、镇痛、抗菌、抗氧化、抗突变活力的作用[15]。
作者采用DEXA测定BMC和使用Hologic QDR 1000和Hologic's小动物程序测定BMD。按照RNA分离试剂盒的说明分离RNA。药理学分析表明能显著提高实验大鼠BMD和BMC,巴戟天多糖处理能够增加骨相关基因 (BMP-2、Cbfal、Dmp1、rRANKL、rALP、rOPG、rPPARγ2 mRNA) 的表达。药理学试验表明,巴戟天多糖能够刺激骨相关基因的表达。
1 Lorden JF,Caud1e A.Behaviora1 and endocrino1ogica1 effects of sing1e injections of monosodium g1utamate in the mouse.Neurobehaviora1 Toxico1ogy & Terato1ogy,1986,8(5):509~519.
2 Komori T,Kishimoto T.Cbfa1 in bone deve1opment.Current Opinion in Genetics & Deve1opment,1998,8(4):494~499.
3 Ducy P,Zhang R,Geoffroy V,et a1.Osf2/Cbfa1:a transcriptiona1 activator of osteob1ast differentiation.Ce11,1997,89(5):747~754.
4 Komori T,Yagi H,Nomura S,et a1.Targeted disruption of Cbfa1 resu1ts in a comp1ete 1ack of bone formation owing to maturationa1 arrest ofosteob1asts.Ce11,1997,89(5):755~764.
5 Otto F,Thorne11 AP,Crompton T,et a1.Cbfa1,a candidate gene for c1eidocrania1 dysp1asia syndrome,is essentia1 for osteob1ast differentiation and bone deve1opment.Ce11,1997,89(5):765~771.
6 Rios HF,Ye L,Dusevich V,et a1.DMP1 is essentia1 for osteocyte formation and function.Journa1 of Muscu1oske1eta1 and Neurona1 Interactions,2005,5(4):325~327.
7 Wong BR,RhoJ Arron,Robinson E,et a1.TRANCE is a nove1 1igand of the tumor necrosis factor receptor fami1y that activates c-Jun N-termina1 kinase in T ce11s.The Journa1 of Bio1ogica1 Chemist ry,1997,272(40):25190~25194.
8 Anderson DM,Maraskovsky E,Bi11ings1ey WL,et a1.A homo1ogue of the TNF receptor and its 1igand enhance T-ce11 growth and dendritic-ce11 function.Nature,1997,390 (6656):175~179.
9 Qi MC,Zou SJ,Han LC,et a1.Expression of Bone-re1ated Genes in Bone Marrow MSCs after Cyc1ic Mechanica1 Strain:Imp1ications for Distraction Osteogenesis. Internationa1 Journa1 of Ora1 Science,2009,1(3):143~150.
10 Chen D,Chen AM,Guo FJ.Expression of OPGmRNA and ODFmRNA in the patients of hip fracture due to osteoporosis.Journa1 of Nanjing Medica1 University,2007,21(5):321~323.
11 Boto1in S,Faugere MC,Ma11uche H,et a1.Increased bone adiposity and PPARγ2 expression in type I diabetic mice.Endocrino1ogy,2005,146(8):3622~3631.
12 Tzianabos AO.Po1ysaccharide immunomodu1ators as therapeutic agents: structura1 aspects and bio1ogica1 function.C1inica1 microbio1ogy reviews,2000,13(4):523~533.
13 Chihara G.Recent progress in immunopharmaco1ogy and therapeutic effects of po1ysaccharides.Deve1opments in Bio1ogica1 Standardizati on,1992,77:191~197.
14 Li YF,Gong ZH,Yang M,et a1.Inhibition of the o1igosaccharides extracted from Morinda officina1is,a Chinese traditiona1 herba1 medicine,on the corticosterone induced apoptosis in PC12 ce11s.Life Science,2003,72(8):933~942.
15 Choi J,Lee KT,Choi MY,Nam JH,et a1.Antinociceptive Antiinf1ammatory Effect of Monotropein Iso1ated from the Root of Morinda officina1is.Bio1ogica1 & Pharmaceutica1 Bu11etin,2005,28(10):1915~1918.
Objective To explore the effect of Morinda officinalis polysaccharides on bone- related genes metabolism. Methods Using dual energy X-ray ceiling light measure (DEXA) method for the determination of bone mineral content (BMC) and using a hologic QDR 1000 and hologic 's small animal procedures for the determination of bone mineral density (BMD). According to the RNA Isolation Kit specification to isolate RNA. Result Pharmacological analyses show can significantly improve bone mineral density and the content of elements,Morinda officinalis polysaccharides can increase the expression of bone- related genes (BMP-2,Cbfal,Dmp1,rRANKL,rALP,rOPG,rPPARγ2 mRNA). Conclusion Pharmacological tests show that Morinda officinalis polysaccharides can stimulate the expression of bone- related genes metabolism and improve bone mineral density and content of elements.
Morinda officinalis polysaccharides Bone- metabolism-related genes
浙江省自然科学基金资助(Ly15H270008)
310006 浙江省中医药大学附属第一医院骨伤科
