BCRP过表达对乳腺癌细胞增殖和凋亡的影响
2016-09-12于兆进余涧坤于丽凤魏敏杰赵琳中国医科大学药学院沈阳110001
于兆进,余涧坤,于丽凤,魏敏杰,赵琳(中国医科大学药学院,沈阳110001)
BCRP过表达对乳腺癌细胞增殖和凋亡的影响
于兆进,余涧坤,于丽凤,魏敏杰,赵琳
(中国医科大学药学院,沈阳110001)
目的 探讨乳腺癌耐药蛋白(BCRP)基因过表达对人乳腺癌细胞MDA-MB-435S增殖和凋亡的影响。方法取对数生长期的MDA-MB-435S细胞,将其随机分为三组,阳性转染组将真核表达质粒pcDNA3.1/BCRP经双酶切和测序鉴定后转染MDA-MB-435S细胞,阴性对照组同步转染2 μg pcDNA3.1的空质粒,空白对照组用2 mL原培养液正常培养。采用RT-PCR法和Western blotting法检测BCRP mRNA和蛋白表达。转染后48 h,每组再分设7个丝裂霉素(MMC)浓度(0.01、0.10、2.50、5.00、10.00、20.00、40.00 μmol/L)组,每个浓度组3个复孔,加入相应浓度的MMC 10 μL,采用CCK-8法检测细胞增殖情况;流式细胞术分析细胞凋亡情况。结果 重组真核表达质粒pcDNA3.1/BCRP经双酶切和测序证实该质粒构建正确;阳性转染组转染24、48、72 h后,MDA-MB-435S细胞中BCRP mRNA和蛋白表达均明显增加(P均<0.05);与阴性对照组比较,阳性转染组转染pcDNA3.1/BCRP 48 h后,细胞凋亡率无统计学差异(P>0.05);CCK-8结果显示,化疗药物MMC作用24 h后,与阴性对照组比较,阳性转染组转染pcDNA3.1/BCRP 48h后细胞存活率显著增加(P<0.05)。结论 BCRP过表达可促进人乳腺癌细胞MDA-MB-435S增殖,但对细胞凋亡无明显影响。
乳腺癌;乳腺癌耐药蛋白;细胞增殖;细胞凋亡
乳腺癌是对化疗较敏感的实体瘤之一,术后化疗可明显降低乳腺癌患者的复发率,10年生存率提高10%左右[1]。然而,内在性和获得性的多药耐药性(MDR)产生是引起化疗失败的重要原因。乳腺癌耐药蛋白(BCRP)是从耐药的人乳腺癌细胞株MCF7/AdrVP中用RNA指纹分析法分离出来的跨膜半转运蛋白,与乳腺癌耐药作用最为相关。由位于人染色体4q22的ABCG2基因编码,包含2.4 kb mRNA翻译的655个氨基酸残基、1个ATP结合域和1个疏水性跨膜结构域[2]。BCRP通过水解ATP供能将转运底物(化疗药物)从细胞内逆浓度梯度泵到细胞外[3],特异性使乳腺癌细胞内米托蒽醌、拓扑替康、阿霉素、罗丹明123等浓度下降,从而导致细胞对药物抵抗、诱导耐药性产生[4~7]。2014年11月~2015年5月,我们用pcDNA3.1-BCRP-cDNA质粒转染乳腺癌细胞MDA-MB-435S,构建BCRP基因过表达细胞模型,观察乳腺癌细胞增殖和凋亡的变化,为进一步研究BCRP在乳腺癌中的作用奠定基础。
1 材料与方法
1.1 材料 MDA-MB-435S细胞(中国医科大学药理教研室冻存),pcDNA3.1真核表达载体、感受态大肠杆菌E.Coli DH5α、小量及大量质粒提取试剂盒(天根生化科技有限公司);限制性内切酶HindⅢ、BamH I、人源性反转录酶(AMV)、Taq DNA聚合酶、T4 DNA连接酶、RNA提取试剂盒、胶回收试剂盒购自TaKaRa公司;pMD18-T克隆载体及dNTP (Promega);LipofectamineTM2000(Invitrogen);PVDF膜(美国Miliipore);引物合成及测序由上海生物工程技术公司完成;Annexin V FITC凋亡试剂盒(晶美生物工程有限公司);丝裂霉素(MMC,大连美仑生物技术有限公司);CCK-8试剂盒(日本DOjinDO)。PCR扩增仪(美国PE 9600);流式细胞仪(美国BD FACS Calibur);倒置荧光显微镜CCD成像系统(日本OLYMPUS)。
1.2 细胞培养及转染 MDA-MB-435S细胞用含抗生素的10%FBS高糖DMEM培养基,于37℃、5%CO2恒温培养箱中培养传代,转染前1 d胰酶消化,调整细胞密度至1×105/mL,每孔2 mL接种6孔板。培养18~24 h,细胞达90%融合。将细胞随机分为三组,阳性转染组取2 μg质粒加入250 μL DMEM培养基中,得到A液。取4 μL Lipofectamine 2000加于250 μL DMEM培养基中,得到B液,室温静置5 min。将A和B液混匀,室温静置20 min后均匀滴于1.5 mL细胞培养基中,轻轻晃动细胞培养板,混合均匀,分别培养24、48、72 h;阴性对照组同步转染2 μg pcDNA3.1的空质粒,其余操作同阳性转染组;空白对照组用2 mL原培养液正常培养。
1.3 质粒鉴定 将pMD18-T/BCRP重组质粒用HindⅢ和BamH I双酶切,回收BCRP cDNA片段,并与经HindⅢ和BamH I双酶切的真核表达载体pcDNA3.1进行连接反应,用连接产物转化感受态的大肠杆菌DH5α,挑取含氨苄青霉素抗性的阳性克隆,扩大培养后按质粒提取试剂盒说明书提取质粒,以HindⅢ和BamH I双酶切鉴定。细胞瞬时转染绿色荧光蛋白质粒48 h后,荧光显微镜下观察,计算带有绿色荧光的细胞百分比,转染效率=(绿色荧光细胞数/总细胞数)×100%。
1.4 BCRP mRNA表达检测 采用RT-PCR法。用TRIzol试剂提取各组细胞总RNA,紫外分光光度计定量。以随机引物于M-MLV逆转录酶的作用下逆转录合成cDNA,反应条件为30℃10 min,50℃30 min,95℃5 min,5℃5 min,1个循环。而后以反转录合成的cDNA第一链为模板进行PCR扩增,反应条件为94℃45 s,55℃45 s,72℃30 s,30个循环。
1.5 BCRP蛋白表达检测 采用RIPI蛋白裂解液提取细胞总蛋白,BCA法测定总蛋白量。取25 μg蛋白样品上样,进行10%SDS-PAGE,电泳结束取出凝胶,用转印仪将蛋白转移在PVDF膜上。转移膜经5%脱脂奶粉封闭1 h后,加入兔抗BCRP单克隆抗体(1∶500稀释),4℃孵育过夜,PBST洗膜,加入HRP标记的山羊抗兔IgG(1∶5 000稀释),室温孵育1 h,PBST洗膜,用ECL化学发光法检测BCRP蛋白表达,以β-actin作为内参,试验重复3次。
1.6 细胞存活率测算 将对数生长期的MDA-MB-435S细胞,接种至96孔板中,每孔100 μL细胞悬液(5×103个细胞),培养过夜后,阳性转染组与阴性转染组按前述方法转染阳性质粒及阴性质粒(每孔质粒和转染试剂用量为6孔板的1/20),同步设置空白对照组。转染后48 h,弃板内液体,重新加入培养基后,每组再分设7个MMC浓度组(0.01、0.10、2.50、5.00、10.00、20.00、40.00 μmol/L),每个浓度组3个复孔,加入相应浓度的MMC 10 μL,继续培养24 h后,弃板内液体,重新加入培养基,然后每孔加入CCK-8工作液10 μL,37℃孵育1 h,60 r/min振荡10 min,用安图酶标仪450 nm检测OD值,并计算细胞存活率。细胞存活率(%)=(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%。
1.7 乳腺癌细胞凋亡情况检测 采用Annexin V-FITC/PI双染法。将对数生长期细胞接种至6孔板中,每孔2 mL细胞悬液(3×105个细胞),37℃、5%CO2培养箱中培养过夜后,按前述方法转染阳性及阴性对照质粒,培养箱中培养72 h,按照凋亡试剂盒说明书上步骤进行处理并通过流式细胞仪检测。
1.8 统计学方法 采用SPSS16.0统计软件。计量资料以±s表示,多组数据比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 BCRP过表达质粒的鉴定 抽提质粒进行HindⅢ/BamHⅠ酶切后进行凝胶电泳,可见2 381 bp和5 400 bp两个基因片段,证明重组质粒中含有BCRP cDNA全长;成功构建的的重组质粒pcDNA 3.1/BCRP,片段长度为7.9 kb。电泳结果见图1。

图1 pcDNA3.1/BCRP质粒HindⅢ和BamHⅠ酶切产物的电泳分析
2.2 BCRP过表达质粒的转染效率 细胞瞬时转染绿色荧光蛋白质粒48 h后,荧光显微镜下观察可见绿色荧光,MDA-MB-435S转染效率为40.21%±4.18%。荧光显微镜照相结果见图2。

图2 荧光显微镜观察质粒转染前后的MDA-MB-435S细胞
2.3 转染pcDNA3.1/BCRP重组质粒后乳腺癌细胞中BCRP mRNA表达 重组质粒pcDNA3.1/BCRP转染MDA-MB-435S细胞后24、48、72 h,BCRP mRNA表达较空白对照组增加(68.18±12.45)%、(107.80± 22.62)%、(182.93±31.78)%(P均<0.01);阴性对照组BCRP mRNA表达(0.064±0.012)较空白对照组(0.071±0.015)无明显增加(P>0.05),见图3。
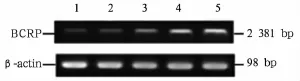
图3 RT-PCR法检测MDA-MB-435S细胞中转染重组质粒后BCRP mRNA表达
2.4 转染pcDNA3.1/BCRP重组质粒后乳腺癌细胞中BCRP蛋白表达 重组质粒pcDNA3.1/BCRP转染MDA-MB-435S细胞后24、48、72 h,BCRP蛋白表达水平较空白对照组分别增加(17.46± 4.66)%、(72.71±15.05)%和(85.34±19.56)% (P<0.05);阴性对照组BCRP表达水平(0.059± 0.008)较空白对照组(0.066±0.014)无明显增加(P>0.05)。见图4。
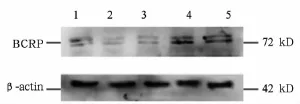
图4 Western blotting法检测MDA-MB-435S细胞中转染重组质粒后BCRP蛋白表达
2.5 BCRP基因过表达对乳腺癌细胞增殖的影响
化疗药物MMC作用24 h后,与阴性对照组比较,转染pcDNA3.1/BCRP 48 h后细胞存活率显著增加(P<0.05)。见图5。

图5 CCK-8法检测MDA-MB-435S细胞转染后细胞存活率
2.6 BCRP基因过表达对乳腺癌细胞凋亡的影响
转染后48 h,阳性转染组MDA-MB-435S细胞凋亡率(53.24%±6.86%)与阴性对照组(51.08%± 5.20%)比较无统计学差异(P>0.05),见图6。
3 讨论

图6 Annexin V-FITC/PI双染法检测三组MDA-MB-435S细胞凋亡
BCRP基因位于4q22~23,编码665个氨基酸残基。BCRP跨度超过66kb,包括16个外显子和15个内含子,转录起始位点在第二个外显子上,第一个外显子含有大量的5'端不翻译区,在此区存在三种未翻译的外显子(E1a、Elb、E1c),这些变异体在药物筛选细胞系中的表达及翻译起始位点均不同,在MCF-7细胞系中以Elc为主并被高效翻译[8]。BCRP首先在人乳腺癌细胞株中被发现,但其并非乳腺癌所特有。研究表明,以米托蒽醌(MX)诱导人结肠癌细胞株HCT-116、人小细胞肺癌细胞株GLC4、人骨髓瘤细胞株RPMI8226等获得的耐药株均可检测到BCRP过表达[9~11]。除MX外,近年来发现Topo I抑制剂拓扑替康、伊立替康等亦能诱导细胞BCRP的过表达。通过抑制BCRP的表达已成为逆转肿瘤耐药的重要手段,Xie等[12]报道,RNAi抑制人绒毛膜癌细胞中BCRP表达后,可增加细胞对化疗药物的敏感性。此外,本研究还发现,微小RNA-miR-181a、487a靶向抑制BCRP表达后,可增加乳腺癌细胞对阿霉素和米托蒽醌的敏感性[13]。
本研究应用基因重组技术构建了DH5α真核表达质粒pcDNA3.1/BCRP,经酶切和测序分析碱基排列顺序正确,没有突变,证实质粒构建成功。该质粒可在MDA-MB-435S细胞内介导BCRP的合成,使得BCRP在细胞中的表达显著增高,继BCRP过表达的耐药细胞株诱导成功之后,成功构建了BCRP过表达MDAMB-435S细胞模型。并且该质粒带有neo基因,能够进行真核细胞转染后的G418压力筛选试验,有可能筛选出BCRP基因过表达的阳性单细胞克隆,并建立目的基因过表达的细胞株。以上实验研究为阐明BCRP在乳腺癌细胞中的生物学功能及进一步研究BCRP在乳腺癌发生发展和多药耐药产生过程中的作用奠定了一定的实验基础。
进一步研究发现,MDA-MB-435S在转染pcDNA 3.1-BCRP-cDNA质粒后BCRP表达明显增加,加入MMC 24 h后细胞存活率升高,即细胞对MMC敏感性降低,该结果与BCRP可介导肿瘤细胞耐药性一致。同时细胞凋亡变化不大,但具体作用机制还需进一步研究。本实验为进一步研究BCRP在乳腺癌细胞中的作用及其机制奠定了基础,对其功能的进一步研究可能为更有效地治疗癌症提供新途径。
[1]Untch M,Konecny GE,Paepke S,et al.Current and future role of neoadjuvant therapy for breast cancer[J].Breast,2014,23 (5):526-537.
[2]Ross DD,Yang W,Abruzzo LV,et al.A typical mutidrug resistance breast cancer resistance protein messenger RNA expression in mitoxantrone-selected cell lines[J].J Natl Cancer Inst,1999,91 (5):429-433.
[3]Sugimoto Y,Tsukahara S,Ishikawa E,et al.Breast cancer resistance protein:molecular target for anticancer drug resistance and pharmacokinetics/pharmacodynamics[J].Cancer Sci,2005,96 (8):457-465.
[4]Yamagata T,Morishita M,Kusuhara H,et al.Characterization of the inhibition of breast cancer resistance protein-mediated efflux of mitoxantrone by pharmaceutical excipients[J].Int J Pharm,2009,370(1-2):216-219.
[5]Molina JR,Kaufmann SH,Reid JM,et al.Evaluation of lapatinib and topotecan combination therapy:tissue culture,murine xenograft,and phaseⅠclinical trial data[J].Clin Cancer Res,2008,14(23):7900-7908.
[6]Brooks TA,O'Loughlin KL,Minderman H,et al.The 4'-O-benzylated doxorubicin analog WP744 overcomes resistance mediated by P-glycoprotein,multidrug resistance protein and breast cancer resistance protein in cell lines and acute myeloid leukemia cells[J]. Invest New Drugs,2007,25(2):115-122.
[7]Dai CL,Liang YJ,Wang YS,et al.Sensitization of ABCG2-overexpressing cells to conventional chemotherapeutic agent by sunitinib was associated with inhibiting the function of ABCG2[J].Cancer Lett,2009,279(1):74-83.
[8]Nakanishi T,Bailey-Dell KJ,Hassel BA,et al.Novel 5 untranslated region variants of BCRP mRNA are differentially expressed in drug-selected cancer cells and in normal human tissues:implications for drug resistance,tissues-specific expression,and alternative promoter usage[J].Cancer Res,2006,66(10):5007-5011.
[9]Yamazaki R,Nishiyama Y,Furuta T,et al.Novel acrylonitrile derivatives,YHO-13177 and YHO-13351,reverse BCRP/ABCG2-mediated drug resistance in vitro and in vivo[J].Mol Cancer Ther,2011,10(7):1252-1263.
[10]Singh A,Wu H,Zhang P,et al.Expression of ABCG2(BCRP)is regulated by Nrf2 in cancer cells that confers side population and chemoresistance phenotype[J].Mol Cancer Ther,2010,9(8):2365-2376.
[11]Imai Y,Nakane M,Kage K,et al.C421A polymorphism in the human breast cancer resistance protein gene is associated with low expression of Q141K protein and low-level drug resistance[J].Mol Cancer Ther,2002,1(8):611-616.
[12]Xie N,Mou L,Yuan J,et al.Modulating drug resistance by targeting BCRP/ABCG2 using retrovirus-mediated RNA interference [J].PLoS One,2014,9(7):e103463.
[13]Jiao X,Zhao L,Ma M,et al.MiR-181a enhances drug sensitivity in mitoxantone-resistant breast cancer cells by targeting breast cancer resistance protein(BCRP/ABCG2)[J].Breast Cancer Res Treat,2013,139(3):717-730.
Influence of BCRP overexpression on proliferation and apoptosis of human breast cancer cells
YU Zhaojin,YU Jiankun,YU Lifeng,WEI Minjie,ZHAO Lin
(Department of Pharmacology,China Medical University,Shenyang 110001,China)
Objective To investigate the effect of breast cancer resistance protein(BCRP)overexpression on cell proliferation and apoptosis of breast cancer cells MDA-MB-435S.Methods MDA-MB-435S cells in the logarithmic phase were randomly divided into three groups:the positive transfection group,in which the eukaryotic expression plasmid pcDNA3.1/BCRP was identified by restriction analysis and sequencing and then was transfected into MDA-MB-435S cells,the positive control group,in which the cells were transfected with 2 μg pcDNA3.1 empty plasmid at the same time,and the blank control group,in which the cells were cultured with 2 mL nutrient solution.The mRNA and protein expression of BCRP was determined by RT-PCR and Western blotting,respectively.After 48-hour transfection,7 mitomycin(MMC)concentration groups(0.01,0.10,2.50,5.00,10.00,20.00,40.00 μmol/L)were set up in each group,each concentration group had 3 complex holes which were added with 10 μL MMC.Cell counting kit-8(CCK-8)and flow cytometry were used to determine the influence of BCRP on cell proliferation and apoptosis of MDA-MB-435S cells,respectively.Results Restriction analysis and sequencing proved that recombinant plasmid pcDNA3.1/BCRP was constructed correctly. Both the expression of BCRP mRNA and protein was up-regulated in MDA-MB-435S cells after transfection 24,48 or 72 h in the positive transfection group(P<0.05).No significant difference was found between the positive transfection group and the negative control group(P>0.05).After MMC treatment of 24 hours,CCK-8 showed that the cell survival rate in the transfection group was significantly higher than that of the negative control group(P<0.05).Conclusion BCRP overexpression promotes the proliferation of MDA-MB-435S cells,but has no significant effect on apoptosis.
breast carcinoma;breast cancer resistance protein;cell proliferation;apoptosis
10.3969/j.issn.1002-266X.2016.25.006
R737.9
A
1002-266X(2016)25-0020-04
国家自然科学基金资助项目(81573462);辽宁省高等学校优秀人才支持计划项目(LJQ2015118)。
于兆进(1983-),男,讲师,博士研究生在读,主要研究方向为分子肿瘤药理学研究。E-mail:yuzhaojin19830813@163.com
简介:赵琳(1979-),女,副教授,博士研究生,主要研究方向为分子肿瘤药理学研究。E-mail:zl_cmu@163.com
2015-11-25)
