NS-398对人结肠癌HCT-8细胞增殖、凋亡的影响及机制
2016-09-12张晓贤孙剑经刘华罗强张林西河北北方学院河北张家口075000河北北方学院附属第一医院
张晓贤,孙剑经,刘华,罗强,张林西(河北北方学院,河北张家口075000;河北北方学院附属第一医院)
NS-398对人结肠癌HCT-8细胞增殖、凋亡的影响及机制
张晓贤1,孙剑经2,刘华1,罗强1,张林西1
(1河北北方学院,河北张家口075000;2河北北方学院附属第一医院)
目的 观察Cox-2选择性抑制剂NS-398对人结肠癌细胞株HCT-8增殖及凋亡的影响,并探讨其机制。方法 取对数生长期的HCT-8细胞,加入终浓度为0、10、20、40、80、160 μmol/L的NS-398进行干预,采用CCK-8法测定NS-398对人结肠癌HCT-8细胞的抑制率;采用流式细胞术(FCM)检测细胞凋亡率,Hoechst 33342染色观察凋亡细胞核形态;0、40、80、160 μmol/L的NS-398作用癌细胞24 h后,免疫细胞化学法检测癌细胞Cox-2、Survivin蛋白表达;ELISA法检测NS-398作用前后培养液中PGE2含量;酶标仪检测Caspase-3/7的活性。结果 NS-398作用后结肠癌HCT-8细胞增殖受到抑制,抑制作用呈时间、浓度依赖性,40、80、160 μmol/L的NS-398作用后细胞生长抑制率比较差异有统计学意义(P均<0.05);FCM结果显示,40、80、160 μmol/L的NS-398作用24 h后,细胞凋亡率分别为12%、17%及26%,且呈剂量依赖性;Hoechst 33342染色显示,随着NS-398浓度的增加,核呈致密浓染状,荧光强度增加,细胞凋亡增加。40、80、160 μmol/L的NS-398作用24 h后,癌细胞Cox-2、Survivin蛋白表达较0 μmol/L的NS-398显著减少,细胞培养上清液中PGE2含量较0 μmol/L的NS-398明显下降;同时随NS-398浓度的增加,Caspase-3/7活性上调,呈剂量-效应关系。结论 NS-398可抑制人结肠癌HCT-8细胞增殖,诱导细胞凋亡,其机制可能与抑制Cox-2和Survivin蛋白表达、上调Caspase-3/7活性及抑制PGE2生成有关。
结肠癌;Cox-2选择性抑制剂;细胞凋亡;Survivin蛋白;Caspase-3/7
环氧合酶2(Cox-2)是合成前列腺素的重要限速酶,在结直肠癌中呈高表达[1]。非甾体抗炎药NS-398是Cox-2选择性抑制剂[2],能较强地抑制Cox-2表达。凋亡抑制因子Survivin通过下调效应分子Caspase-3、Caspase-7的活性阻止癌细胞凋亡[3]。2014年10月~2015年9月,我们观察了Cox-2选择性抑制剂NS-398对人结肠癌细胞株HCT-8的作用,并探讨其可能机制,为结直肠癌的新辅助治疗提供理论依据。
1 材料与方法
1.1 材料 细胞与试剂:人结肠癌细胞株HCT-8、胰蛋白酶-EDTA消化液及Caspase-3/7活细胞荧光实时法检测试剂盒均购自凯基生物科技发展有限公司;NS-398购自美国Cayman公司;RPMI1640培养基及胎牛血清均购自美国Gibco公司;CCK-8试剂盒购自北京庄盟国际生物基因科技有限公司;Hoechst 33342染色液购自北京索莱宝科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国BD公司;二步法免疫组化检测试剂盒购自北京中杉金桥生物技术公司;人前列腺素E2(PGE2)酶联免疫分析试剂盒购自美国R&D公司。仪器:BB16HF二氧化碳培养箱购自美国Thermo electron corporation;SW-CJ-1FD超净工作台购自苏州安泰空气技术有限公司;TDL-50B低速台式离心机购自上海安亭科学仪器厂;荧光倒置显微镜购自日本尼康公司;Spectra Max M2e多功能微孔板检测系统购自美国Molecular Devices公司;FACS Aria TMllu流式细胞仪购自美国BD公司。
1.2 细胞生长抑制率测算 采用CCK-8法。将HCT-8细胞培养于含胎牛血清10%,青霉素与链霉素1×105U/L的RPMI1640完全培养基中,置于37℃、5%CO2饱和湿度培养箱中培养。取对数生长期的HCT-8细胞,胰酶消化,调整细胞悬液浓度为1× 105/mL,接种于96孔板,设实验组、对照组和空白组。空白组不进行任何干预,对照组加生理盐水,实验组加药使NS-398终浓度为0、10、20、40、80、160 μmol/L,分别作用24、48 h后,每孔加入CCK-8试剂20 μL,4 h后采用多功能微孔板检测系统于450 nm波长处测OD值。根据OD值计算细胞增殖抑制率(IR),IR=[1-(实验组平均OD值-空白组平均OD值)/(对照组平均OD值-空白组平均OD值)]×100%。
1.3 细胞凋亡检测 采用Annexin V-FITC/PI双染FCM法。取1×105/mL细胞悬液接种于细胞培养瓶。0、40、80、160 μmol/L NS-398作用24 h后,收集细胞,PBS清洗,离心,弃上清,1×Binding Buffer重悬细胞,分别加入Annexin V-FITC和Propidium I-odide染液,轻轻混匀,室温避光反应15 min,流式细胞仪进行细胞凋亡检测。
1.4 细胞凋亡形态观察 采用Hoechst 33342染色法。将1×105/mL细胞悬液接种于6孔板中,每孔3 mL,0、40、80、160 μmol/L NS-398作用24 h后,吸弃培养基,清洗,每孔加入Hoechst 33342染液1 mL,避光孵育25 min,清洗,荧光倒置显微镜下观察。
1.5 Cox-2和Survivin蛋白表达检测 采用免疫细胞化学法。将1×105/mL细胞悬液接种于6孔板中。0、40、80、160 μmol/L NS-398作用24 h后,细胞固定,按照二步法免疫组化检测试剂盒说明书操作,显微镜下观察,随机计数高倍视野的细胞。根据结肠癌细胞表达产物染色阳性率分级,大于75%为强阳性(+++),25%~75%为中度阳性(++),低于25%为弱阳性(+),无阳性表达为阴性(-)。
1.6 细胞上清液中PGE2含量测定 采用ELISA法检测。取1×105/mL细胞悬液接种于细胞培养瓶。0、40、80、160 μmol/L NS-398作用24 h后,无菌管收集,2 000 r/min离心20 min后,按PGE2酶联免疫分析试剂盒说明书制作标准曲线及检测PGE2含量。
1.7 Caspase-3及Caspase-7活性测定 将1×105/ mL细胞悬液接种于96孔板,0、40、80、160 μmol/L NS-398作用24 h后,去除药物,洗涤细胞,加入Caspase-3及Caspase-7检测液,37℃,避光孵育30 min,多功能微孔板检测系统在Ex/Em=511/533 nm波长处检测荧光强度。
1.8 统计学方法 采用SPSS17.0统计软件。计量数据以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度NS-398干预后HCT-8细胞生长抑制率比较 10、20、40、80、160 μmol/L的NS-398作用HCT-8细胞24 h后,HCT-8细胞的生长抑制率分别为(7.595 ±3.253)%、(9.944±4.543)%、(15.321±2.102)%、(26.232±3.690)%、(43.418±2.185)%,40、80、160 μmol/L的NS-398作用后HCT-8细胞生长抑制率明显高于10、20 μmol/L的NS-398作用后,差异均有统计学意义(P均<0.05)。10、20、40、80、160 μmol/L的NS-398作用HCT-8细胞48 h后,HCT-8细胞的生长抑制率分别为(8.726±2.866)%、(11.867±3.453)%、(21.507±2.626)%、(36.856±2.241)%、(52.219± 2.549)%,40、80、160 μmol/L的NS-398作用后HCT-8细胞生长抑制率明显高于10、20 μmol/L的NS-398作用后,差异均有统计学意义(P均<0.05)。
2.2 不同浓度NS-398干预后HCT-8细胞凋亡率比较 HCT-8细胞凋亡在一定浓度范围内随着NS-398药物浓度的增加而增加,0、40、80、160 μmol/L 的NS-398作用HCT-8细胞24 h后,细胞凋亡率分别为3%、12%、17%及26%,不同浓度间两两比较差异有统计学意义(P均<0.01),见图1。
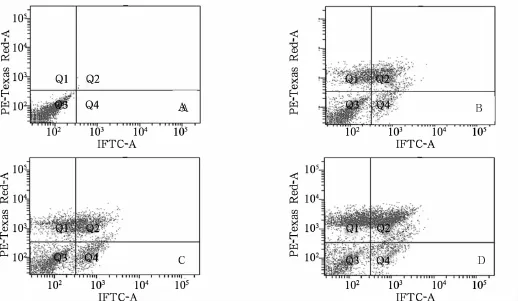
图1 不同浓度NS-398作用24 h后HCT-8细胞凋亡率
2.3 细胞凋亡形态变化 0、40、80、160 μmol/L 的NS-398作用24 h后,荧光倒置显微镜下显示一般正常细胞核为均匀的暗蓝色;细胞发生凋亡则核为亮白色,呈碎块状或致密浓染,荧光强度增加。随着NS-398浓度的增加,核呈致密浓染状,荧光强度增加,细胞凋亡增加而导致细胞数量减少,见图2。
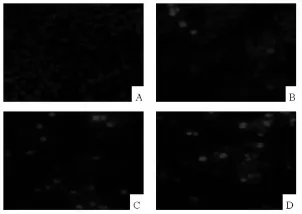
图2 荧光倒置显微镜下观察不同药物浓度NS-398作用24 h后的细胞凋亡情况(×200)
2.4 NS-398作用后HCT-8细胞中细胞Cox-2蛋白和Survivin蛋白表达比较 80 μmol/L的NS-398作用结肠癌细胞24 h后,与对照组相比,细胞中Cox-2及Survivin蛋白表达量显著减少。Cox-2蛋白表达于细胞质;Survivin蛋白表达于细胞核/质。Cox-2阳性率由82%下降为24%,由强阳性变为弱阳性,Survivin阳性率由79%下降为21%,同样由强阳性变为弱阳性,差异均有统计学意义(P均<0.01),见图3。
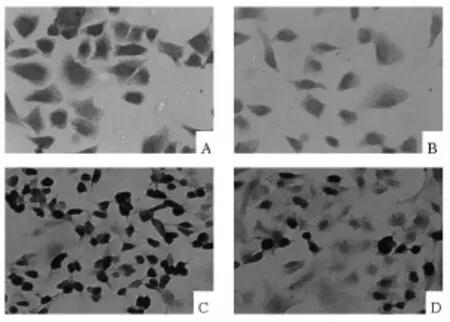
图3 NS-398作用24 h后Cox-2和Survivin 在HCT-8细胞中的表达(二步法)
2.5 不同浓度NS-398作用后细胞培养上清液中PGE2的含量比较 PGE2含量随NS-398浓度的增加而下降,呈剂量依赖性。0、40、80、160 μmol/L的NS-398作用细胞24 h后,细胞培养上清液中PGE2含量分别为(446.82±12.49)、(384.92±39.28)、(292.11±38.83)、(132.41±46.25)ng/L,各浓度间比较差异有统计学意义(P均<0.05)。
2.6 不同浓度NS-398作用后细胞中Caspase-3/7活性比较 随着NS-398浓度的增高,Caspase-3/7活性明显增加,且以高浓度为著,呈剂量依赖性。0、40、80、160 μmol/L的NS-398作用细胞24 h后,Caspase-3/7活性分别为1 260.17±151.13、1 489.99±128.24、1 718.27±159.41、1 967.04± 95.40,各浓度间比较差异有统计学意义(P均<0.05)。
3 讨论
结直肠癌是消化系统常见的恶性肿瘤之一,其癌谱位置不断攀升[4]。虽然近年有关结直肠癌的研究已取得较大进展,但治疗效果仍不十分满意。本课题从肿瘤的自主增殖和凋亡失调的角度出发,研究Cox-2选择性抑制剂抗肿瘤作用机制。
Survivin作为凋亡抑制蛋白(IAP)家族最强的凋亡抑制因子可抑制细胞凋亡,主要发挥负调控作用[5,6]。Caspase-3和Caspase-7是凋亡促进因子Caspase家族成员,具有诱导凋亡作用[7]。近年多篇文献[8,9]报道了Survivin已广泛表达于胃癌、食管癌、肺癌、宫颈癌等多种人类恶性肿瘤。国内学者对结直肠癌的研究[10]发现,癌组织中的Survivin蛋白表达明显高于正常对照黏膜,且与肿瘤淋巴转移及Duke′s分期密切相关。Survivin对细胞有丝分裂具有调节作用,并抑制细胞发生凋亡,与癌细胞的恶性度有关[11]。因此,如果Cox-2选择性抑制剂能抑制结直肠癌中Survivin表达,促进肿瘤细胞凋亡,则有望为结直肠癌患者的靶向治疗提供理论依据。
Cox是合成前列腺素的重要限速酶。其中Cox-2为诱导型酶,正常情况下一般不表达,癌蛋白、炎症刺激和细胞因子等可刺激Cox-2表达[12],促进炎症和肿瘤的发生发展。研究[13]显示,Cox-2蛋白在结肠癌的早期阶段如腺瘤中呈高表达状态。Cox-2选择性抑制剂NS-398能较强抑制Cox-2表达。近年研究发现,非甾体类抗炎药具有抗肿瘤作用,主要通过抑制Cox-2表达实现[14]。NS-398是否通过抑制Cox-2表达导致结肠癌HCT-8细胞凋亡及癌细胞中Cox-2与Survivin蛋白表达是否有关需进一步探讨。Cox-2与Survivin在多种肿瘤细胞中共同表达,且二者在刺激细胞增殖和诱导肿瘤新生血管形成、抑制细胞凋亡及促进肿瘤发生转移等方面有类似作用机制。多项研究表明,在胰腺癌[15]、胃癌[16]、宫颈癌[17]、肺癌[18]等多种肿瘤中Cox-2与Survivin表达呈正相关,推测Cox-2可能是通过上调Survivin表达而促进肿瘤发生发展。此外,Cox-2能影响Survivin表达,Cox-2选择性抑制剂能显著降低Survivin在肿瘤细胞中的水平[19,20]。这提示Cox-2选择性抑制剂可能通过抑制Cox-2表达从而影响Survivin水平。
本研究发现,NS-398对结肠癌HCT-8细胞生长有抑制作用,且呈时间和浓度依赖性。FCM结果提示,NS-398在一定浓度范围内呈剂量依赖性增加HCT-8细胞凋亡,这表明NS-398主要通过诱导凋亡作用而抑制结肠癌细胞增殖。Hoechst 33342染色观察凋亡细胞核形态亦证实了这一点。研究[21]表明,Cox-2选择性抑制剂可能通过下调Survivin水平,上调Caspase-3表达,诱导食管癌细胞凋亡。目前关于NS-398对结肠癌的作用是否通过Survivin基因的下调引起细胞凋亡研究报道较少。本研究发现,80 μmol/L的NS-398作用癌细胞24 h后,Cox-2、Survivin表达量较0 μmol/L的NS-398显著减少;同时Caspase-3/7活性明显增加。Cox-2与Survivin表达密切相关,而Survivin与Caspase-3/7表达呈明显负相关。NS-398可能通过抑制Cox-2表达,进而抑制Survivin表达,上调Caspase-3/7的活性,诱导结肠癌细胞发生凋亡。
研究[22]发现,Cox-2选择性抑制剂可使PGE2生成减少,从而逆转肿瘤免疫抑制作用。本研究结果显示,80 μmol/L的NS-398作用HCT-8细胞24 h后,PGE2含量明显低于0 μmol/L的NS-398,而Cox-2蛋白表达与PGE2水平呈正相关。因此可以推测PGE2表达降低可能是Cox-2选择性抑制剂诱导凋亡的又一证据,其具体机制有待进一步探讨。
综上所述,NS-398能显著抑制结肠癌HCT-8生长,主要通过诱导凋亡作用实现。其诱导凋亡作用机制可能是通过抑制Cox-2、Survivin蛋白表达,上调Caspase3/7活性及抑制PGE2含量而实现的。本研究有望为结直肠癌等恶性肿瘤患者的靶向治疗提供理论依据。与此同时,Cox-2选择性抑制剂诱导凋亡的具体机制尚未阐明,有待更进一步探讨。
[1]Roelofs HM,Te Morsche RH,van Heumen BW,et al.Over-expression of COX-2 mRNA in colorectal cancer[J].BMC Gastroenterol,2014,14:1.
[2]Vecchio AJ,Malkowski MG.the structure of ns-398 bound to cyclooxygenase-2[J].J Struct Biol,2011,176(2):254-258.
[3]Shin S,Sung BJ,Cho YS,et al.an anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and-7[J].Biochemistry,2001,40(4):1117-1123.
[4]陈万青,张思维,郑荣寿,等.中国2009年恶性肿瘤发病和死亡分析[J].中国肿瘤,2013,22(1):2-12.
[5]Rapti E,Gazouli M,Legaki E,et al.Association of survivin promoter polymorphisms with inflammatory bowel disease and response to antitumornecrosis factor therapy[J].Genet Test Mol Biomarkers,2015,19(6):339-343.
[6]Naumovic T,Miljus D,Djoric M,et al.Mortality from cervical cancer in Serbia in the period 1991-2011[J].J BUON,2015,20 (1):231-234.
[7]Huang H,Xu S,Li F,et al.Computed tomography-guided I seed interstitial implantation for head and neck cancer patients with unmanageablecervical lymph node metastases[J].World J Surg Oncol,2015,13(1):15.
[8]Zhang J,Zhu Z,Sun Z,et al.Survivin gene expression increases gastric cancer cell lymphatic metastasis by upregulating vascular endothelial growth factor-C expression levels[J].Mol Med Rep,2014,9(2):600-606.
[9]Lu D,Qian J,Yin X,et al.Expression of PTEN and survivin in cervical cancer:promising biological markers for early diagnosis and prognostic evaluation[J].Br J Biomed Sci,2012,69(4):143-146.
[10]陆娜娜,尹玉,曹立宇,等.大肠癌中Livin和Survivin的表达及相关性研究[J].中国组织化学与细胞化学杂志,2012,21(3):250-254.
[11]Kelly RJ,Lopez-Chavez A,Citrin D,et al.Impacting tumor cellfate by targeting the inhibitor of apoptosis protein survivin[J]. Mol Cancer,2011,10:35.
[12]Sobolewski C,Cerella C,Dicato M,et al.The role of cyclooxygenase-2 in cell proliferation and cell death in human malignancies [J].Int J Cell Biol,2010,2010:215158.
[13]Galamb O,Spisák S,Sipos F,et al.Reversal of gene expression changes in the colorectal normal-adenoma pathway by NS-398 selective COX-2 inhibitor[J].Br J Cancer,2010,102(4):765-773.
[14]Lu L,Sun HC,Zhang W,et al.Aspirin minimized the pro-metastasis effect of sorafenib and improved survival by up-regulating HTATIP2 in hepatocellular carcinoma[J].PLoS One,2013,8 (5):e65023.
[15]郭梅梅,刘江伟,贾福鑫,等.Survivin和COX-2的表达及与胰腺癌预后的关系[J].现代生物医学进展,2013,13(19):3632-3636.
[16]金锷.胃癌组织中Survivin和COX-2的表达及其相关性的研究[J].中国实用医药,2015,10(6):6-7.
[17]Zhou WQ,Sheng QY,Sheng YH,et al.Expressions of survivin,P16(INK4a),COX-2,and Ki-67 in cervical cancer progression reveal the potential clinical application[J].Eur J Gynaecol Oncol,2015,36(1):62-68.
[18]Wang J,Chen X,Hou L,et al.effects of tea polyphenols on the expression of nf-kappab,cox-2 and survivin in lewis lung carcinomaxenografts in c57bl/6 mice[J].Zhongguo Fei Ai Za Zhi,2012,15(5):271-276.
[19]Muratori C,Tamagnone L.semaphorin signals tweaking the tumor microenvironment[J].Adv Cancer Res,2012,114:59-85.
[20]Jiang X,Huang JF,Huo Z,et al.Elevation of soluble major histocompatibility complex class I related chain A protein in malignant and infectious diseases in Chinese patients[J].BMC Immunol,2012,13:62.
[21]Li S,Tian D,Fei P,et al.a cyclooxygase-2 inhibitor ns-398-enhanced apoptosis of esophageal carcinoma cell ec9706 by adjusting expression of surviving and caspase-3[J].Cancer Invest,2011,29 (2):102-106.
[22]Cannon CP,Cannon PJ.Physiology.COX-2 inhibitors and cardiovascular risk[J].Science,2012,336(6087):1386-1387.
Effect and mechanism of NS-398 on proliferation and apoptosis of human colorectal carcinoma HCT-8 cells
ZHANG Xiaoxian1,SUN Jianjing,LIU Hua,LUO Qiang,ZHANG Linxi
(1 Hebei North University,Zhangjiakou 075000,China)
Objective To observe the effects of cyclooxygenase-2(Cox-2)selective inhibitor NS-398 on proliferation and apoptosis of colorectal carcinoma HCT-8 cells and to investigate its mechanism.Methods HCT-8 cells in the logarithmic phase were added with 0,10,20,40,80 and 160 μmol/L NS-398 to intervene.The inhibition rate of colorectal carcinoma HCT-8 cells was detected by CCK-8 kit,apoptosis rate was determined by flow cytometry and the cells were stained by Hoechst 33342 and observed under fluorescent inverted microscope further.After HCT-8 cells were treated by 0,40,80 and 160 μmol/L NS-398 for 24 hours,the protein expression of Cox-2 and Survivin were detected by immunocytochemical staining.ELISA analysis were performed to detect PGE2concentration in the culture supernatant of HCT-8,and meanwhile,the activities of Caspase-3/7 were analyzed by automatic fluorescence enzyme-linked immunoassay detector.Results NS-398 inhibited the proliferation of HCT-8 cells in a time-and concentration-dependent manner,and there were significantly differences among the 40,80 and 160 μmol/L NS-398 concentration groups(all P<0.05).Flow cytometry revealed,the apoptosis rates were 12%,17%and 26%after treated by 40,80 and 160 μmol/L NS-398 for 24 hours,which was in a dose-dependent manner.Hoechst 33342 staining revealed,the apoptosis increased and cell nucleus showed highdensity fluorescence with the increase of NS-398 concentration.The expression of Cox-2 and Survivin decreased significantly after treated by 40,80 and 160 μmol/L NS-398 for 24 hours,and the level of PGE2 production also significantly decreased as compared with the group of 0 μmol/L NS-398.Meanwhile,the activity of Caspase-3/7 was activated by NS-398 in a dose-dependent manner.Conclusion Cox-2 selective inhibitor NS-398 can inhibit proliferation and induce apoptosisof the colorectal carcinoma HCT-8 cells by down-regulating the expression of Cox-2 and Survivin,PGE2 production and upregulating the activity of Caspase-3/7.
colorectal carcinoma;cyclooxygenase-2 selective inhibitor;apoptosis;Survivin protein;Caspase-3/7
10.3969/j.issn.1002-266X.2016.25.003
R979.1;R735.35
A
1002-266X(2016)25-0008-05
河北省高等学校科学技术研究重点项目(ZD20131004)。
张晓贤(1987-),女,硕士,主要研究方向为消化道肿瘤发病机制及临床研究。E-mail:15369318106@163.com
简介:张林西(1968-),男,教授,博士,主要研究方向为消化道肿瘤病理及发病机制。E-mail:zlxwxl@163.com
2016-03-11)
