谷朊粉鲜味肽的呈味规律研究
2016-09-12王丽华王金鹏金征宇徐学明
王丽华,王金鹏,金征宇,徐学明
(江南大学食品科学与技术国家重点实验室、食品学院、食品安全与营养协同创新中心,江苏无锡 214122)
谷朊粉鲜味肽的呈味规律研究
王丽华,王金鹏,金征宇*,徐学明
(江南大学食品科学与技术国家重点实验室、食品学院、食品安全与营养协同创新中心,江苏无锡 214122)
采用了超滤离心、阴离子交换色谱分离和端解酶水解的方法研究了谷朊粉肽的呈鲜规律。实验发现,分子量Mw<1000 u的肽鲜味较强,进一步采用阴离子交换树脂分离和端解酶水解Mw<1000 u的肽,发现肽的鲜味与谷氨酸含量并不成正相关关系,碱性氨基酸和酸性氨基酸的共同作用使肽呈现鲜味,以Glu为N端会使肽的鲜味增强。
鲜味肽,鲜味肽呈味规律,阴离子交换树脂,肽端解酶
鲜味是区别于酸、甜、苦、咸四种基本滋味的第五种基本滋味,对食品的滋味、可口性及可接受性起着重要的作用。鲜味最早是1908年日本科学家Ikeda[1]发现并命名的。自从1978年Yamasaki等人[2]从牛肉中分离得到鲜味肽Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala以来,肽的鲜味受到学者的广泛专注。鲜味肽相较于氨基酸类鲜味剂,其鲜味更加柔和醇厚,后味好,且与其他鲜味剂混合使用具有鲜味协同作用。同时,某些肽具有降血压、降血脂、抗氧化性等一系列生理活性[3-4],因此,鲜味肽作为鲜味剂具有广阔的市场前景。
鲜味肽主要来源于动植物水解蛋白。植物水解蛋白主要由植物蛋白经酸法或酶法水解得到。酸法生产的植物水解蛋白含盐量高,且会产生氯丙醇致癌物,对身体健康存在威胁[5-6],使其应用受到了限制。相反,酶法水解植物蛋白条件温和,不会产生致癌物且产物肽具有含量高及含盐量低等特点,备受学者关注。
目前,鲜味肽的研究仍主要集中于新鲜味肽的发现探索和酶法制备鲜味肽工艺条件的优化[7-9]。研究认为肽的鲜味与其分子量、碱性基团和酸性基团的定位存在一定关系[10-12]。然而,肽的鲜味与分子量和氨基酸组成关系并不明确,对鲜味肽本身的呈味特点及呈味规律仍需进一步探索研究。本实验采用酶法水解谷朊粉得到鲜味肽,从肽分子量大小,肽序列氨基酸组成、末端氨基酸组成入手分析鲜味肽的呈味特点及规律,为鲜味肽生产研究提供参考。
1 材料与方法
1.1材料与仪器
谷朊粉上海维京有限公司;15 mL 1 ku超滤离心管pall有限公司;15 mL 3 ku超滤离心管millipore有限公司;717强碱性阴离子交换树脂中国医药集团上海化学试剂公司;中性蛋白酶(157000 U/g)诺维信酶制剂公司;Peptidase R酶(420 U/g)天野酶制剂公司;Accelerzyme CPG酶(200 U/mL)上海帝斯曼有限公司;双(1,1-三氟乙酸基)碘苯([Bis(trifluoacetoxy)iodo]benzene,BTI)成都贝斯特试剂有限公司;其他所用试剂为分析纯或色谱纯。
TU-1900双光束紫外可见分光光度计北京普析通用仪器有限责任公司;Waters 600高效液相色谱仪美国Waters公司。
1.2实验方法
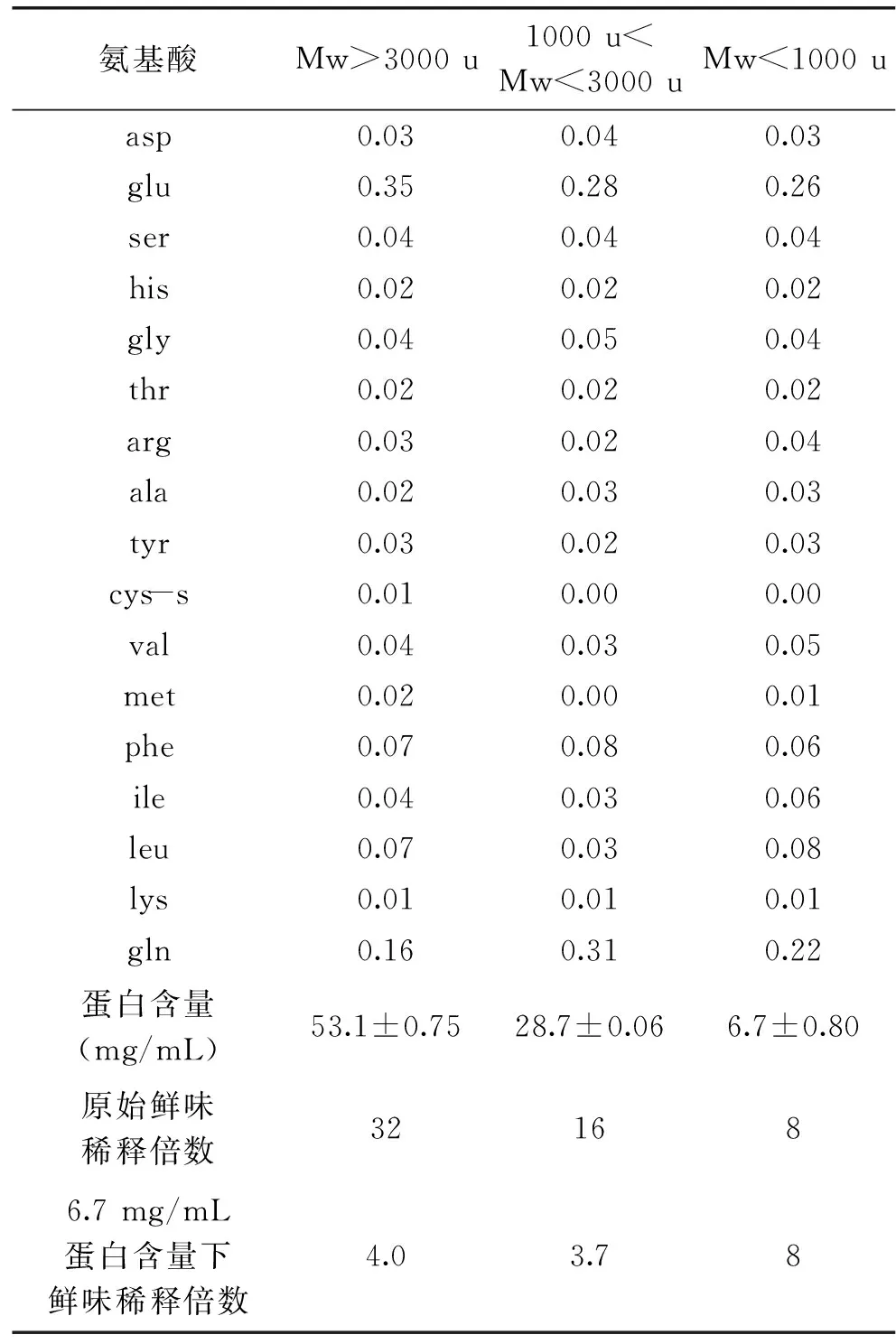
1.2.1谷朊粉鲜味肽的制备将谷朊粉均匀分散于去离子水中得到10%的悬浊液,用1 mol/L NaOH溶液调节pH至7.0,磁力搅拌1 h后置于50℃恒温水浴摇床上,以180 r/min的速度旋转,加入3000 U/g的中性蛋白酶反应2 h,沸水浴15 min灭酶,冷却至室温后,1500×g离心15 min,过滤取上清液于4℃冰箱中保存使用。
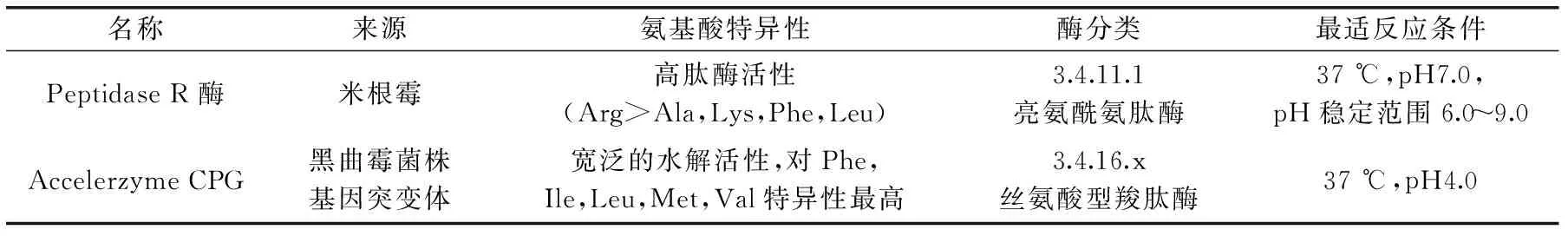
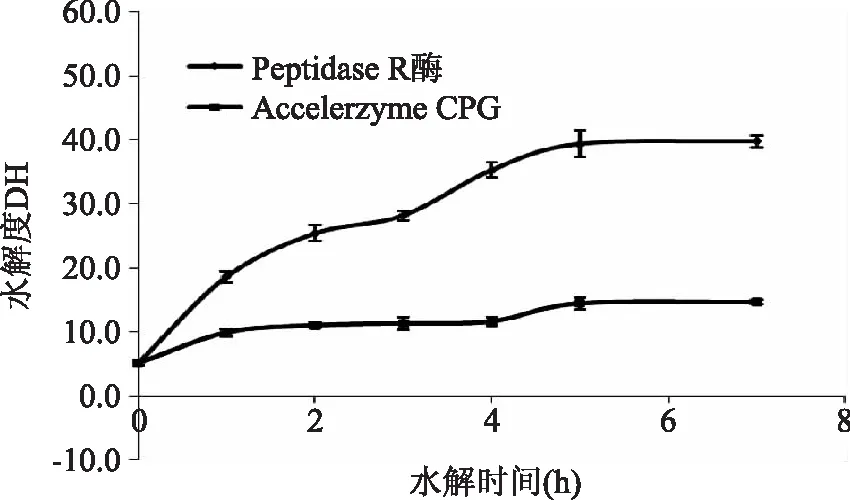
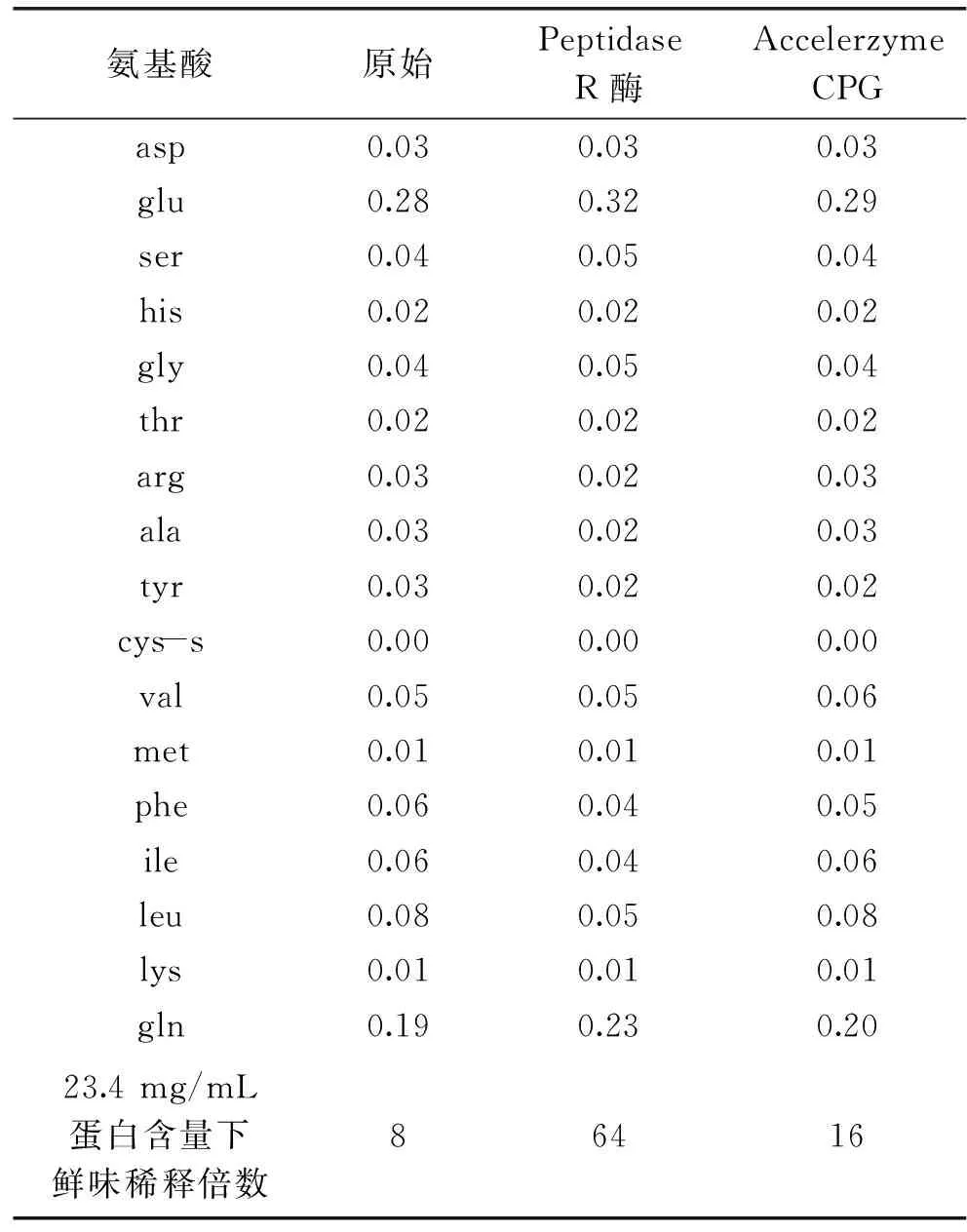
1.2.2超滤分离不同分子量范围肽先使用截留分子量为3 ku的超滤离心管分离上述所得酶解液,加入10 mL酶解液于超滤离心管中,3000×g离心30 min。得到分子量Mw>3000 u和Mw<3000 u的两组分肽段,再将Mw<3000 u的肽使用截留分子量为1 ku的超滤离心管分离,3000×g、30 min离心分离。得到分子量为1000 u 1.2.3离子交换树脂分离分子量Mw<1000 u的肽717强碱性阴离子交换树脂预处理参照国标[13]方法,采用湿法填柱。柱型:2.5 cm×50 cm;检测波长:280 nm。样品采用1 mol/L的NaOH溶液调节pH,以1 mL/min速度上样结束后,用超纯水以1.5 mL/min的流速洗脱未吸附的肽。每3 min收集流出液一管,并测定其280 nm处的吸收值。当流出液紫外吸收不再变化后,采用1 mol/L HCl溶液以相同的流速洗脱,直至流出液无紫外吸收。结束后采用超纯水冲洗柱子直至洗脱液为中性。调节样品的pH和上样量,以吸附率为指标,确定上样最佳条件。 1.2.4端解酶水解Mw<1000 u的肽采用Peptidase R酶和Accelerzyme CPG酶分别水解Mw<1000 u的肽,考虑到反应后需要对产物进行感官评定,本实验在原始pH6的情况下,加入一定量的酶,在37℃恒温振荡器中反应1~7 h,反应结束后沸水浴15 min灭酶,4℃冰箱保存使用。 1.2.5产物理化性质测定谷朊粉蛋白含量的测定:凯氏定氮法,参照国标[14];水解液蛋白含量:福林酚法[15];水解度测定:茚三酮法[7]。 分子量分布测定:高效液相色谱法。色谱条件:Waters 600高效液相色谱仪;色谱柱:TSKgel2000 SWXL 300 mm×7.8 mm;流动相:乙腈/水/三氟乙酸,45/55/0.1(v/v/v);柱温:30℃;流速:0.5 mL/min。 游离氨基酸测定:高效液相色谱法。采用OPA FMOC柱前衍生化法测定。色谱条件:(250×4.6)mm 5 μm ODS HYPERSIL;柱温:40℃;流速:1 mL/min。流动相:A相:8.0 g乙酸钠溶于1000 mL水中,再加入225 μL三乙胺,搅拌并滴加5%的醋酸,将pH调制7.2;加入5 mL四氢呋喃,混合后备用。B相:8.0 g乙酸钠溶于400 mL水中,滴加2%醋酸将pH调到7.2;将此溶液加入800 mL乙腈和800 mL甲醇,混合后备用。流动相程序:0~17.0 min B相从0~60%,17.0~18.0 min B相从60%~100%,23 min后转回100% A相。 水解氨基酸测定:色谱条件同游离氨基酸,样品前处理参照文献[16]。谷氨酸和谷氨酰胺的测定:200 μL 2.5 mg/mL水解液,加入200 μL BTI(10 mg/mL)乙腈水溶液中(乙腈∶水=3∶2),同时加入50 μL 50 mmol/L吡啶水溶液,混匀后均匀充氮,50℃反应4 h后,氮气吹干,再按照文献[16]进行处理。未经BTI保护测得的谷氨酸含量为实际谷氨酸含量与谷氨酰胺含量之和,经过BTI保护测得的谷氨酸含量为实际谷氨酸含量,谷氨酰胺的含量即为两者之差。 1.2.6产物感官评定采用滋味稀释分析对鲜味进行评定。感官评定员的筛选参照ISO标准[17],选择7名(3男4女)感官评定员,感官评定液pH调节至6.0。依次稀释水解液,将溶液至于30℃恒温后,装入统一容器。按浓度从小到大进行实验。取2 mL稀释液含入口中,保持5 s后吐出,评定完一个样品后以清水漱口。间隔10 min后进行下一个样品。取大多数感官评定员能感受到鲜味的最大稀释倍数作为该水解液的鲜味稀释倍数。 1.3数据统计分析 实验数据用SPSS统计分析软件处理分析,数据图表采用Excel统计分析软件处理。 2.1分子量大小及其氨基酸组成与鲜味的关系 大量学者已从不同来源的蛋白酶解液或者发酵产物等中分离得到肽,并对其序列进行了检测。由前人研究发现,肽的鲜味与其分子量和氨基酸组成存在一定关系[18-20]。因此,本实验也从分子量大小和氨基酸组成,末端氨基酸组成角度分析研究肽的鲜味规律。 分子量大小对肽呈味影响较大。例如,对于苦味肽来说,分子量越大,其平均疏水性越小,苦味越低[21]。由表1可以看出,肽的鲜味也与分子量大小有关。分子量Mw<1000 u的肽鲜味明显较Mw>3000 u和1000 u 从组成氨基酸来看,各种氨基酸组成比例无明显差异。可以看出Mw<1000 u的肽氨基酸组成与其他分子量肽的组成差别不大,而且谷氨酸含量也不是最高。这可能是由于在谷氨酸含量差异不大的情况下,与谷氨酸相连的氨基酸组成及肽分子量的差异对肽的鲜味的影响更大。为进一步确认肽的鲜味与组成肽的氨基酸之间的关系,采用了阴离子交换树脂依据肽的电荷性质分离Mw<1000 u以下的肽,分别进行感官评定。 2.2上样量和上样pH对离子交换树脂吸附率的影响 肽是两性物质,在不同pH环境下呈现不同的电荷性质。强碱性阴离子交换树脂是通过与溶质进行阴离子交换而吸附的,因此,上样pH即原始溶液的电荷性质对其在树脂上的吸附有较大的影响。上样量也是影响吸附分离的重要因素。上样量过大,容易使一些应该被吸附的物质不能被吸附而洗脱下来,不能达到分离的目的;同样,若上样量过小,得到的洗脱液浓度过低,影响后续的分析。采用吸附率对不同上样pH和上样量进行考察,以获得最优的条件。结果见表2,当起始pH为6.0和7.0时,肽组分所处的碱性条件不够强,使之带负电荷不够多,与树脂间的吸附不够强,在水洗阶段流失较多,吸附率较小。最终选定上样pH为8.0。从表3可以看出,上样量大于40 mg时,吸附率明显降低,选定最终上样量为40 mg。 表1 超滤后各段分子量肽的氨基酸组成比例及鲜味评价 表2 吸附率与上样pH的关系 表3 吸附率与上样量的关系 2.3离子交换树脂分离后各组分氨基酸组成与鲜味分析 将分离得到的组分冷冻干燥后进行水解氨基酸的测定。结果见表4,可以看出,各组分水解氨基酸相对含量存在一定差异。未被吸附的肽Glu含量高于被吸附的肽,而Asp和一些疏水性氨基酸的含量低于被吸附的肽。这可能由于在pH8.0的情况下,大多数氨基酸都带负电荷,各种氨基酸组成的肽之间存在竞争吸附关系,用水洗脱过程中,吸附能力不强的肽就容易被洗脱下来。 表4 阴离子交换树脂分离组分氨基酸比例及鲜味 由感官评定可以看出,被吸附的肽的鲜味较未被吸附的肽的鲜味强。而被吸附的肽谷氨酸含量比未被吸附的肽谷氨酸含量低。由此进一步可以看出,肽的鲜味与谷氨酸的含量不成正比关系。被吸附的肽碱性氨基酸His,Lys和Arg含量较高,这可能与其鲜味较强存在关系。Yamasaki等人[10-12]发现鲜味肽Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala中N端的碱性基团与酸性基团共同作用使得该肽呈现鲜味,其末端碱性基团Lys-Gly的消失,会使鲜味消失而呈现酸味。 表5 Peptidase R酶和Accelerzyme CPG的酶学性质 同时,被吸附的肽疏水性氨基酸含量较高,但是其鲜味仍然较强。Takashi等人[10]发现鲜味肽Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala中缺失了疏水性片段Ser-Leu-Ala后的肽Lys-Gly-Asp-Glu-Glu并不呈现鲜味。这表明,疏水性氨基酸的存在,并不一定对鲜味起到削弱的作用而是可能起到了辅助的作用。 为进一步研究肽组成与其鲜味的关系,采用端解酶对Mw<1000 u的肽进行水解,使其末端氨基酸组成发生变化,研究鲜味的变化。 2.4端解酶水解条件的确定 Peptidase R酶为氨肽酶,从肽的N端逐一水解多肽。Accelerzyme CPG酶为羧肽酶,从肽的C端逐一水解多肽。这两种酶对不同末端氨基酸有不同的敏感性,Peptidase R酶和Accelerzyme CPG酶的酶学性质见表5。这两种酶对一些亲水性氨基酸包括Asp,Glu的水解作用较弱。通过端肽酶水解肽使肽的末端不同氨基酸组成比例发生变化,来考察末端氨基酸组成是否与鲜味有关。端解酶水解效果采用水解度考察。水解度过大,肽几乎完全被水解成氨基酸;水解度过小,末端氨基酸变化不明显,因此需要选择合适的水解度进行评价。根据经验,水解度不超过30%为宜(即水解液中肽仍以寡肽形式存在)。 从图1可以看出,Peptidase R酶对Mw<1000 u的肽段有良好的水解作用。选择反应条件为37℃,pH6.0。反应进行3 h的情况下,加酶量小于100 U/g时,水解度增加较快,大于100 U/g后,水解度随加酶量的增加而缓慢增加,因此,选择加酶量为100 U/g。加酶量为100 U/g时,水解度随时间的变化如图2,水解度呈现增长的情况,没有明显的转点。考虑到水解度不宜超过30%,最终选择水解时间2 h。Accelerzyme CPG酶对Mw<1000 u的肽段的水解作用较弱。选择加酶量为200 U/g,考虑水解度不能太小,选择反应时间为5 h,进行后续研究。 图1 反应3 h时端解酶水解度DH与加酶量的关系Fig.1 The relationship between degree of hydrolysis and enzyme amount under 3 hours hydrolysis 图2 固定加酶量下水解度DH与时间的关系Fig.2 The relationship between degree of hydrolysis and time under fixed enzyme amount 2.5端解酶水解产物游离氨基酸组成与鲜味的关系 从表6可以看出Peptidase R酶对多种氨基酸都有较强的水解作用,而对Asp,Glu,Ser,His,Gly,Cys-s的水解作用较弱。Accelerzyme CPG酶对Arg,Met,Lys的水解作用较强,对其他氨基酸的水解作用较弱。这与酶的特异性有关。较易被水解的氨基酸在末端的比例就会下降,不易被水解的氨基酸在末端的比例就会上升。 表6 端解酶处理后肽组成氨基酸比例和鲜味变化 由表6可以看出Peptidase R酶水解处理后的肽Glu含量高,疏水性氨基酸Phe,Ile,Leu比例降低。且由于Peptidase R酶为氨肽酶,Glu在N端的比例要更高,其水解液鲜味较强。可以得出,以Glu为N端的肽鲜味强。这一结论与Tamura等人[12]得出Lys-Glu无鲜味而Glu-Lys呈现鲜味结果相符。用Accelerzyme CPG酶处理后的肽氨基酸组成变化不大,鲜味也有所增强。Accelerzyme CPG酶处理后的肽鲜味的增强可能来源于肽分子量的减小。 肽的鲜味是一个复杂的呈味过程,其鲜味强弱与其分子量大小、氨基酸组成、N端氨基酸组成和C端氨基酸组成都有关系。本实验得出,谷朊粉酶解得到的肽中,分子量小于1000 u的肽的鲜味较强,且肽的鲜味与谷氨酸含量并不成正相关关系,肽中碱性氨基酸和酸性氨基酸共同作用使肽呈现鲜味。N端为Glu的肽鲜味更强,而疏水性氨基酸对鲜味并不起到削弱的作用,甚至可能是鲜味肽不可缺少的组成部分。肽的鲜味的呈味机理与呈味规律仍待学者更加深入的研究。 [1]Ikeda K.1908.日本.4805[P]. [2]Yamasaki Y,Maekawa K.A peptide with delicious taste[J].Agricultural and biologicalchemistry,1978,42(9):1761-1765. [3]蔡高峰,黄纪念,孙强,等.大豆降压肽的制备,纯化及活性分析方法研究进展[J].中国食物与营养,2009,(10):25-27. [4]史军,王金水,蔡凤英,等.花生蛋白酶解条件及活性肽抗氧化特性研究[J].河南工业大学学报:自然科学版,2007,27(6):29-33. [5]Andres S,Appel K E,Lampen A.Toxicology,occurrence and risk characterisation of the chloropropanols in food:2-Monochloro-1,3-propanediol,1,3-dichloro-2-propanol and 2,3-dichloro-1-propanol[J].Food and Chemical Toxicology,2013,58:467-478. [6]Lee J C,Shin I S,Kim G H,et al.Evaluation of maternal toxicity in rats exposed to 1,3-dichloro-2-propanol during pregnancy[J].Toxicological Research,2008,24(4):307-314. [7]宋美,郭顺堂.大豆蛋白呈鲜组分的制备及其性质研究[J].大豆科学,2006,25(4):349-354. [8]赵阳,陈海华,王雨生,等.紫贻贝蛋白酶解过程中呈味物质释放规律和呈味肽结构[J].食品与机械,2015,(1):18-24. [9]Rhyu M R,Kim E Y.Umami taste characteristics of water extract of Doenjang,a Korean soybean paste:Low-molecular acidic peptides may be a possible clue to the taste[J].Food chemistry,2011,127(3):1210-1215. [10]Nakata T,Takahashi M,Nakatani M,et al.Role of basic and acidic fragments in delicious peptides(Lys-Gly-Asp Glu-Glu-Ser-Leu-Ala)and the taste behavior of sodium and potassium salts in acidic oligopeptides[J].Bioscience,biotechnology,and biochemistry,1995,59(4):689-693. [11]Yamasaki Y,Maekawa K.Synthesis of a peptide with delicious taste[J].Agricultural and Biological Chemistry,1980,44(1):93-97. [12]Tamura M,Nakatsuka T,Tada M,et al.The relationship between taste and primary structure of “delicious peptide”(Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala)from beef soup[J].Agricultural and Biological Chemistry,1989,53(2):319-325. [13]离子交换树脂预处理方法[S],GBT 5476-1996. [14]食品安全国家标准食品中蛋白质的测定[S],GB 50095-2010. [15]高英,俞玉忠.福林酚法测定脑蛋白水解物溶液中的多肽含量[J].海峡药学,2005,16(6):57-58. [16]赵成仕,臧爱香,夏莲,等.酸水解-全自动氨基酸分析仪测定蜂蜜中 17 种氨基酸[J].现代农业科技,2013,(3):325-326. [17]ISO8586:2012,Sensory analysis--General guidelines for the selection,training and monitoring of selectedassessors and expert sensory assessors[S]. [18]Noguchi M,Arai S,Yamashita M,et al.Isolation and identification of acidic oligopeptides occurring in a flavor potentiating fraction from a fish protein hydrolysate[J].Journal of agricultural and food chemistry,1975,23(1):49-53. [19]Maehashi K,Matsuzaki M,Yamamoto Y,et al.Isolation of peptides from an enzymatic hydrolysate of food proteins and characterization of their taste properties[J].Bioscience,biotechnology,and biochemistry,1999,63(3):555-559. [20]Schlichtherle-Cerny H,Amadò R.Analysis of taste-active compounds in an enzymatic hydrolysate of deamidated wheat gluten[J].Journal of agricultural and food chemistry,2002,50(6):1515-1522. [21]Adler-Nissen J,Olsen H S.The influence of peptide chain length on taste and functional properties of enzymatically modified soy protein[J].Journal of the American Chemical Society,1979,43:125-146. Taste regularity of umami peptides from gluten WANG Li-hua,WANG Jin-peng,JIN Zheng-yu*,XU Xue-ming (State Key Laboratary of Food Science and Technology,School of Food Science and Technology, Synergetic Innovation Center of Food Safety and Nutrition,Jiangnan University,Wuxi 214122,China) Ultrafiltration centrifugation,anion exchange resin separation and exopeptidases treatment were applied to analyze the umami regularity of peptides from gluten.Results showed that the peptides which molecular weight below 1000 u had a stronger umami taste.Anion exchange resin separation and exopeptidases treatment were further performed to analyze the umami taste of these peptides.Results showed that the umami taste of peptides was not positive correlated to the Glu content but with Glu existed in the N-terminal,the peptides showed a stronger umami taste.Both the basic group and acidic group of peptides contributed to the umami taste. umami peptides;umami peptides taste regularity;anion exchange resin;exopeptidase 2015-09-21 王丽华(1992-),女,硕士在读,研究方向:碳水化合物,E-mail:wlhstella@163.com。 金征宇(1960-),男,博士,教授,研究方向:碳水化合物、农副产品的综合利用,E-mail:jinlab2008@yahoo.com。 国家自然科学基金项目(31401524);江苏省自然科学基金(BK20140143);“十二五”科技支撑计划项目(2012BAD37B03);江苏省科技支撑计划(BE2013311);农业部公益性行业(农业)科研专项(201303070-02);江苏高校优势学科建设工程资助项目资助。 TS201.1 A 1002-0306(2016)07-0333-05 10.13386/j.issn1002-0306.2016.07.0552 结果与讨论




3 结论
