玉米胚芽蛋白凝胶特性的研究
2016-09-12孙向东刘春雨
石 丹,孙向东,张 筠,兰 宇,刘春雨
(1.黑龙江东方学院食品学院,黑龙江哈尔滨 150066;2.黑龙江农业科学院农产品质量安全研究所,黑龙江哈尔滨 150086;3.西安银桥乳业(集团)有限公司,陕西西安 710600)
玉米胚芽蛋白凝胶特性的研究
石丹1,3,孙向东2,张筠1,*,兰宇1,刘春雨1
(1.黑龙江东方学院食品学院,黑龙江哈尔滨 150066;2.黑龙江农业科学院农产品质量安全研究所,黑龙江哈尔滨 150086;3.西安银桥乳业(集团)有限公司,陕西西安 710600)
利用流变仪研究不同处理条件下玉米胚芽蛋白凝胶特性的变化规律。结果表明:玉米胚芽蛋白在160 mg/mL质量浓度下开始形成凝胶,随着质量浓度的增加,凝胶弹性增强。玉米胚芽蛋白的储能模量G′、耗能模量G″均与蛋白浓度呈线性正相关,提高升降温速率会使其凝胶弹性显著减弱。玉米胚芽蛋白的储能模量G′、耗能模量G″均与升降温速率呈负相关。相同条件下,玉米胚芽蛋白的凝胶弹性较蛋清蛋白差,优于大豆分离蛋白。本研究深入探索了玉米胚芽蛋白凝胶特性,为拓宽玉米胚芽蛋白利用途径打下基础。
流变仪,玉米胚芽蛋白,凝胶弹性
玉米胚芽占玉米籽粒质量的10%~15%,含有玉米籽粒中20%的蛋白质[1]。我国有丰富的玉米胚芽资源,但在玉米胚芽综合利用方面还存在较大问题。目前玉米胚芽主要用于提取油脂,副产物胚芽粕则直接干燥粉碎,因其中的蛋白质严重变性,功能性较差,有异味,所以一般作饲料使用,没充分实现经济价值。国内关于胚芽蛋白方面大部分侧重提取工艺的优化和提取率的提高,对功能性研究并不多。据报道[2],欧美发达国家已经工业化生产纯度高达92%~95%的优质玉米胚芽分离蛋白,并且将玉米胚芽蛋白广泛应用于乳制品、焙烤食品、冰激凌、早餐方便食品、健康营养食品、饮料、人造肉及乳化肉制品当中。应用玉米胚芽蛋白可显著改善产品组织结构及口感,提高产品得率,延长保质期,因而受到广泛欢迎。 玉米胚芽中蛋白质含量较高,主要含有白蛋白和球蛋白,具备良好的功能性质,如持水性、持油性、乳化性、乳化稳定性、发泡性、胶凝性等,是优质蛋白质的重要来源[3-4]。凝胶特性是食品蛋白质最重要的功能特性之一,决定着香肠、火腿肠等乳化肉制品的组织状态和口感,目前在这类肉制品中主要使用大豆蛋白作为添加剂,起到增强凝胶弹性及强化蛋白质的作用。玉米胚芽蛋白与大豆蛋白都是植物贮藏蛋白,其中水溶性球蛋白占主要部分,不但结构类似,乳化、发泡、凝胶等功能特性也很接近,具有良好的开发应用前景。
小张力振荡动态测试(small strain oscillatory dynamic testing)以动态旋转式流变仪在连续旋转和震荡形式下运行,因其对样品物理结构和化学组分的变化特别敏感而在评估凝胶性质和凝胶韧性方面有较大的应用价值,近年来在对食品凝胶体系评价中应用逐渐增多。该方法可测试温度变化过程中蛋白质形成凝胶的动态变化,通过对温度的扫描记录下与流变性质相关的从液体到胶体的能量转化过程细节。这种方法适于测量与凝胶形成现象相关的细微变化,具有不破坏凝胶结构、节省实验材料等特点。
采用工业上技术成熟的碱溶酸沉法提取玉米胚芽蛋白,以小张力振荡动态测试为实验手段,研究热诱导玉米胚芽蛋白凝胶形成过程中粘弹性的动态变化,明确其凝胶特性,可为深度开发玉米胚芽蛋白,拓展其在乳化肉制品领域的应用提供理论参考。
1 材料与方法
1.1材料与仪器
玉米胚芽哈尔滨市阿城区玉米粉厂;商品大豆分离蛋白哈高科大豆食品有限责任公司提供;鸡蛋哈尔滨中央红超市。
乙醇、氢氧化钠、盐酸、氯化钠等北京益利精细化学品有限公司。
酸度计PB-10北京赛多利斯仪器系统有限公司;冷冻干燥机FDU-1100日本EYELA(东京理化)东京理化器械株式会社;凯氏定氮仪KjeltecTM 8100福斯华(北京)科贸有限公司;流变仪DHR美国TA公司等。
1.2实验方法
1.2.1碱溶酸沉法提取玉米胚芽蛋白赵梅[5]等采用碱溶酸沉法从已脱脂的玉米胚芽粉中提取玉米胚芽蛋白,本研究在其工艺基础上进行适当改进,具体步骤如下:

采用GB/T 5511-2008测得所提取的玉米胚芽蛋白中蛋白含量。
1.2.2玉米胚芽蛋白凝胶特性的测定配制蛋白质量浓度分别为60、80、100、120、140、160、180、220 mg/mL,NaCl浓度为0.3 mol/L的玉米胚芽蛋白和大豆分离蛋白溶液并用封口膜封口,85℃下恒温水浴40 min后取出,迅速冷却,放入冰箱4℃冷藏过夜后,将试管倒置观察形成凝胶的情况。凝胶未流出来的认为能够形成凝胶,反之则不能形成凝胶[6]。
1.2.3不同蛋白浓度对玉米胚芽蛋白凝胶特性的影响配制蛋白质量浓度分别为60、80、100、120、140、160、180、220 mg/mL,NaCl浓度为0.3 mol/L的玉米胚芽蛋白溶液,校正流变仪探头,加样适量,设置实验参数:初始温度为25℃,平衡2 min,由25℃升温至95℃,在95℃下保持30 s后降温至25℃,升降温速率为4℃/min,并设置在25℃时,进行频率扫描,扫描范围在0.01~10 Hz,然后加样测定。为避免样品测定期间水分蒸发影响实验结果,可在平板上的凹槽中滴入适量的矿物油以形成密封体系[7]。
1.2.4不同加热速率对玉米胚芽蛋白凝胶特性的影响配制蛋白质量浓度为160 mg/mL,NaCl浓度为0.3 mol/L的玉米胚芽蛋白悬浊液,校正流变仪探头。设置实验参数同上,调节升降温速率分别为1、2、4、8℃/min条件下进行测定。
1.2.5不同蛋白质凝胶弹性的比较分别配制含有0.3 mol/L NaCl,蛋白质量浓度为160 mg/mL的玉米胚芽蛋白和大豆分离蛋白悬浊液、蛋清适量。校正流变仪探头,设置实验参数:升降温速率为2℃/min,其他参数及步骤同上。
1.3统计分析
采用SAS 9.4软件的Duncan’s多重比较模块进行差异显著性检验。以下各表中显著性差异(p<0.05)用不同字母表示。
2 结果与分析
2.1玉米胚芽蛋白粉蛋白质含量
采用GB/T 5511-2008测得所提取的玉米胚芽蛋白中蛋白含量为56.42%,商品大豆分离蛋白中蛋白质的含量为85.26%,由于商品大豆分离蛋白已经过分离纯化,故蛋白质含量较高。
2.2玉米胚芽蛋白的凝胶特性
2.2.1玉米胚芽蛋白凝胶形成性的测定在蛋白质分子聚集过程中,当引力和斥力相等时,就可形成蛋白质凝胶;当斥力大于引力时,蛋白质分子无法形成凝胶。当引力大于斥力时,蛋白质分子则可以形成凝结物[8]。

表1 玉米胚芽蛋白与大豆分离蛋白的凝胶形成性
注:“+”表示形成了凝胶,“-”表示未形成凝胶。
由表1可知,玉米胚芽蛋白在质量浓度为160 mg/mL时,开始形成凝胶,此时为弱凝胶,大豆分离蛋白在100 mg/mL时就可形成凝胶,可见,大豆分离蛋白凝胶形成性优于玉米胚芽蛋白。
2.2.2玉米胚芽蛋白凝胶形成时的典型图谱储能模量(G′)又称为弹性模量,代表凝胶储存形变并回复原状的能力,表示与弹性凝胶结构相关的样品的硬度[9];耗能模量(G″)也称为粘性模量,是物质抵抗外力流动的能力,是描述凝胶的粘性的物理量;
tanδ是粘性模量G″与弹性模量G′的比值,若tanδ<1,即G″
由图1可以看出,扫描频率为1 Hz的条件下,在初始的升温阶段,储能模量G′缓慢上升,耗能模量G″开始略微下降,而后又逐渐上升,tanδ>1,说明在升温初始阶段,玉米胚芽蛋白所形成的体系黏性大于弹性,玉米胚芽蛋白悬浊液在开始时还未形成凝胶体。温度在39℃时,储能模量G′和耗能模量G″出现交叉点,此时tanδ=1,为玉米胚芽蛋白的凝胶点。说明加热会引起玉米胚芽蛋白悬浊液发生由溶胶到凝胶的变化。在温度即将上升到95℃时,储能模量G′和耗能模量G″急剧升高,这一现象可能由于在储能模量G′值较高时凝胶体系中较强的分子间网络结构及增强的蛋白与蛋白、蛋白与多聚物分子之间的相互作用。
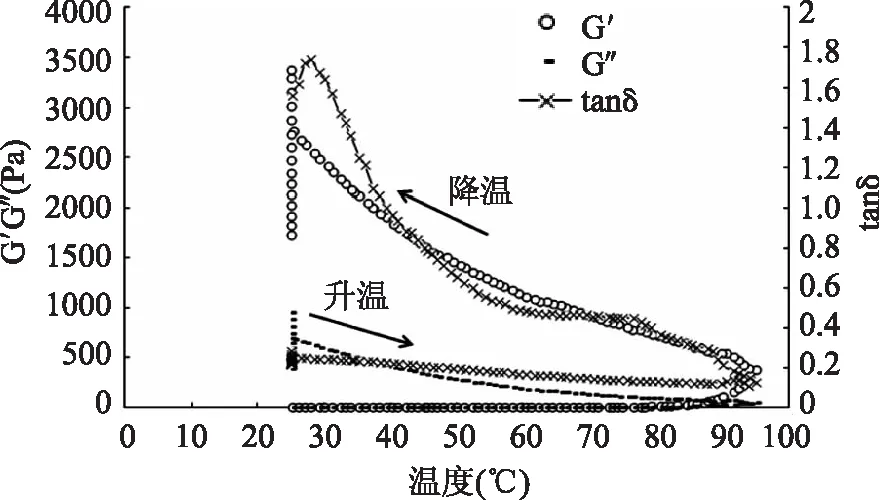
图1 质量浓度为160 mg/mL玉米胚芽蛋白凝胶形成的典型图谱Fig.1 Typical gel formation pattern of 160 mg/mL corn germ proteins
在降温过程中,储能模量G′和耗能模量G″仍不断的升高,可能是经过热处理后,蛋白质分子结构发生部分延伸,有部分疏水基团暴露出来,加强了分子间相互作用。
2.2.3蛋白质量浓度对玉米胚芽蛋白凝胶弹性的影响对不同蛋白质量浓度对玉米胚芽蛋白凝胶弹性影响的显著性差异分析见表2。
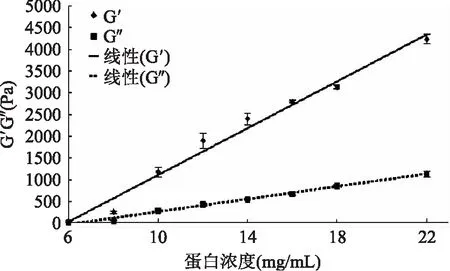
图2 不同蛋白质量浓度对玉米胚芽蛋白凝胶性的影响Fig.2 Effect of different protein concentrations on gelation properties of corn germ proteins
由表2可以看出,扫描频率为1 Hz的条件下,随着玉米胚芽蛋白质量浓度的增加,储能模量G′和耗能模量G″值均显著增大(p<0.05),储能模量G′的变化较耗能模量G″变化幅度大,且储能模量G′远远大于耗能模量G″。说明随着蛋白质量浓度的增加,形成的蛋白凝胶的韧性与粘性增加,可能是增加了玉米胚芽蛋白分子间基团交联的机率,导致形成的蛋白凝胶性增强。

表2 不同玉米胚芽蛋白质量浓度对G′和G″的影响差异性分析
注:同列数据后字母不同表示显著差异,检验误差为0.05水平。
以弹性模量G′和粘性模量G″为纵坐标对玉米胚芽蛋白质量浓度(ρ)做曲线,对图2中曲线进行拟合方程:储能模量G′=269.53ρ-1584.0(R2=0.9831);耗能模量G″=72.075ρ-460.98(R2=0.9937),具有良好的线性关系。Arntfield等[12]早期在豌豆蛋白的研究中采用类似的方法描述凝胶的储能模量G′和耗能模量G″对其质量浓度之间关系,得到乘幂规律,而本实验得到的是线性关系,虽然这两种蛋白质的储能模量G′、耗能模量G″与蛋白质量浓度都呈正相关,但毕竟还存在差异,究其原因,可能是不同蛋白质性质不同所致。
2.2.4升降温速率对玉米胚芽蛋白凝胶弹性的影响由图3可以看出,扫描频率为1 Hz的条件下,在升降温速率为1℃/min和2℃/min时,储能模量G′没有显著性差异(p>0.05),在2~8℃/min时随着升降温速率的升高,储能模量G′降低(p<0.05),说明这时随着升降温速率的升高,形成的蛋白凝胶的韧性逐渐减弱;随着升降温速率的升高,耗能模量G″显著减小(p<0.05),且储能模量G′的降幅远远大于耗能模量G″。可能是在较低升降温速率时玉米胚芽蛋白氨基酸残基有更充裕的时间进行合理的排列,交联的机率进一步增加,从而形成韧性较强的蛋白凝胶[13]。

图3 不同升降温速率对玉米胚芽蛋白凝胶性的影响Fig.3 Effect of different heating and cooling rates on gelation properties of corn germ proteins注:表中同一系列字母标记不同表示差异显著,检验误差为0.05水平,图4同。
当以最大速率8℃/min加热和冷却时,测得储能模量G′值分别小于加热和冷却速率在1、2、4℃/min条件下的储能模量G′。说明玉米胚芽蛋白凝胶形成相同的弹性时,在较高的升降温速率下形成相同韧性的凝胶需要更高温度,才能与在升降温速率较低的条件下形成的凝胶韧性相同。在1℃/min的升降温速率条件下储能模量G′值最大,可能是升降温速率较慢时,蛋白质分子按照合理的顺序重新排列的时间更加充分,从而增强了玉米胚芽蛋白的凝胶韧性[14]。
由图3可以看出,不同升降温速率下得到的玉米胚芽蛋白凝胶弹性(tan δ)不同,在4℃/min和8℃/min二个处理条件下,最终获得的凝胶弹性无显著差异(p>0.05),而1℃/min和2℃/min二个处理条件下获得的凝胶弹性差异显著,且与4℃/min和8℃/min两个处理条件下获得的凝胶也有显著性差异。总之,在较慢的加热和冷却速率(1℃/min)下,玉米胚芽蛋白形成的凝胶弹性较差。这是因为虽然在1℃/min加热和冷却速率条件下凝胶韧性有所增加,但相应的粘性增大得更多,才导致tan δ显著升高。
2.2.5不同蛋白质凝胶弹性的比较由图4可知,蛋清凝胶储能模量G′(4265.87 Pa)显著高于玉米胚芽蛋白的储能模量G′(2409.66 Pa)和商品大豆分离蛋白的储能模量G′(1802.55 Pa),玉米胚芽蛋白的储能模量G′与商品大豆分离蛋白的弹性模量G′(p<0.05)有显著性差异。而三种蛋白质凝胶中,蛋清凝胶的tanδ最低,表示其蛋白凝胶的弹性最好。众所周知,鸡蛋清中的主要蛋白质卵白蛋白具有优良的凝胶性,由图4可见,蛋清的凝胶性明显优于玉米胚芽蛋白和大豆分离蛋白(p<0.05),这可能是由于玉米胚芽蛋白和大豆分离蛋白都是采用碱溶酸沉法提取,酸处理导致蛋白质严重变性,导致凝胶弹性大幅较低,而新鲜蛋清未经任何处理,具有最佳的凝胶形成能力。

图4 不同蛋白质凝胶性的比较Fig.4 Gelation characteristics of corn germ proteins compared with other proteins注:图中SPI为大豆分离蛋白,CGP为玉米胚芽蛋白,EGG为蛋清蛋白。
3 结论
玉米胚芽蛋白凝胶性成形较大豆分离蛋白差;玉米胚芽蛋白的凝胶弹性随着蛋白质量浓度增高而增强,较高的升温和降温速率会使玉米胚芽蛋白的凝胶弹性弱化;比较相同处理条件下玉米胚芽蛋白、大豆分离蛋白和蛋清的凝胶性发现蛋清蛋白的凝胶弹性最好,玉米胚芽蛋白凝胶的韧性较大豆蛋白差,但其凝胶弹性优于大豆分离蛋白。因此,开发玉米胚芽蛋白作为功能性营养添加剂应用于乳化肉制品中具有较好的应用前景。
[1]任婷婷,李书国.玉米胚芽的营养保健价值及其食品的研究开发[J].粮食加工,2012,37(2):93-104.
[2]Healey,I.A revolutionary new food protein/nutraceutical ingredient for the food and beverage industries[J].International Food Marketing & Technology,2004,18(1):4-6.
[3]Z Leibovitz,C Ruckenstein.Our experiences in processing maize corn germ oil[N].Journal of the American Oil Chemists’ Society,1983,60(2):395-399.
[4]Sezin Islamoglu Kadioglu,Tri T Phan,David A.Sabatini.Surfactant-Based Oil Extraction of Corn Germ[N].Journal of the American Oil Chemists’ Society,2011,88(6):863-869.
[5]赵梅,韩忠杰,孙庆杰.响应面法优化玉米胚芽分离蛋白的提取工艺[J].粮食加工,2013,21(3):10-14.
[6]徐慧.反胶束法萃取玉米胚芽蛋白及其性质研究[D].齐齐哈尔:齐齐哈尔大学,2012:33-34.
[7]Xiang Dong Sun,Suan D Arntfield.Gelation properties of salt-extracted pea protein induced by heat treatment:Effect of heating and cooling rate[J].Food Chemistry,2011,124:1011-1016.
[8]胡坤,方少瑛,王秀霞,等.蛋白质凝胶机理的研究进展[J].食品工业科技,2006,(6):202-205.
[9]Egelandsdal B,Martinsen B,Autio K.Rheological parameters as predictor of protein functionality:a model study using myofibrils of different fiber-type composition[J].Meat Science,1995,39(1):97-111.
[10]Ikeda S,NishinariI K.On solid-like rheological behaviors of globular protein solutions[J].Food Hydrocolloids,2001,15(4-6):401-406.
[11]Stading M,Hermansson A M.Viscoelastic behavior ofβ-lactoglobulin structures[J].Food Hydrocolloids,1990,4(2):121-135.
[12]Arntfield S D,Murray E D,Ismond M A H.Dependence of thermal properties as well as network microstructure and rheology on protein concentration for ovalbumin and vicilin[J].Journal of Texture Studies,1990,21(2):191-212.
[13]Xiang Dong Sun,Suan D.Arntfield.Gelation properties of salt-extracted pea protein induced by heat treatment[J].Food Reacherch International,2010,43:509-515.
[14]Arntfiela S D,Murray E D.Heating rate affects thermal properties and network formation for vicilin and ovalbumin at various pH values[J].Journal of Food Science,1992,57(3):640-646.
Study on gelation characteristics of corn germ proteins
SHI Dan1,3,SUN Xiang-dong2,ZHANG Yun1,*,LAN Yu1,LIU Chun-yu1
(1.Food College,East University of Heilongjiang,Harbin 150066,China; 2.Quality&Safety Institute of Agricultural Products,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China; 3.Xi’an Yinqiao Dairy(Group)Limited Company,Xi’an 710600,China)
A rheometer was employed to study gelation characteristics of corn germ proteins concentrate under different conditions.Results showed that corn germ proteins concentrate started to form a gel at the concentration of 160 mg/mL,the gel elasticity of corn germ proteins was increased with increasing proteins concentration.Storage modulus G′ and loss modulus G″ showed a positive linear relationships with the increasing concentration of corn germ proteins concentrate.With rising heating and cooling rates,the elasticity of corn germ proteins gel were weakened and negative linear relationships were obtained for heating and cooling rate and G′ as well as G″.Under the same concentration,gel elasticity of corn germ proteins was weaker than that of egg white while stronger than that of soy protein isolate.This investigation provided fundamental informations for employing the gelation characteristics of corn germ proteins in food industry.
rheometer;corn germ protein;gelation elasticity
2015-08-27
石丹(1990-),女,硕士,研究方向:食品工程微生物与生物技术,E-mail:daisyilla@163.com。
张筠(1976-),女,博士,研究方向:食品微生物与生物技术,E-mail:24343886@qq.com。
哈尔滨市优秀学科带头人基金项目(2013RFXYJ049)。
TS201.7
A
1002-0306(2016)07-0067-04
10.13386/j.issn1002-0306.2016.07.005
