壳聚糖对竹荪水提液中镉的去除及其机理研究
2016-09-12刘伏佳谭礼浩伍家豪贺丽苹
刘伏佳,谭礼浩,伍家豪,曹 庸,贺丽苹
(1.华南农业大学食品学院,广东广州 510642;2.华南农业大学测试中心,广东广州 510642;3.广东省天然活性物工程技术研究中心,广东广州 510642)
壳聚糖对竹荪水提液中镉的去除及其机理研究
刘伏佳1,3,谭礼浩1,3,伍家豪1,曹庸1,3,贺丽苹2,3,*
(1.华南农业大学食品学院,广东广州 510642;2.华南农业大学测试中心,广东广州 510642;3.广东省天然活性物工程技术研究中心,广东广州 510642)
为探讨壳聚糖对竹荪水提液中镉的去除及其去除机理。以竹荪水提液为研究对象,利用壳聚糖吸附其中的镉,以镉吸附率和粗多糖保留率作为指标,在单因素的基础上,进行pH、壳聚糖添加量、吸附温度和吸附时间的四因素三水平正交实验,并探究了壳聚糖吸附前后的竹荪水提液中镉形态的变化。结果表明:最佳吸附条件为:pH7.0、壳聚糖添加量0.35 g/100 mL、吸附温度70 ℃、吸附时间2.5 h,在此条件下,镉吸附率为63.8%,粗多糖保留率为85.6%,镉含量达到食品安全标准限量的要求;形态分析结果显示壳聚糖主要吸附竹荪水提液中游离态、无机态和稳定态的镉。表明壳聚糖对竹荪水提液中镉具有较好的吸附效果,且对功效成分粗多糖的影响较小。
竹荪水提液,镉,粗多糖,壳聚糖,形态分析
竹荪(DictyophoraIndusiata)是一种名贵的大型食用菌,自古就被列为草八珍之一,有“现代保健食品”、“人类植物性食品的顶峰”等美誉[1]。竹荪主要有效成分为粗多糖,还包含氨基酸、脂肪、挥发油等有效物质[2],具有抗衰老、增强免疫、抗肿瘤、降血压、抑菌等功效[3]。除了日常食用,竹荪还被开发为竹荪酒、罐头、饮料、面条等功能食品,同时在保健品和化妆品领域也获得了深度开发[4]。由于竹荪富集重金属的能力强,再加上产地环境的恶化和化肥等基质材料的滥用,导致竹荪及其水提液中重金属污染问题越来越突出[5],尤其镉元素严重超标。不仅影响了其食用安全,而且限制了竹荪新产品的研发。因此,采用合适的方法去除竹荪水提液中超标的镉,使其达到或低于限量标准的要求,保证其食用安全,对竹荪产品的深度开发具有十分重要的意义。
目前食材中重金属去除方法主要有高速离心法、吸附澄清法、吸附色谱法和超临界流体萃取法等[6]。高速离心法不能去除离子状态的重金属;吸附色谱分离法和超临界流体萃取法操作复杂、成本高,且后者不适合液体样品的处理;吸附澄清法所用吸附剂主要有壳聚糖、纤维素、麦饭石等,其中壳聚糖具有来源广、安全、成本低、操作简单、吸附效果好等优点[7]。因此本实验选用壳聚糖对竹荪水提液中的镉进行吸附。
本研究在保证竹荪功效成分有效保留的前提下,探究了壳聚糖吸附竹荪水提液中镉的最佳吸附条件,并分析吸附前后竹荪水提液中镉的形态变化,探索了竹荪水提液中镉的存在形态和壳聚糖吸附竹荪水提液中镉的机理。
1 材料与方法
1.1材料与仪器
竹荪水提液由无限极(中国)有限公司提供;硫酸、无水乙醇广州化学试剂厂,分析纯;硝酸、过氧化氢广州化学试剂厂,优级纯;壳聚糖(脱乙酰度≥90%)广州市齐云生物技术有限公司;强酸型阳离子树脂、Amberlite XAD-2大孔树脂广州市齐云生物技术有限公司;Chelex-100螯合树脂Sigma公司。
原子吸收光谱仪美国PerkinElmer公司;Ethos D微波消解仪意大利Milestone公司;EG-20B电热板北京莱伯泰科科技有限公司;紫外可见分光光度计上海精密科学仪器有限公司;SZCL-30磁力搅拌水浴锅河南予华仪器有限公司。
1.2实验方法
1.2.1壳聚糖吸附竹荪水提液中镉的技术流程竹荪水提液→加入壳聚糖→调节pH→设置吸附温度与吸附时间→磁力搅拌→离心→取上清液→定容→测定镉和粗多糖含量
1.2.2镉、粗多糖含量的检测镉含量参照国家标准GB/T5009.15-2003的方法将样品消化后,以磷酸二氢胺(120 g/L)作为基体改进剂,石墨炉原子吸收光谱法测定;粗多糖含量参照国家标准NYT 1676-2008测定。
1.2.3水提液pH的确定量取5份竹荪水提液100 mL,置于锥形瓶中,加入0.30 g壳聚糖,分别调节水提液的pH为3.0、5.0、7.0、8.0、9.0,在60 ℃下磁力搅拌3 h,4000 r/min转速下离心10 min,上清液定容测定镉和粗多糖的含量。
1.2.4壳聚糖添加量的确定量取5份竹荪水提液100 mL,置于锥形瓶中,分别加入0.07、0.15、0.30、0.45、0.60 g壳聚糖,调节pH为7.0,在60 ℃下磁力搅拌3 h,4000 r/min转速下离心10 min,上清液定容测定镉和粗多糖的含量。
1.2.5吸附温度的确定量取5份竹荪水提液100 mL,置于锥形瓶中,加入0.30 g壳聚糖,调节pH为7.0,分别设置吸附温度为30、45、60、75、90 ℃,磁力搅拌3 h,4000 r/min转速下离心10 min,上清液定容测定镉和粗多糖的含量。
1.2.6吸附时间的确定量取5份竹荪水提液100 mL,置于锥形瓶中,加入0.30 g壳聚糖,调节pH为7.0,在60 ℃下,磁力搅拌1、2、3、4、5 h,4000 r/min转速下离心10 min,上清液定容测定镉和粗多糖的含量。
1.2.7吸附最佳参数的确定对pH、吸附温度、壳聚糖添加量、吸附时间这四个因素及其对应的三个较优水平进行正交实验,采用L9(34)正交实验对壳聚糖吸附竹荪水提液中镉的工艺条件作进一步优化。实验设计中的因素及水平见表1。

表1 L9(34)正交实验因素水平表Table 1 L9(34)Factors and levels of orthogonal test
1.2.8镉吸附率和粗多糖保留率的计算
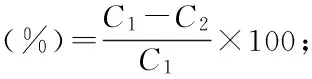

式中:C1为壳聚糖吸附前竹荪水提液中镉的含量,单位为μg/kg;C2为壳聚糖吸附后竹荪水提液中镉的含量,单位为μg/kg。
P为壳聚糖吸附后竹荪水提液中粗多糖的含量,单位为g/100 g;P1为壳聚糖吸附前竹荪水提液中粗多糖的含量,单位为g/100 g。
1.2.9形态分析方法参考文献[8-9],取一定量壳聚糖吸附前后的竹荪水提液,分别过Amberlite XAD-2大孔树脂、Chelex-100螯合树脂、强酸型阳离子交换树脂,即得到有机态和无机态、稳定态和不稳定态、游离态和非游离态的镉。
1.3数据统计分析
所有数据采用Excel软件进行统计处理,使用OriginPro 7.5作图。
2 结果与分析
2.1竹荪水提液中镉和粗多糖的含量
经检测竹荪水提液中镉的含量为779.7 μg/kg,粗多糖含量为4.75%(折算为25%的固形物含量)。参考《食品安全国家标准 食品中污染物限量》以及《药用植物及制剂进口绿色行业标准》可知镉的限量为300 μg/kg,竹荪水提液中镉的含量远高于其限量标准。
2.2单因素实验结果与分析
2.2.1水提液pH对镉吸附率和粗多糖保留率的影响从图1可以看出,随着水提液pH的升高,镉吸附率逐渐升高,当pH达到7.0后镉吸附率后稍有下降。这是因为在低pH条件下,H+和镉与壳聚糖上的结合位点发生竞争性的结合,壳聚糖上的-NH2形成-NH3+,对镉的吸附能力减小;随着pH的增大,壳聚糖中的-NH2游离出来,对镉的吸附能力随之增强[10-11];当pH大于7.0以后,壳聚糖对水提液中存在的其他金属离子的选择性吸附强于镉离子,导致吸附率略有下降[12]。与此同时,粗多糖保留率随pH的增加逐渐下降。
综合考虑,选取pH6.5、7.0、7.5继续对水提液中镉的吸附做正交实验以确定水提液的最佳pH。
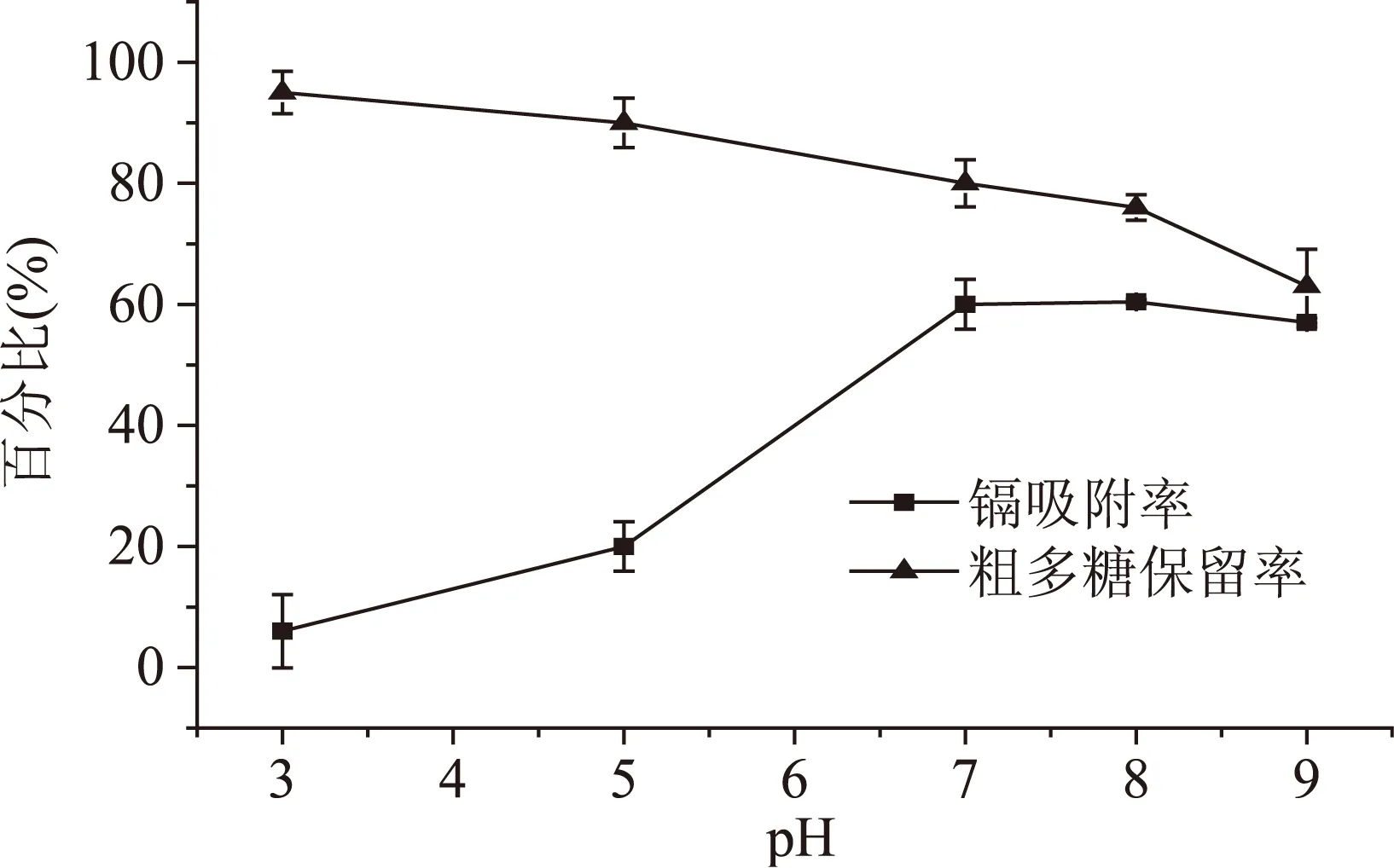
图1 pH对镉吸附率和粗多糖保留率的影响Fig.1 Effect of pH on adsorption rate of cadmium and retention rate of polysaccharide
2.2.2壳聚糖添加量对镉吸附率和粗多糖保留率的影响从图2可以看出,随着壳聚糖添加量的增加,水提液中镉吸附率逐渐升高,当壳聚糖添加量达到0.30 g/100 mL时吸附接近饱和,再增加壳聚糖添加量时,镉吸附率趋于稳定。这是因为壳聚糖添加量的增加导致了与镉作用的基团数量增多,但当壳聚糖添加量超过0.30 g/100 mL以后镉吸附率趋于稳定,说明吸附已经达到饱和状态。与此同时,壳聚糖添加量的变化对粗多糖保留率的影响较小。
综合考虑,选取0.25、0.30、0.35 g/100 mL继续对水提液中镉的吸附做正交实验以确定最佳的壳聚糖添加量。

图2 壳聚糖添加量对镉吸附率和粗多糖保留率的影响Fig.2 Effect of chitosan content on adsorption rate of cadmium and retention rate of polysaccharide
2.2.3吸附温度对镉吸附率和粗多糖的保留率的影响从图3可以看出,在30~75 ℃的温度范围内,随着吸附温度的升高,镉吸附率迅速上升,吸附温度达到75 ℃时,吸附效果最好,之后略有下降。由于随着温度的升高,加速了壳聚糖与镉结合的反应速度和反应程度;当温度高于75 ℃时,壳聚糖与镉的结合遭到破坏,导致镉吸附率下降。与此同时,在20~60 ℃的温度范围内,随着温度的升高,体系的热运动加剧,壳聚糖分子与粗多糖之间的碰撞几率增加,粗多糖保留率迅速下降;随着温度进一步升高,壳聚糖分子链有收缩的趋势,缩短了架桥长度,对粗多糖的絮凝能力减弱,粗多糖保留率下降趋势变缓[12]。
综合考虑,选取70、75、80 ℃继续对水提液中镉的吸附做正交实验以确定最佳的吸附温度。
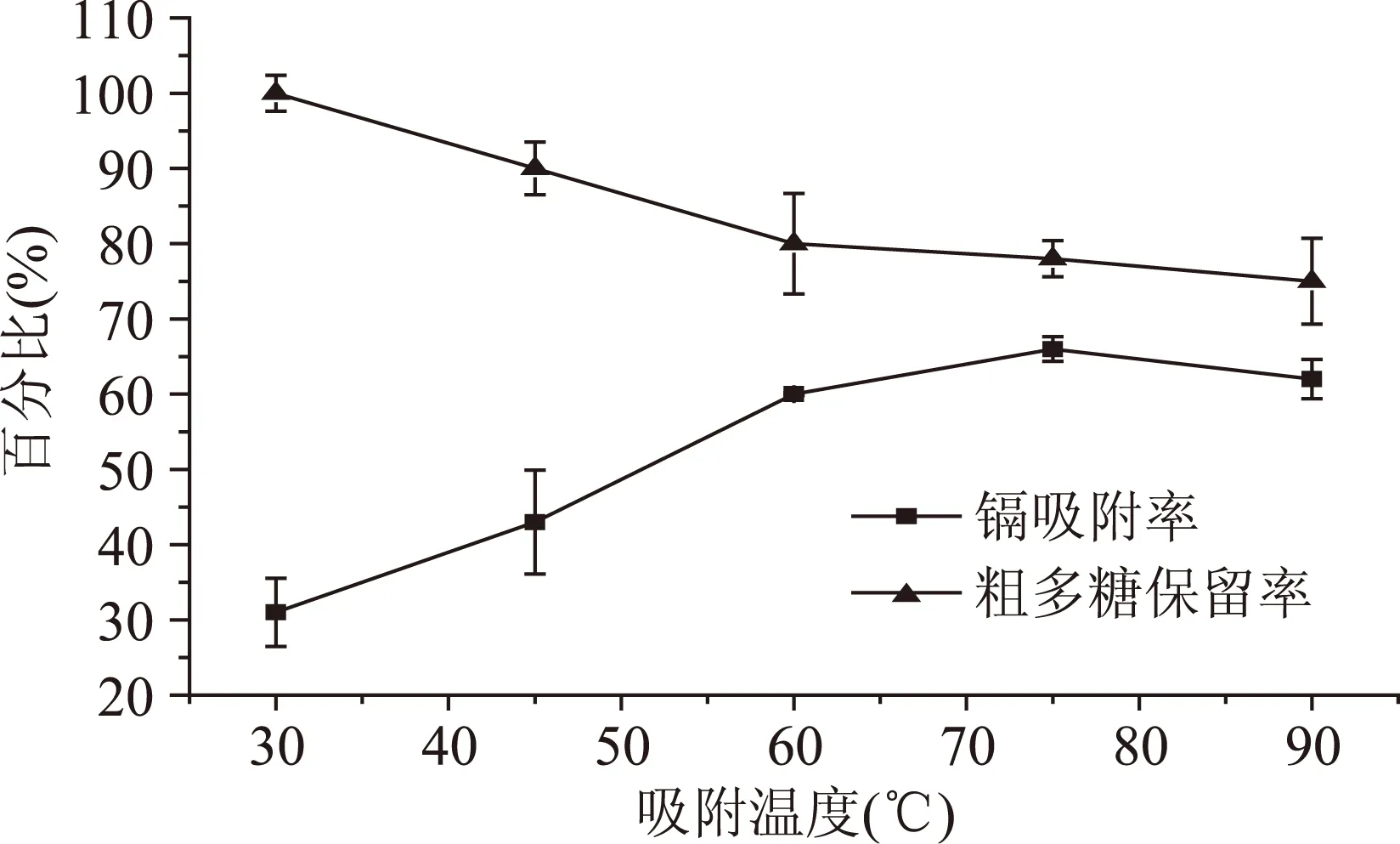
图3 吸附温度对镉吸附率和粗多糖的保留率的影响Fig.3 Effect of temperature on adsorption rate of cadmium and retention rate of polysaccharide
2.2.4吸附时间对镉吸附率和粗多糖保留率的影响从图4可以看出,在1~3 h的时间范围内,随着吸附时间增加,镉吸附率迅速提高,当吸附时间为3 h时,吸附效果最好,之后稍有下降。这是因为在1~3 h时间范围内,随着反应的进行,壳聚糖不断地与镉结合,吸附率逐渐上升;3 h以后,随着时间的继续延长,部分已结合的络合物趋向于分解,导致吸附率下降[14]。与此同时,粗多糖保留率随着反应时间延长缓慢上升。
综合考虑,选取2.5、3.0、3.5 h继续对水提液中镉的吸附做正交实验以确定最佳的吸附时间。
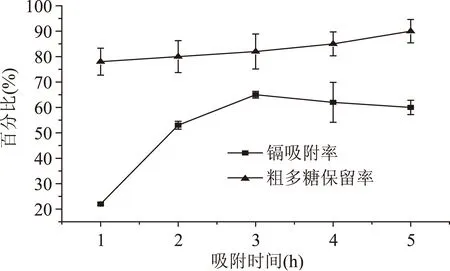
图4 吸附时间对镉吸附率和粗多糖的保留率的影响Fig.4 Effect of time on adsorption rate of cadmium and retention rate of polysaccharide
2.3正交实验优化吸附条件
根据表2可以得出,pH、吸附温度、壳聚糖添加量、吸附时间这四个因素对壳聚糖吸附竹荪水提液中镉的影响强度主次顺序为A>C>D>B。最优正交实验组合实验5的镉吸附率达62.7%。根据表3方差分析可以看出,pH单因素的F比值大于F0.05的临界值,因此,pH对竹荪水提液中镉的吸附有显著性影响(p<0.05),其他因素的影响不显著。从节约能源的角度结合极差分析结果,最终确定最优工艺组合为A2B1C3D1,然而此工艺组合未出现在正交实验组合中,验证实验结果显示,本工艺镉的吸附率为63.8%,优于最优正交实验组合实验5。经最优工艺处理后竹荪水提液中镉含量为282.3 μg/kg,低于限量标准,同时粗多糖保留率为85.6%。
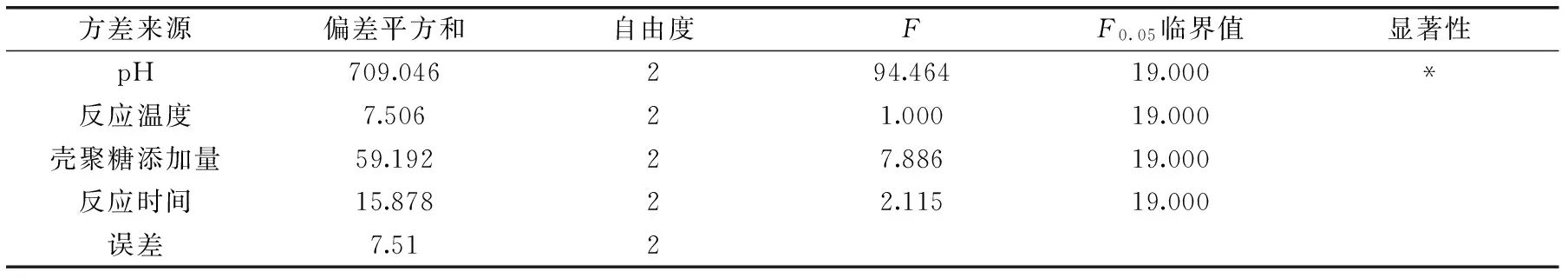
表3 壳聚糖吸附竹荪水提液中镉的正交实验结果的方差分析Table 3 Variance analysis results of orthogonal experiment of absorbing cadmium in water extraction liquid of Dictyophora Indusiata by chitosan
注:*代表具有显著性差异,p<0.05。

表2 壳聚糖吸附竹荪水提液中镉的 正交实验结果与极差分析Table 2 Orthogonal optimization results and range analysis of absorbing cadmium in water extraction ofDictyophora Indusiata by chitosan
2.4壳聚糖吸附镉的机理分析
从图5可知,竹荪水提液中镉主要以游离态、无机态和不稳定态三种形态存在,说明竹荪水提液中只有少量的镉以与有机成分络合的形式存在。壳聚糖吸附后的竹荪水提液中游离态、无机态和稳定态镉的含量相比于吸附前均有所降低,其中游离态和无机态降低较明显,分别降低了72.9%、65.7%,其他形态镉的变化趋势不明显。可见,壳聚糖主要吸附竹荪水提液中游离态、无机态和稳定态的镉,这是由于壳聚糖分子中含有大量的带孤对电子的活性基团(如-OH、-NH2等),这些活性基团对水提液中的镉离子具有很好的吸附能力,但对和有机物络合的镉则无法或难以发生吸附反应[15-16]。

图5 壳聚糖吸附前后镉的形态分布Fig.5 Speciation of cadmium before and after chitosan adsorption
3 结论
本文研究了壳聚糖对竹荪水提液中镉的吸附作用,正交实验确定了其最优吸附条件,研究表明:pH对竹荪水提液中镉的吸附有显著性影响,最佳吸附条件为:pH7.0、温度70 ℃、壳聚糖添加量0.35 g/100 mL、反应时间2.5 h,在此工艺条件下竹荪水提液中镉吸附率达63.8%,同时功效成分粗多糖保留良好,吸附后的竹荪水提液中镉含量达到了食品安全标准限量的要求;进一步的形态分析结果表明,壳聚糖主要吸附竹荪水提液中游离态、无机态和稳定态这三种形态的镉。
本研究提供了一种去除竹荪水提液中镉的方法,壳聚糖是天然生物高分子聚合物,来源广且不会对环境造成二次污染。该方法操作简单、成本低、对竹荪水提液中的镉有良好的吸附效果;同时,有效成分保留率理想,具有很好的实际应用价值。
[1]华洋林,高擎,唐健,等.不同产地竹荪营养成分的比较研究[J].食品工业科技,2011,32(10):418-420.
[2]林陈强,陈济琛,林戎斌,等.竹荪资源综合利用研究进展[J].中国食用菌,2011,3(2):8-11.
[3]利泉,邓艳霞.竹荪的研究与利用[J]. 中国野生植物资源,2000,19(3):21-23.
[4]尤新.我国食品添加剂的开发重点.食品与机械,1995,2:10-12.
[5]Demirbasa. Levels of trace element in the fruit bodies of mushroom growing in the East Black Sea region[J].Energy Education Science & Technology,2006,7(2):67-81.
[6]张卫东.分离纯化技术在医药领域中的应用[J].中国医药技术与市场,2007,7(1):10-19.
[7]Huang C P,Chen Y. Coagulation of colloidal particles in water by chitosan[J]. Journal of Chemical Technology and Biotechnology,1996,66(3):227-232.
[8]汪学楷. 中药中微量元素水平及形态的研究[D].成都:四川大学,2004:27-35
[9]邱倩.中江丹参植株中重金属的分布和形态分析[D].成都:成都理工学:22-30.
[10]Wan Ngah W S,Teong L C,Hanafiah M A K M. Adsorption of dyes and heavy metal ions by chitosan composites:A review[J]. Carbohydrate Polymers,2011,83(4):1446-1456.
[11]Miretzky P,Cirelli A F. Hg(II)removal from water by chitosan and chitosan derivatives:A review[J]. Journal of Hazardous Materials,2009,167(1-3):10-23.
[12]张倩.絮凝剂在大枣多糖提取分离中的应用研究[D].西安:西北大学.2008:34-35.
[13]程珊珊,杨锡洪,章超桦,等. 壳聚糖对镉铅混合离子吸附作用的研究[J].现代食品科技,2011(03):257-261.
[14]Juang R S,Shao H J. A simplified equilibrium model for sorption of heavy metal ions from aqueous solutions on chitosan[J]. Water Research,2002,36(12):2999-3008.
[15]Webster A,Halling M D,Grant D M. Metal complexation of chitosan and its glutaraldehyde cross-linked derivative[J]. Carbohydr Res. 2007,342(9):1189-1201.
[16]Kittur F S,Kumar A B V,Varadaraj M C,et al.Chitooligosaccharides-preparation with the aid of pectinase Isozyme from Aspergillus niger and their antibacterial activity[J]. Carbohydrate research,2005,340(6):1239-1245.
Study on removal of cadmium and its mechanism in water extract ofDictyophoraIndusiataby chitosan
LIU Fu-jia1,3,TAN Li-hao1,3,WU Jia-hao1,CAO Yong1,3,HE Li-ping2,3,*
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Instrumental Analysis & Research Center,South China Agricultural University,Guangzhou 510642,China;3. Guangdong Engineering Research Center of Natural Active Substance,Guangzhou 510642,China)
To investigate the effects on removal of cadmium and its mechanism in water extract ofDictyophoraIndusiataby chitosan,the orthogonal test design was conducted and the adsorption rate of cadmium and retention rate of polysaccharide was the measure indicator. Four adsorption parameters including pH,chitosan content,adsorption temperature and adsorption time were optimized using orthogonal test design based on the single factor experiments. Furthermore,the speciation of cadmium had been investigated before and after adsorption by chitosan. The optimization condition was as follows:the conditions of pH7.0,0.35 g/100 mL of chitosan content,70 ℃ of adsorption temperature and 2.5 h of adsorption time. The adsorption rate of cadmium and retention rate of polysaccharide were 63.8% and 85.6%,respectively. After cadmium removal,the contents of cadmium in water extract ofDictyophoraIndusiatawere decreased under the limit amount requirement of food safety standards. The results of speciation analysis showed that mainly free-state,inorganic-state and steady-state of cadmium were absorbed by chitosan. Chitosan had a good adsorption effect to cadmium and less impact on polysaccharide in water extract ofDictyophoraIndusiata.
Water extracts ofDictyophoraIndusiata;cadmium;polysaccharide;chitosan;speciation analysis
2016-12-27
刘伏佳(1991-),男,在读硕士研究生,研究方向:食品科学与工程,E-mail:liufujia2011@126.com。
贺丽苹(1965-),女,博士,副教授,研究方向:食品质量与安全,E-mail:heliping@scau.edu.cn。
TS218
A
1002-0306(2016)15-0112-05
10.13386/j.issn1002-0306.2016.15.013
