免疫磁珠法分离纯化乳鼠肾血管周细胞*
2016-09-12马跃荣成都中医药大学附属医院病理科四川成都610036
王 丽,马跃荣(成都中医药大学附属医院病理科,四川成都610036)
·论 著·
免疫磁珠法分离纯化乳鼠肾血管周细胞*
王 丽,马跃荣
(成都中医药大学附属医院病理科,四川成都610036)
目的 通过建立肾原代细胞培养,探讨免疫磁珠分离纯化乳鼠肾血管周细胞的方法。方法 选取健康BALB/c乳鼠肾脏,剪碎、消化和过滤制成细胞悬液,原代培养并传代(传3代)。免疫磁珠法分离出神经胶质细胞2型硫酸软骨素糖蛋白(NG-2);倒置相差显微镜观察细胞形态特点,免疫细胞化学检测NG-2、平滑肌肌动蛋白(SMA)和CD31表达,BrdU法检测细胞增殖活性,鉴定是否符合周细胞特征及纯化后的细胞是否具有增殖活性。结果 纯化后获取的细胞宽大扁平,形态呈梭形、三角形或多边形并有突起。细胞核椭圆居中,多为单核,偶为双核,细胞质丰富,无接触性抑制生长,符合周细胞形态及生长特征。NG-2和SMA免疫细胞化学染色阳性表达,CD31免疫细胞化学染色阴性表达,符合周细胞特点。分离纯化后的细胞48、72 h细胞增殖率分别为(0.37±0.11)%、(0.42±0.10)%。结论 免疫磁珠法可使周细胞从细胞成分复杂的肾组织中分离出来,并具有生物活性,可继续体外培养,为后续研究提供参考依据。
免疫磁珠法; 周细胞; 肾小管; 分离和提纯
血管周细胞又称Rouget细胞,是由Zimmermann于1923年首次提出,紧邻内皮细胞,生理情况下与内皮细胞一起维持着内环境稳定[1]。周细胞存在于血管管壁,在不同器官中数量存在明显差异,视网膜中分布较多,肾小管周毛细血管中也有发现。有文献报道,有关在肿瘤和视网膜病变中周细胞较多,少数器官纤维化病变中偶见报道[2]。有学者提出肾间质纤维化发生机制与周细胞-间叶细胞转分化相关[3],该观点一经提出便吸引众多学者目光。周细胞在肾脏病变中的研究多处于体外实验阶段,这就需要纯净的、具有生物活性的周细胞作为实验基础,目前,没有商品化的周细胞株出售,给研究带来不便,所以找到一种可行、高效的获取周细胞的方法是解决研究的首要问题。
1 材料与方法
1.1 材料
1.1.1 动物 选取健康BALB/c乳鼠(由成都中医药大学实验动物中心提供)30只,每只约3 g,雄雌不限。
1.1.2 试剂及仪器 DMEM/F12培养基(赛默飞世尔生物化学制品有限公司),进口胎牛血清(美国Sigma公司),Ⅰ型胶原酶(美国Sigma公司),胰酶细胞消化液(上海碧云天生物技术研究所),免疫磁珠二抗(德国美天妮公司),神经胶质细胞2型硫酸软骨素糖蛋白(NG-2,美国Abcam公司),平滑肌肌动蛋白(SMA,美国Abcam公司),CD31(美国Abcam公司)。超净工作台(成都恒瑞实验设备有限公司),CO2培养箱(山东科博有限公司),电热恒温水浴箱(重庆东悦仪器公司),TD5K台式低速离心机(上海赵迪生物科技有限公司),CKX31/41倒置相差显微镜(日本Olympus公司),免疫磁珠分选仪(德国美天妮公司)。
1.2 方法
1.2.1 肾原代细胞培养 取1~3 d BALB/c乳鼠经颈椎脱臼法处死,经75%乙醇消毒后移入超净工作台,在无菌条件下解剖取肾,经含双抗(青霉素100 U/mL,链霉素100 μg/mL)PBS漂洗、剪碎、消化后,用含10%胎牛血清DMEM/F12培养基终止消化,收集细胞悬液。将细胞悬液离心,重悬后置于37℃,5%CO2培养箱原代培养,细胞生长72 h左右后换液。当细胞铺满80%培养皿底部时,传代并拍照保存。
2.2 细胞纯化 将收集的细胞通过免疫磁珠分选技术,获得少量呈悬浮状的单个透明细胞。48 h时,可见细胞贴壁生长,细胞轮廓清晰可辨。4 d时,生长状态良好的细胞成群分布,细胞宽大扁平、三角形或多边形伴3~5个突起,细胞核呈椭圆居中,单核或双核,细胞质均质透明,相邻细胞间连接紧密(图3)。10 d后细胞生长旺盛,呈交叉重叠状,出现无接触抑制性生长。纯化后细胞出现的形态特征和生长特点均与周细胞相符。
那夜老赵三回来得很晚,那是因为他逢人便讲亡国,救国,义勇军,革命军,……这一些出奇的字眼,所以弄得回来这样晚。快鸡叫的时候了!赵三的家没有鸡,全村听不见往日的鸡鸣。只有褪色的月光在窗上,三星不见了,知道天快明了。
拦河坝坝轴线地基为土岩双层结构,上部覆盖层以卵石、含壤土碎石为主,最大厚度12.4m;下部基岩主要为全、强、弱风化泥岩和砂岩,其中全风化层厚度1~11m。考虑拦河坝沥青混凝土心墙为坝体防渗关键部位,以尽量减少沥青心墙沉降,设计沥青心墙坐落于强风化基岩上、基础按深入强风化岩不少于1.0m控制。
2.1 细胞培养 倒置相差显微镜观察细胞显示,原代培养36 h,培养皿中细胞大部分贴壁,少许透亮细胞悬浮于培养基中;48 h时,通过首次换液及差异培养,培养皿底的细胞碎片等杂质成分减少,背景变得干净,同时贴壁细胞数量明显增多,轮廓分明;3 d时,培养皿底贴壁细胞散落分布,细胞扁平有向外伸展趋势(图1);5 d时,贴壁细胞单层平铺延伸,胞体明显增大,形状有所差异,胞核圆形或椭圆形居中,细胞质清晰,内含细小颗粒(图2);7 d时,贴壁细胞生长密集,呈编织状外观;当培养皿底铺满约80%细胞时传代,传代(传3代)细胞与原代细胞形态相同。
2.3 纯化细胞鉴定 将收集的细胞爬片后行免疫细胞化学染色,可见NG-2、SMA抗原表达,细胞质呈棕黄色颗粒细胞达95%以上,未见CD31抗原表达(图4)。
摘 要:闸述传统文化晨读之内容,阐明传统文化晨读之意义。首先,学生的知识储备量得以提高;其次,对学生正在形成的人文思想具有正面、积极的影响作用;第三,学生的诗词鉴赏能力得以提高。
1.3 统计学处理 应用SPSS19.0统计软件进行数据分析,计量资料以±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。
where S is the entropy, N is the number of carriers, and U is the internal energy.
1.2.2 细胞分离纯化 贴壁细胞经消化及离心后成细胞悬液,收集于离心管中,经缓冲液洗涤,移入EP管中。加一抗稀释液(1∶50 NG-2)100 μL于EP管中吹打,孵育。洗涤、离心后加入免疫磁珠二抗(1∶4稀释)孵育。洗涤、离心后缓冲液重悬。将细胞悬液通过在磁场中的分选柱,用缓冲液冲洗后移离磁场,加缓冲液洗脱获取周细胞,在培养基中培养。
2 结 果
1.2.3 免疫细胞化学检测 收集细胞悬液,制作12张爬片(实验组NG-2/SMA/CD31各3张,阴性对照组各1张),加入0.3%过氧化氢溶液,37℃孵育,消除内源性过氧化物酶,洗涤。实验组及阳性对照组(由成都中医药大学附属医院病理科提供的供性白片)分别滴加NG-2、SMA、CD31一抗,阴性对照组加PBS,孵育后加入二抗标记。DAB显色、脱水、封片,拍照。

图1 原代细胞培养3 d的贴壁细胞形态(40×)
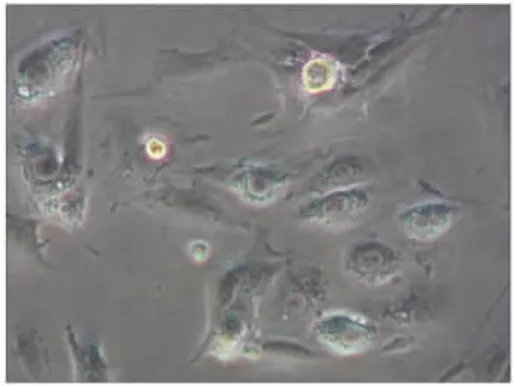
图2 原代细胞培养5 d的贴壁细胞形态(200×)
定植后应及时中耕除草,植株进入旺盛生长期应经常浇水,保持土壤湿润。苦瓜生长期长,结瓜多,需肥量大,定植前应施足底肥。通常每667平方米施入优质农家肥5000千克,配合施用过磷酸钙25千克,硫酸钾10千克,深翻耙平,并开厢作畦。育苗移栽比直播提早7~10天上市,而且产量高。幼苗长至2~3片真叶时可移栽。春季栽培,植株蔓叶生长旺盛,侧蔓较多,且挂果以侧蔓为主,必须适当疏种,移植时一定要淋足定根水。
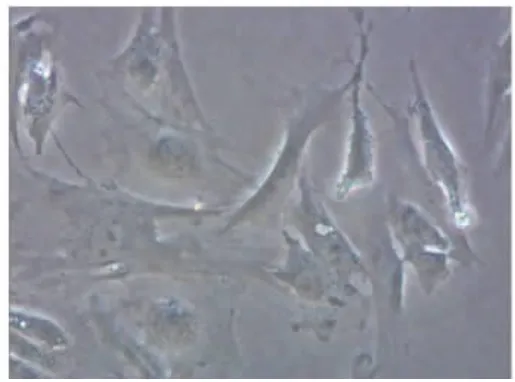
图3 周细胞4 d时的细胞形态(200×)
1.2.4 细胞活性检测 收集细胞悬液,制作10张爬片(48、72 h各5张),4%多聚甲醛室温固定,用含0.3% Triton X-100的PBS漂洗,经0.3%过氧化氢溶液37℃孵育,阻断内源性过氧化酶,漂洗、变性,0.1 mol/L硼酸(pH=8.0)中和,0.3%Triton X-100 PBS漂洗,山羊血清封闭孵育,滴加Anti-BrdU抗体4℃过夜;二抗室温孵育。DAB显色、苏木素复染、双蒸水洗涤,脱水、封片,光镜下观察,照相保存。40倍镜下随机选取6个非重叠视野,分别计数阳性细胞及总细胞个数,计算增殖率。
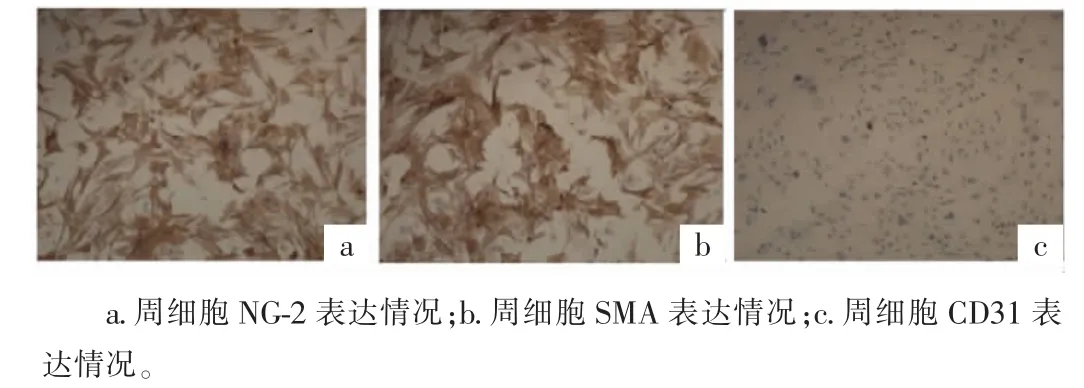
图4 免疫细胞化学染色(200×)
2.4 细胞增殖活性检测 分离纯化后的细胞培养48、72 h,经Anti-BrdU抗体孵育,40倍镜下计数,48 h培养组细胞增殖率为(0.37±0.11)%;72 h培养组细胞增殖率为(0.42±0.10)%,2个时间点比较,差异有统计学意义(P<0.05)。
3 讨 论
血管周细胞是体内微血管系统的重要组成之一,紧邻内皮细胞,与内皮细胞间通过密切连接维持相互的稳定性,构成了微血管和组织间隙的基本屏障。有文献报道,周细胞是一种原始的间充质细胞,因此,在某些特殊情况下,周细胞存在转分化的可能性[2]。长期以来,在肾间质纤维化发生机制中,肾小管上皮细胞-间叶细胞转分化学说占主导地位,但复杂的机制可能还有其他解释,相关研究一直在持续[4-5]。2008年,新近学者在肾间质纤维化机制研究中提出了周细胞-间叶细胞转分化学说,该学说一经提出便引起诸多学者的关注、跟进[5]。因此,随着研究的深入,周细胞逐渐成为新的切入点。
本实验原代细胞培养采用酶消化法,直接取乳鼠肾组织进行体外培养,因细胞刚从组织分离,且传代数较少,所以可以最大限度地保持细胞原有生物学特性。作者认为整个实验细胞无污染是成功的关键,所以本实验中,在遵守无菌操作原则基础上,尽量减少污染概率,为实验的成功提供保障。乳鼠在有菌环境中被处死,经75%乙醇浸泡消毒30s,可减少皮肤表面细菌,移入超净工作台中解剖获取肾组织,并经含有双抗(青霉素100U/mL、链霉素100 μg/mL)的PBS反复冲洗及含双抗(同上)的培养基培养,均可最大限度地降低污染的概率。本实验采用酶消化法,如何选择合适的酶,获取尽量多的具有活性的细胞尤为重要,所以作者在预实验中用胰蛋白酶、胰蛋白酶联合Ⅰ型胶原酶及Ⅰ型胶原酶分别消化肾组织块,反复实验得出,Ⅰ型胶原酶消化细胞存活率高,消化时间易于把握,可以作为本实验的消化酶。
肾脏细胞组成复杂,原代培养混有内皮细胞、系膜细胞和纤维细胞等,要获取纯净的周细胞,需要对其进行筛选。实验中常用的分选方法有流式细胞技术、离心分离技术及免疫磁珠分选技术等。有资料显示,流式细胞技术耗时长、易污染[6],后期培养细胞存活率低。离心分离技术包括沉淀离心、差速离心和密度梯度离心等,离心时间长,对细胞产生的机械性损伤较大,对操作者技能要求较高,虽然可以成功分离靶细胞,但对细胞生物活性影响较大,不利于后期研究[7]。免疫磁珠法设备简单,操作便捷,其最大优势是可在超净工作台中实现无菌操作,对细胞损伤小,分选后细胞易存活[8]。其原理是基于抗原抗体结合反应,将带磁珠的抗体与靶细胞表面抗原顺利结合,利用磁场中的磁性吸附带磁珠的靶细胞,从而达到分离靶细胞的目的。目前在视网膜及淋巴细胞等研究中得到广泛运用,王应利等[9]已成功通过免疫磁珠分选法原代分离视网膜微血管周细胞,而用于分离肾脏周细胞却鲜见报道,作者尝试用该方法分离。
在本实验中,作者通过原代和传代培养使细胞增殖,利用周细胞相对特异的表面抗原蛋白NG-2,选用带有NG-2抗体的磁珠,将靶细胞从细胞悬液中分离出来。纯化后的细胞贴壁生长,细胞宽大扁平,形态梭形,三角形或多边形并伴长短不一突起。细胞核呈椭圆居中,单核或双核,细胞质略微丰富。10 d后,密集的细胞表现出无接触性抑制生长方式。有研究报道,周细胞可表达α-SMA、平滑肌肌球蛋白、NG-2等,但不表达内皮细胞标志物,说明对于周细胞的鉴定,需要联合抗原检测[10]。根据周细胞表面抗原特点,本实验联合应用NG-2、SMA和CD31 3种抗体进行免疫细胞化学检测,发现获得的细胞NG-2、SMA抗原阳性表达,CD31抗原阴性表达,综合观察得出,分离获得的细胞特征与Nicosia等[11]及Smith等[12]对周细胞研究报道相符。分离纯化后的周细胞48、72 h增殖率为(0.37±0.11)%、(0.42±0.10)%,具有较强的增殖活性。以上实验表明,原代细胞培养后,通过以抗原-抗体结合反应为基础的免疫磁珠分选技术分选,不仅可获得高纯度的血管周细胞,还可因操作简单、无污染,最大限度地减少对细胞活性的影响,作为获取纯化肾血管周细胞的一种可行方法,从而为肾血管周细胞的进一步研究奠定坚实基础。
[1]Díaz-Flores L,Gutiérrez R,Madrid JF,et al.Pericytes.morphofunction,interactions and pathology in a quiescent and activated mesenchymal cell niche[J].Histol Histopathol,2009,24(7):909-969.
[2]赵晨阳,王岚,李砚超,等.周细胞的标记分子、生理功能和相关疾病[J].生理科学进展,2012,43(3):207-210.
[3]Lin SL,Kisseleva T,Brenner DA.Pericytes and perivascular fibroblasts are the primary source of Collagen-Producing cells in obstructive fibrosis of the kidney[J].Am J Pathol,2008,173(6):1617-1627.
[4]Strutz F,Müller GA.Transdifferentiation comes of age[J].Nephrol Dial Transplant,2000,15(11):1729-1731.
[5]Humphreys BD,Lin SL,Kobayashi A,et al.Fate tracing reveals the pericyte and not epithelial origin of myofibroblasts in kidney fibrosis[J].Am J Pathol,2010,176(1):85-97.
[6]DeHaas AH,Boddeke HW,Biber K.Region-specific expression of immunoregulatory proteins on microglia in the healthy CNS[J].Glia,2008,56(8):888-894.
[7]Pountos I,Corscadden D,Emery P,et al.Mesenchymal stem cell tissue engineering:techniques for isolation,expansion and application[J].Injury,2007,38 Suppl 4:S23-33.
[8]Stanciu LA,Shute J,Holgate ST,et al.Production of IL-8 and IL-4 by positively and negatively selected CD4+and CD8+human T cells following a four-step cell separation method including magnetic cell sorting(MACS)[J].J Immunol Methods,1996,189(1):107-115.
[9]王应利,郭斌,惠延年,等.免疫磁珠法原代分离培养大鼠视网膜微血管周细胞[J].眼科新进展,2005,25(6):498-502.
[10]Armulik A,Genové G,Betsholtz C.Pericytes:developmental,physiological,and pathological perspectives,problems,and promises[J].Dev Cell,2011,21(2):193-215.
[11]Nicosia RF,Villaschi S.Rat aortic smooth muscle cells become pericytes during angiogenesis in vitro[J].Lab Invest,1995,73(5):658-666.
[12]Smith SW,Chand S,Savage CO.Biology of the renal pericyte[J].Nephrol Dial Transplant,2012,27(6):2149-2155.
Isolation and purification of sucking mice pericytes by immunomagnetic bead techniques*
Wang Li,Ma Yuerong
(Department of Pathology,Affiliated Hospital of Chengdu University of Traditional Chinese Medicine,Chengdu,Sichuan 610036,China)
Objective To establish the primary culture by renal cells and to investigate the isolation and purification method of sucking mice renal vessel pericytes by the imunomagnetic bead technique.Methods The kidney of healthy BALB/c sucking mice was selected,cut into pieces,digested and filtered for preparing the cellular suspension.The primary culture and passage(3 generations)were performed;the mimunomagnetic bead technique isolated neurogliocytes(NG-2);the inverted phase contrast microscope was adopted to observe the cellular morphological characteristics,the immunohistochemistry was used to detect NG-2,SMA and CD31 expression by joint judgement,the cellular proliferation activity was detected by using the BrdU method.Whether meeting pericytes characteristics and whether purified cells having the proliferation activity were identified.Results The cells obtained by purification were wide and flat,the morphologies were fusiform,triangle or polygon with prominence.The cellular nucleus was ellipse and in the middle,the majority were mononucleus,occasionally bi-neucleus,with plentiful cytoplasma,without contacting inhibition growth,which conformed to the pericytes morphology and growth characteristics.NG-2 and SMA were positively expressed by immunocytochemical staining,CD31 was negatively expressed,which conformed to the pericytes characteristics.The 48,72 h proliferation activities of isolated and purified cells were(0.37±0.11)%and(0.42±0.10)%respectively.Conclusion The imunomagnetic bead method can make the pericytes to be isolated from the kidney with complex cellular compositions,which have biological activity,can continuously culture in vitro and provide the reference basis for subsequentstudy.
Immunobead method; Pericytes; Kidney tubules; Isolation and purification
10.3969/j.issn.1009-5519.2016.16.001
A
1009-5519(2016)16-2453-03
四川省卫生厅科技资助项目(80173)。
王丽(1984-),硕士研究生,主要从事肾脏病理的研究。
2016-05-11)
