慢性血栓栓塞性肺动脉高压基因表达谱的研究
2016-09-11李广辉,刘岩,苏丕雄等
基础研究
慢性血栓栓塞性肺动脉高压基因表达谱的研究
李广辉 刘岩 苏丕雄 张希涛 安向光 高杰 顾松
目的 利用基因表达谱芯片研究慢性血栓栓塞性肺动脉高压病变组织中差异表达的基因,从多基因角度研究疾病发生的分子机制。方法 选取5例慢性血栓栓塞性肺动脉高压患者的肺动脉内膜组织作为实验组,并选择年龄和性别相匹配的5例肺移植供体的正常肺动脉内膜组织为对照组。分别提取、纯化RNA,反转录为cDNA,与Affymetrix 2.0 ST基因芯片进行体外杂交,通过扫描信号及数据处理,分析出CTEPH肺动脉内膜的差异基因表达谱,并选择部分基因进行反转录聚合酶链反应(RT-PCR)验证。结果 通过对两组基因表达谱比较分析,筛选出有统计学差异的1614个基因。其中880个基因表达上调,734个基因表达下调。筛选出差异最显著的5个上调基因和5个下调基因,RT-PCR验证TBX15、FMO3、ITIH3、CHRDL1、ACADL表达与芯片结果符合。结论 慢性血栓栓塞性肺动脉高压存在显著的差异基因表达谱,筛选出来的差异基因涉及炎症反应、细胞黏附、血栓形成、平滑肌增殖、血管生成等,而完整的基因功能信息、传导通路、信号网络等,尚需进一步研究。
肺栓塞; 肺动脉高压; 基因表达谱
慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)是临床上常见的潜在致命性疾病,在所有心血管疾病中发病率仅次于冠状动脉粥样硬化性心脏病和高血压[1]。近段肺动脉内存在机化或新鲜血栓及内膜增生是CTEPH的典型特征。疾病诊断时往往已处于终末期,此时肺动脉压(pulmonary artery pressure,PAP)和肺血管阻力(pulmonary vascular resistance,PVR)已较正常值增高了5~10倍,导致肺动脉高压和进行性右心功能衰竭,终末发展为全心衰[2]。
肺动脉内膜剥脱术(pulmonary endarterectomy,PEA)是目前治疗CTEPH最重要的手段之一,也是唯一的根治手段[3]。术后大约50%的患者血流动力学能恢复到正常水平。然而,15%~20%的患者术后PAP和PVR却持续升高,导致围术期死亡率增加了4%~5%[4]。某些因素如C反应蛋白、血栓素A2、内皮素-1、vW因子可能参与到肺动脉高压的病理生理过程[5]。然而,由于存在数量较多的具有不同功能的基因位点,难以彻底阐明其发病机制。
20世纪90年代以来,商用化的基因芯片技术使得探究疾病本质成为了可能。而新一代高通量基因表达谱芯片的出现,使得我们能快速全面分析CTEPH的基因表达。在本研究中,我们运用生物信息学分析CTEPH和对照组基因表达谱,筛选出显著差异表达的基因。根据不同患者的遗传特征来制订更加个性化的诊治方案,此项研究成果会对此起到积极作用。
1 对象与方法
1.1 研究对象 选取2013年6~12月就诊于首都医科大学附属北京朝阳医院心外科的5例CTEPH患者,术前均行肺通气与灌注断层扫描、右心导管肺动脉造影检查并已确诊。CTEPH诊断标准是患者经过至少6个月有效抗凝后仍存在劳力性呼吸困难,平均PAP>25mm Hg(1mm Hg=0.133kPa)。肺通气及灌注扫描可提示肺部节段或更大面积的病变。CTEPH的最终确诊依赖右心导管肺动脉造影[6]。5例CTEPH患者均在我院实施肺动脉内膜剥脱术。实验组为PEA手术所取的5例病变肺动脉内膜组织,其中男性2例、女性3例,平均年龄(38.2±14.7)岁。对照组是年龄和性别相匹配的5例肺移植供体的正常肺动脉内膜组织,其中男性3例、女性2例,平均年龄(35.3±10.6)岁。手术取材后即刻将组织置入液氮罐,转移储存于-80℃超低温冰箱,备总RNA提取。本研究经首都医科大学附属北京朝阳医院伦理委员会批准,患者签署知情同意书后开展。
1.2 方法
1.2.1 芯片制备 实验选用美国Affymetrix公司新一代的Human Gene 2.0 ST全转录组芯片,全面覆盖转录组,可以同时检测>30 000个编码的转录本和>11 000个长链非编码转录本;探针设计最大程度覆盖所有外显子,可检测选择性拼接/转录本变体。每个转录本覆盖特异探针的数目中值达到21种,每种探针的长度为25 bp。
1.2.2 总RNA提取与质检 实验组和对照组标本用冷冻机粉碎,采用 TRIzol试剂(加拿大Invitrogen)提取,RNeasy Mini Kit(德国Qiagen)纯化,并利用脱氧核糖核酸酶将DNA酶解,完成总RNA抽提。采用Nano Drop 2000分光光度计,测定不同波长吸光度,利用260 nm与280 nm的吸光度比值A260/A280(1.9~2.1)评估总RNA的浓度和纯度。用1.5%甲醛变性凝胶电泳(电压120 V)15 min,在凝胶成像仪下检测总RNA中28 S和18 S的完整性。
1.2.3 RNA反转录与体外转录 在PCR仪反转录依次合成First-cDNA的第一链和第二链,之后通过体外转录合成cRNA,纯化除去杂质。以cRNA为模板,利用随机引物和含有dUTP适合浓度的dTTP进行反转录合成2nd-cDNA,去除cRNA模板,纯化后备用。
1.2.4 样品标记与芯片杂交 吸取片段化混悬液到样本2nd-cDNA中,混匀,离心,在PCR仪中孵育反应,得到片段化产物。采用2%琼脂糖凝胶电泳,检测片段化cDNA片段大小,本实验范围控制在100 bp以下。利用TdT标记试剂将片段化cDNA标记,标记后的片段cDNA与Human Gene 2.0 ST芯片杂交,在Affymetri杂交炉(GeneChip2 Hybridzation Oven640)中,温度45℃,转速60 r/min条件下杂交16 h。
1.2.5 芯片洗涤和扫描 杂交完成后,吸除杂交液,在Affymetrix GeneChip Command Console中扫描注册样品信息。在Affymetrix洗脱站(GeneChip2 Fluidics Station 450)完成芯片洗涤、染色;采用Affymetrix扫描仪(GeneChip2 Scanner 3000 7G)进行芯片扫描生成数据。利用RMA方法使原始数据标准化,得到的芯片标准数据用Affymetrix公司的表达控制软件(版本1.2.1)进行分析。
1.2.6 反转录聚合酶链反应验证 采用反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)实时荧光定量技术,在显著差异表达基因中随机选取表达差异倍数(Fold Change,FC)较为显著的5个基因,设计相应的PCR引物,以提取的总RNA反转录合成cDNA,以其为模板进行RT-PCR予以验证。
1.3 统计学方法 采用SPSS 18.0统计分析软件进行统计。用±s表示正态分布计量资料,比较采用独立样本配对t检验;计数资料以频数或百分比表示,采用卡方检验;非正态分布资料采用中位数(M)及四分位数(P25,P75)表示。P<0.05为差异有统计学意义。
2 结果
2.1 总RNA质检结果 提取的总RNA在1.5%甲醛变性凝胶电泳检测,28 S和18 S核糖体RNA条带亮而浓,28 S∶18 S条带亮度比值接近2∶1;260 nm与280 nm波长的吸光度比值A260/A280在1.9~2.1范围内,总RNA纯度和完整性符合基因芯片实验要求。
2.2 基因筛选结果 根据基因芯片杂交结果分析,对比实验组和对照组,发现1614个基因有统计学差异。与对照组相比,实验组880个基因表达上调,734个基因表达下调。差异倍数即两组基因高表达量与低表达量的比值。表达上调时,FC取正值,反之取负值。取P<0.05、FC>3为筛选条件,得到了上调基因和下调基因各5个,具有最重要的统计学差异。见表1、2。
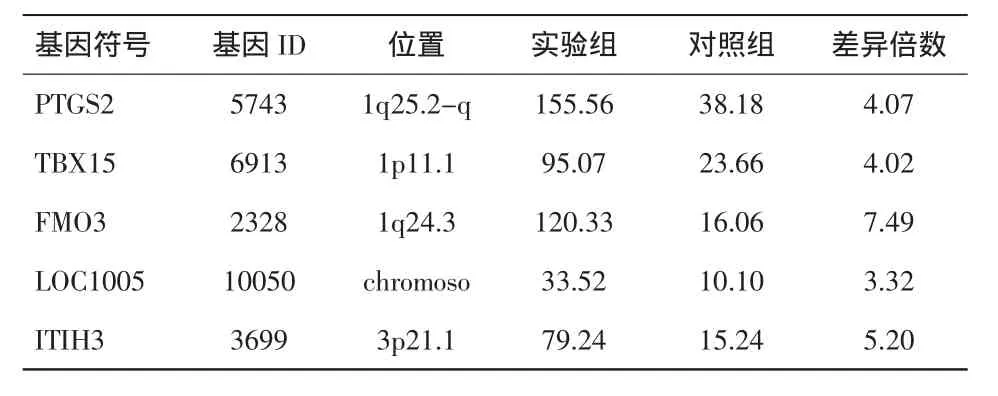
表1 重要的表达上调基因
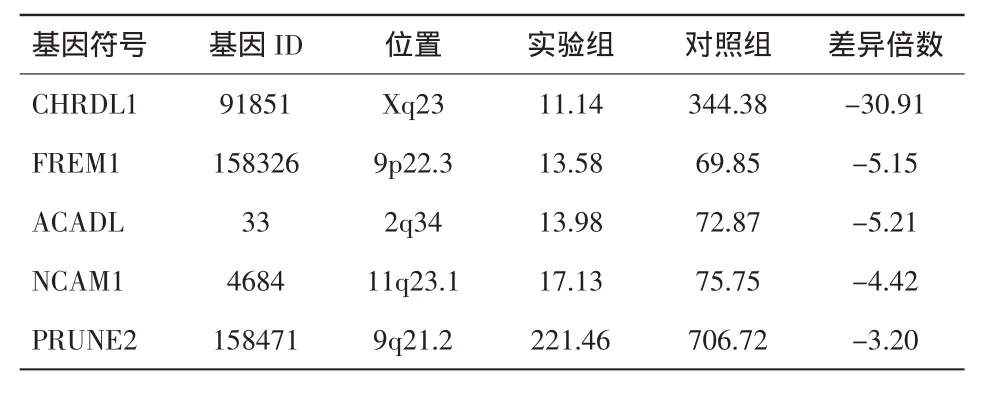
表2 重要的表达下调基因
2.3 聚类分析(hierarchical clustering) 将实验组和对照组筛出的有统计学意义的1614个差异基因用Cluster 3.0软件进行聚类分析,图1为分析后的聚类热图。1614个差异基因进行聚类后,5例实验组样本聚类在一起,5例对照组样本聚类在一起,总体正确聚类效率100%。
2.4 部分差异表达基因的验证 选取不同差异表达水平的 5个基因,其中表达上调基因 3个(TBX15、FMO3、ITIH3),表达下调基因 2个(CHRDL1、ACADL),应用RT-PCR检测基因表达水平。基因芯片和RT-PCR检测的基因差异表达结果一致,RT-PCR验证结果见图2。
3 讨论
CTEPH是急性肺栓塞后血栓因种种原因未完全溶解而持续存在,通过机化、纤维化、重构而导致肺血管阻塞。目前认为CTEPH的病因存在血栓形成、溶栓异常、炎症刺激三方面机制[7]。既往许多研究显示,慢性血栓栓塞性肺动脉高压的发生受多种因素影响,其病理生理学过程仍未完全阐明。为此,国内外相继开展了一些更深层次的研究:细胞学特征、染色体核型分析、荧光原位杂交、单核苷酸多态性、基因表达谱等。通过基因芯片技术,有助于发现影响CTEPH发生、发展的关键基因。
近年来,基因表达谱芯片(cDNA microarrays)因其高通量、所需样本量少、快速、敏感、自动化等特点,越来越多地被用于寻找新的疾病相关基因和关键性调控基因。通过将大量的寡核苷酸或cDNA片段高密度排列于特定载体上,根据碱基互补配对原理与样本杂交后,用荧光检测系统扫描、检测,获得大量有价值的基因信息。通过生物学信息对各基因的表达进行比较和统计分析,确定不同基因在表达上的相关性,分析基因功能、传导通路、信号网络,为探究疾病机制提供线索。
通过基因芯片技术已发现了一些与慢性血栓栓塞性肺动脉高压可能相关的基因表达变化。Gu等[8]利用基因芯片筛选出了CTEPH的第1个表达上调的差异基因:氧化型低密度脂蛋白受体1(oxidized low density lipoprotein,OLR1),被发现与血管粥样硬化等心血管疾病相关。最近,Wynants等[5]发现,OLR1在CTEPH中也有高表达。Lindner等[9]筛选出了CTEPH第2个表达上调的基因:白介素8(interleukin 8,IL8),被发现与PEA手术后血流动力学不稳定相关。第3个被发现的重要表达上调基因是分泌型焦磷酸蛋白1(secreted phosphoprotein 1,SPP1),促使组织分泌骨钙素。有研究发现,绝大多数CTEPH表达下调的基因,都与肿瘤发生、炎症趋化因子、脂类代谢等相关。如下调基因趋化因子配体14[chemokine(C-X-C motif)ligand 14,CXCL14],促进产生炎症趋化因子[10]。另外一个下调基因乙酰肝素酶2(heparanase 2,HPSE2),编码与Urofacial综合征(UFS)相关的代谢酶类[11]。然而,上述OLR1、IL8、SPP1、CXCL14、HPSE2等基因在本研究中未显著表达,考虑可能受疾病相关基因的多态性、个体差异、标本数量等影响。
本研究选用了Affymetrix Human Gene 2.0 ST芯片是新一代全转录组基因芯片,敏感度高,全面覆盖转录组。通过检测CTEPH病变肺动脉内膜和对照组正常肺动脉内膜的基因表达谱,比较分析后得到了1614个有统计学意义的差异表达基因,其中880个基因上调,734个基因下调。设定P<0.05、FC>3,筛选出了最重要的5个上调基因和5个下调基因。
上调基因中的环氧化酶2(prostaglandin-endoperoxide synthase 2,PTGS2)促进前列腺素的合成和释放,在细胞分裂、舒张血管、炎症反应中发挥重要作用。含黄素单氧化酶 3(flavin containing monooxygenase 3,FMO3)能编码一种关键的肝微粒体酶,参与体内大量药物、外源性物质和其他一些化学物质的氧化代谢。Nakamaru等[12]的研究发现,FMO3和细胞色素P450酶(CYP3A4)协同参与胆固醇、类固醇、脂类的合成代谢,与心血管疾病的发生相关。而另一个重要的上调基因α胰蛋白酶抑制剂重链3(inter-alpha-trypsin inhibitor heavy chain 3,ITIH3)有研究证实在心肌梗死、易栓症患者中高表达,提示与血小板、血管平滑肌细胞、巨噬细胞聚集,动脉粥样斑块病变相关[13]。
下调基因中差异倍数最显著的基因,脊索生成素样蛋白1(chordin-like protein 1,CHRDL1),编码类脊索蛋白1,能拮抗骨形态发生蛋白4。Kane等[14]的研究发现,在缺氧的视网膜周细胞中CHRDL1高表达,抑制BMP4,同时分泌血管内皮生长因子(vascular endothelial growth factor,VEGF),促进视网膜内血管生成。第2个重要下调基因,细胞外基质蛋白1(FRAS1 related extracellular matrix 1,FREM1)则与跨膜通透、炎症反应等密切相关。基因长链酰基辅酶A脱氢酶(acyl-CoA dehydrogenase,long chain,ACADL)通过编码酰基辅酶A脱氢酶调节细胞氧化、能量代谢等,ACADL表达异常与缺氧时能量产生障碍相关[15]。显著下调的基因神经细胞黏附分子 1(neural cell adhesion molecule 1,NCAM1)则与血管平滑肌收缩、细胞黏附聚集相关[16]。
慢性血栓栓塞性肺动脉高压的发生和发展是一个复杂的多阶段过程,与多基因表达异常相关。通过此项研究,我们初步筛查出差异表达的基因,结合其生物学信息,涵盖了多个生物学过程,主要与炎症反应、细胞黏附、血栓形成、平滑肌增殖、血管生成等相关。
高通量基因表达谱芯片有助于快速筛查出致病基因及其编码产物,从本质揭示疾病的产生机制和发展过程。但此研究亦有一定的局限性,入组样本量小、标本取自病变肺动脉的不同位置(Jamieson分型不同)、个体差异等势必会产生一定假阳性,尚需进一步扩大样本量验证,同时需结合CTEPH的Jamieson病理分型,以期得到更准确的CTEPH基因学分型。后续还需进一步开展差异基因的功能信息、传导通路、信号网络等研究,为实现CTEPH的个体化诊疗提供理论依据。

图1 差异基因检测结果聚类热图。实验组(Experimental Group,Exp)和对照组(Control Group,Con)。横坐标代表分组的样本,纵坐标代表差异基因。基因表达水平用色度表示,红色表示基因表达水平高,绿色则低。
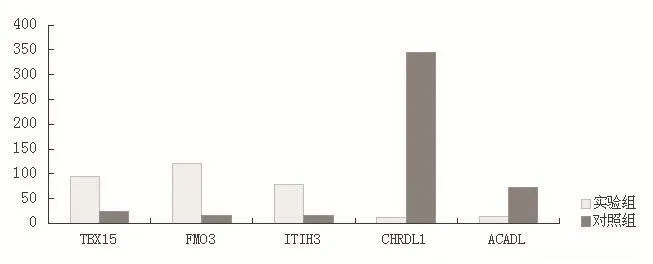
图2 部分差异表达基因的RT-PCR验证
[1]Jamieson SW,Nomura K.Indications for and the results of pulmonary thromboendarterectomy for thromboembolic pulmonary hypertension.Semin Vasc Surg,2000,13:236-244.
[2]Hoepermm,Mayer E,Simonneau G,et al.Chronic thromboembolic pulmonary hypertension.Circulation,2006,113:2011-2020.
[3]Madanimm,Auger WR,Pretorius V,et al.Pulmonary endarterectomy:recent changes in a single institution experience of more than 2700 patients.Ann Thorac Surg,2012,94:97-103.
[4]Freed DH,Thomson BM,Tsui SS,et al.Functional and haemodynamic outcome 1 year after pulmonary thromboendarterectomy. Eur J Cardiothorac Surg,2008,34:525-530.
[5]Wynants M,Quarck R,Ronisz A,et al.Effects of C-reactive protein on human pulmonary vascular cells in chronic thromboembolic pulmonary hypertension.Eur Respir J,2012,40:886-894.
[6]Jenkins D,Mayer E,Screaton N,et al.State-of-the-art chronic thromboembolic pulmonary hypertension diagnosis and management.Eur Respir Rev,2012,21:32-39.
[7]Lang IM,Klepetko W.Chronic thromboembolic pulmonary hypertension:an updated review.Curr Opin Cardiol,2008,23:555-559.
[8]Gu Y,Liu Z,Li L,et al.OLR1,PON1 and MTHFR gene polymorphisms,conventional risk factors and the severity of coronary atherosclerosisin a Chinese Han population.CellPhysiol Biochem,2013,31:143-152.
[9]Lindner J,Maruna P,Kunstyr J,et al.Hemodynamic instability after pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension correlates with cytokine network hyperstimulation.Eur Surg Res,2009,43:39-46.
[10]Zeng J,Yang X,Cheng L,et al.Chemokine CXCL14 isassociated with prognosis in patients with colorectal carcinoma after curative resection.J Transl Med,2013,11:6.
[11]Mahmood S,Beetz C,Tahirmm,et al.First HPSE2 missense mutation in urofacial syndrome.Clin Genet,2012,81:88-92.
[12]Nakamaru Y,Hayashi Y,Ikegawa R,et al.Metabolism and disposition of the dipeptidyl peptidaseⅣ inhibitor teneligliptin in humans.Xenobiotica,2014,44:242-253.
[13]Ebana Y,Ozaki K,Inoue K,et al.A functional SNP in ITIH3 is associated with susceptibility to myocardial infarction.J Hum Genet,2007,52:220-229.
[14]Kane R,Godson C,O′Brien C.Chordin-like 1,a bone morphogenetic protein-4 antagonist,is upregulated by hypoxia in human retinal pericytes and plays a role in regulating angiogenesis.Mol Vis,2008,14:1138-1148.
[15]Maher AC,Mohsen AW,Vockley J,et al.Low expression of long-chain acyl-CoA dehydrogenase in human skeletal muscle. Mol Genet Metab,2010,100:163-167.
[16]Kataria H,Lutz D,Chaudhary H,et al.Small Molecule Agonists of Cell Adhesion Molecule L1 Mimic L1 Functions in Vivo.Mol Neurobiol,2015,8:1-23.
Study of the differential gene expression profiles in chronic thromboembolic pulmonary hypertension
LI Guang-hui,LIU Yan,SU Pi-xiong,et al.Department of Cardiac Surgery,Beijing Chaoyang Hospital,Capital Medical University,Beijing 100020,China
GU Song,E-mail:zhaogu@sina.com
Objective To investigate the differential gene expression profiles in chronic thromboembolic pulmonary hypertension and discuss the pathogenesis by cDNA microarray.MethodsAffymetrix Human Gene 2.0 ST microarray was used to examine the gene expression profiles of pulmonary artery endothelial cells from 5 CTEPH patients and 5 healthy controls from donors of lung transplants and matches to the patients with CTEPH. Total RNA was isolated and purified,reverse transcribed to cDNA.cDNA was hybridized to microarrays.The differential expressed genes were identified to RT-PCR analysis.ResultsCompared to normal samples,1614 genes with statistically changes in expression were identified.Of these,880 genes were upregulated in CTEPH group and 734 were downregulated.Five genes that were the most significantly upregulated or downregulated according to the P-value and fold change.RT-PCR results of TBX15,FMO3,ITIH3,CHRDL1,ACADL were consistent with gene chip analysis.ConclusionThe differential expressed genes in CTEPH most involved in inflammation,disturbed thrombolysis,enhanced thrombosis,cell adhesion,smooth muscle proliferation,angiogenesis.However,further studies are requied to identify GO analysis,pathway and signal-net.
Pulmonary embolism; Pulmonary hypertension; Gene expression profiles
北京市卫生系统高层次卫生技术人才培养计划(项目编号:2011-3-017)
100020 北京市,首都医科大学附属北京朝阳医院心外科
顾松,E-mail:zhaogu@sina.com
10.3969/j.issn.1672-5301.2016.04.022
R654.2
A
1672-5301(2016)04-0370-05
2015-12-11)
