OCT在大隐静脉桥血管病变中的应用价值
2016-09-11高鹏林文华
高鹏 林文华
综述
OCT在大隐静脉桥血管病变中的应用价值
高鹏 林文华
大隐静脉桥血管; 光学相干断层成像; 应用
随着人口老龄化的加剧及发病率的上升,冠状动脉粥样硬化性心脏病(coronary atherosclerosis disease,CAD)对人类健康的影响越来越大[1]。目前,CAD的治疗策略包括生活方式干预、药物治疗及非药物治疗,非药物治疗包括经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)及冠状动脉旁路移植术(coronary artery bypass grafting,CABG)。除遵循指南推荐外,SYNTAX积分[2,3]也为我们如何选择器械治疗策略提供了依据。对于无保护左主干病变及严重的三支病变,尤其SYNTAX积分大于33分的患者,CABG能明显改善患者预后,降低主要心血管事件的发生。目前,CABG移植物的选择包括乳内动脉、桡动脉、胃网膜动脉、腹壁下动脉等。由于位置表浅、取材方便及有足够的长度作为保证,大隐静脉桥血管(saphenous vein graft,SVG)是目前应用最为广泛的桥血管材料。
但随之而来的SVG再狭窄或闭塞成为心外科及心内科医生关注的重点及难点。CABG术后患者由于涉及心内科及心外科,这种学科上的交叉增加了CABG患者术后管理的难度。研究[4-6]显示,SVG通畅率随时间的延长而降低,10%~25%的SVG在1年内闭塞,术后1~5年内每年闭塞增加1%~2%,术后6~10年每年闭塞增加4%~5%,CABG术后10年只有50%左右的血管通畅。由此可见,接受CABG的患者,尤其是使用大隐静脉作为移植血管的患者,行再次血运重建的概率很大。SVG再狭窄机制的研究对于CABG患者的治疗意义重大。虽然解剖及病理生理学的研究逐渐深入,但SVG粥样硬化形成、再狭窄及闭塞的机制尚不明确。大隐静脉移植入动脉环境后,粥样硬化的形成以及再狭窄发生的机制与原位冠状动脉有无异同尚缺乏相关证据。新的影像学技术的兴起及进展为我们研究SVG再狭窄提供了工具,如血管镜、血管内超声(intravascular ultrasound,IVUS)等。IVUS虽然是临床上最常用的血管内成像技术,但其分辨率尚存在不足。作为新兴的血管内成像技术,光学相干断层成像(optical coherence tomography,OCT)由于其独具的分辨率被称为“光学活检技术”[7]。OCT将光学技术与超敏探测器合为一体,应用现代计算机技术完成即刻图像输出。OCT最早应用于眼科领域,2002年开始应用于心血管领域的研究。第一代OCT称为时域OCT,采用波长为1310 nm的近红外线作为光源,应用光学相干原理完成图像采集,其轴向分辨率可达10~20 μm。在原位冠状动脉中,OCT已经充分展现了其血管内成像的优势,能够准确地分辨斑块及血栓性质,指引冠状动脉支架植入术及术后随访,准确地评估支架贴壁及扩张情况,研究支架内再狭窄及血栓形成。随着时域OCT应用的不断增加,研究者发现其最大的不足在于成像时需在血管近端行球囊阻断,易造成灌注区域心肌缺血的发生,其机械性的阻断易造成血管损伤。由于时域OCT成像导丝为一根质地相对硬且易碎的光导纤维,对于严重迂曲的血管易形成无法通过及成像不清。OCT技术的不断进步,尤其是新一代频域OCT的出现解决了时域OCT应用中的许多不足。频域OCT采用波长1250~1370nm的近红外线作为光源,根据Fourier变换的原理完成即刻的图像输出。其无需阻断及快速成像技术使得OCT应用于SVG的研究成为现实。
SVG移植后在经历理化因素的影响后出现静脉动脉化,随之发生血管退化,随着血管内膜纤维性增生及动脉粥样硬化的进展会出现血管再狭窄及闭塞。
1 SVG原位OCT成像
Brown等[8]使用OCT在CABG术中对SVG血管进行成像分析,由于血管壁成分的不同,SVG与动脉血管的OCT成像区别明显。OCT可以精确地区分桡动脉的内膜、中膜及外膜三层结构。由于内膜弹性的发育不良,SVG在OCT成像为两层结构(如图1[8]所示)。OCT清晰地显示SVG取材后即刻血管夹层形成和血凝块残余,这些被认为是SVG急性血栓形成的原因,而急性血栓形成是导致SVG早期闭塞最主要的原因之一[9,10]。SVG移植成功后,OCT可以观察吻合口情况,决定是否进一步完善。
2 大隐静脉动脉化
静脉桥血管移植后,由于血管剪切力的变化以及生物化学因素的改变,造成静脉血管在结构及功能上发生一系列的改变,这种变化被称为桥血管动脉化(arterialization)[11]。静脉动脉化是血管对环境改变后作出的积极反应,有助于静脉适应动脉环境剪切力及血管张力的改变。目前,静脉动脉化的确切机制尚不明确,有研究推测,其类似于动脉损伤后“新生内膜增生”的过程。在静脉环境中,内皮细胞(endothelial cell,EC)和平滑肌细胞(smooth muscle cell,SMC)是构成静脉壁的主要细胞成分。EC维持静脉的完整性及基本功能,通过产生PGI2、NO预防血小板黏附、聚集,在SVG新生内膜生成的初始阶段发挥重要作用[12,13]。SMC在持续静脉血管壁内环境的稳态方面也起了重要作用。桥血管“新生内膜增生”最后阶段主要是由于SMC迁移及增殖形成的[14]。Wong等[15]报道了第一例OCT用于桥血管动脉化观察的病例。图2[15]显示,早期动脉化的表现为纤维内膜增生、中膜肥厚及脂质沉积(模仿动脉弹性外膜成分)。与原位冠状动脉血管的OCT成像相比,SVG早期动脉化三层结构并非十分清晰,尤其是外膜与中膜的分界不明显,这种表现可能与静脉血管本身的结构相关。
3 大隐静脉桥血管退化
冠状动脉造影上桥血管退化表现为内膜不规整或者管腔扩张大于参照管腔的50%。IVUS早期SVG退化的特点为弥漫、同轴性的粥样硬化改变[16,17]。OCT显示严重的SVG退化图像特点为[18]:碎片状表现,疏松地黏附于静脉血管壁,无明显的纤维膜形成(图3[18])。虽然在移植后经受相似的血管剪切力等影响,但原位冠状动脉内并未出现相应的改变。OCT图像上的改变与冠状动脉造影所示的桥血管退化相一致。
4 大隐静脉桥血管狭窄及闭塞
CABG术后1个月内,SVG发生再狭窄及闭塞称为早期病变;1年以上发生称为晚期病变;1个月到1年之间称为中期病变。早期SVG闭塞多数为急性血栓形成所致,占15%~18%[19]。其可能的原因为血管取材及吻合口操作失误及血液流变学改变所致。中期SVG闭塞主要的原因为血管内膜纤维增生所致,血小板和活化的巨噬细胞是内膜增生形成的关键。晚期SVG狭窄及闭塞主要是由于粥样硬化形成所致,粥样硬化斑块在静脉中移行可形成弥散、向心、缺少纤维帽的斑块。由于斑块缺乏纤维帽,SVG粥样斑块更易于破裂[20]。
在原位冠状动脉血管内,OCT可以清晰地显示血栓形成和血栓成分、内膜增生及斑块破裂等。图4[18]、图5[18]显示,OCT可以清晰地显示SVG内红色血栓、白色血栓、斑块破裂及胆固醇结晶等。血栓的OCT成像与原位血管相同,红色血栓由于其富含红细胞,造成强衰减,表现为较大的背散射区。胆固醇结晶的OCT图像特点为:斑块内方向一致的、线状高反射结构。同时OCT发现了SVG所特有的粥样硬化改变。与原位冠状动脉粥样硬化相比,SVG粥样硬化斑块更大且常常伴随着血管瘤样扩张(图4[18])。如图4c所示,在破裂的斑块周围常发现巨孔,这种改变究竟是冠状动脉发现的新生血管还是与斑块破裂相关尚不明确。OCT于原位冠状动脉内亦发现相似的“微血管”结构,尤其见于支架内再狭窄组织及糖尿病患者的冠状动脉内[21]。
还有一种狭窄是SVG所特有的[22],即静脉瓣造成的狭窄(图6[22])。患者12年前造影未见明显狭窄,后复查造影示桥血管狭窄,OCT成像显示造成狭窄的“元凶”为静脉瓣,且OCT三维重建显示静脉瓣逆血流方向,这些改变可能造成了最终桥血管狭窄。
5 SVG再狭窄的治疗
一旦SVG出现再狭窄或者闭塞并且患者出现相应的临床表现时,需要再次血管重建,由于再次行CABG患者常常难以接受,以及手术风险和预后的影响,PCI成为首选的再血管化治疗策略。SVG粥样硬化病变一般伴有较大的、疏松的斑块,且斑块中包含坏死组织碎片、胆固醇结晶并常伴有明显的血栓附着,闭塞的桥血管病变常累及病变较长[23],因此SVG介入与原位冠状动脉相比手术难度大、风险高。组织病理学研究显示,SVG病变具有以下特点:①中膜层与自身血管相比非常薄弱,在支架植入过程容易因为机械作用发生撕裂,中膜的破坏常会引发严重的内膜增生。②SVG管腔大、管壁薄、缺乏弹性,因此SVG血流较原位冠状动脉慢,缓慢的血流常造成血小板聚集及血栓形成。这些特点是SVG支架植入术后支架内再狭窄的发生机制之一。且如前所述,SVG病变组织常较松软,这些松软的组织容易透过支架网眼突入管腔,造成支架内再狭窄。原位冠状动脉支架植入术后富含脂质的新生粥样硬化被认为是远期支架预后不良的机制之一[24-26]。OCT能够清晰地显示SVG药物洗脱支架植入术后支架内新生粥样硬化形成,OCT显示富含脂质斑块、钙化形成、巨噬细胞侵蚀及薄纤维帽斑块破裂,与原位冠状动脉病变接近[27]。图 7[28]示SVG内晚期支架呈“蜂房样”改变。与SVG支架内再狭窄的形态学结构不同,原位冠状动脉内支架再狭窄表现为“花瓣样”改变[29],这些改变被认为与血管的正性重构相关。
发生支架内再狭窄,再次行支架植入术仍是首选的治疗策略。OCT指引下行PCI在原位冠状动脉介入治疗已广泛应用。Lee等[30]报道了一例OCT指引下于右冠状动脉SVG内再狭窄的支架内植入2枚支架的病例。OCT准确地评估了再狭窄组织的性质并指导切割球囊型号及所需支架型号。
6 OCT应用于SVG成像的局限性
目前临床应用较多的OCT系统为时域OCT,即新的C7系统。C7系统无需球囊阻断,快速回撤成像,使SVG成像更加安全。由于C7系统使用专用的成像导管,其质地较脆且硬,通过严重迂曲的SVG有一定难度,由于成像导管质硬,存在导管通过相对弥散且缺少纤维帽的SVG病变时造成血管损伤的可能;SVG退化后呈瘤样扩张改变,扩张后的SVG直径明显增加,OCT能否清晰成像尚需进一步验证。
但通过上述我们可以得出结论,OCT可以于SVG清晰、安全成像,显示即刻取材后血管的损伤,将手术相关的损伤最小化,同时观察CABG即刻吻合口情况,从而指导CABG手术的进行,保证手术效果。OCT可以清晰地显示SVG粥样硬化特点、再狭窄及闭塞的特点,并能发现许多SVG所特有的改变,这些改变对于我们研究SVG粥样硬化的形成及进展意义重大。同时,SVG再狭窄或闭塞后的PCI策略究竟与原位冠状动脉存在多大的差别目前尚无定论,只有深入研究SVG再狭窄的特点,才能更加准确地选择是否需要支架治疗、选择预扩张球囊是否必要、确定支架型号如何选取等。相信随着OCT技术的进步及临床应用的增加,未来OCT可更多地应用于指导CABG手术进行、SVG粥样硬化研究、再狭窄SVG介入治疗及术后随访等领域。
自1960年5月2日Goetz医生完成了世界上第一例冠状动脉搭桥术到现在,CABG术已有50余年的历史。CABG成功挽救了无数严重冠心病患者的生命。目前CABG术后患者的管理已成为心内科难题,尤其是发生桥血管狭窄或闭塞的患者。SVG再狭窄及闭塞的机制尚不清楚,造影所示的桥血管改变与患者临床事件的相关性尚不明确。OCT为我们研究桥血管病变提供了强有力的支持。
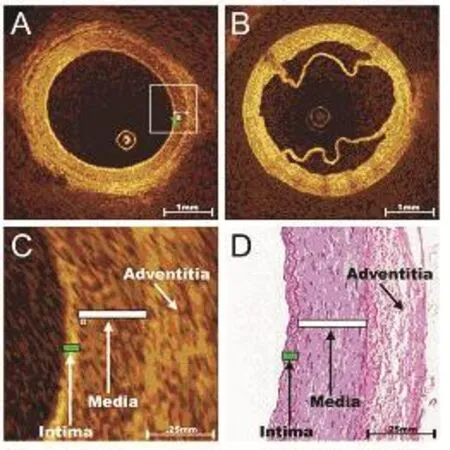
图1 SVG即刻成像

图2 SVG早期动脉硬化
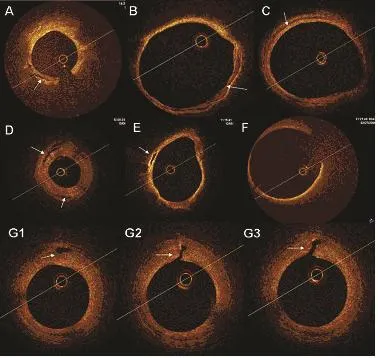
图3 SVG退化的OCT图像
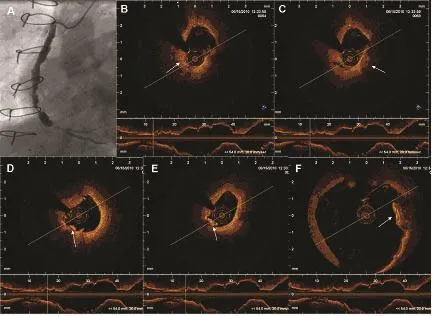
图4 SVG狭窄伴血栓形成
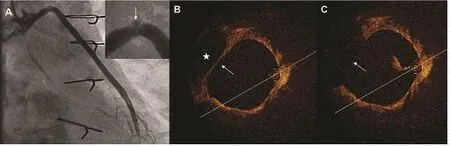
图5 SVG内斑块破裂
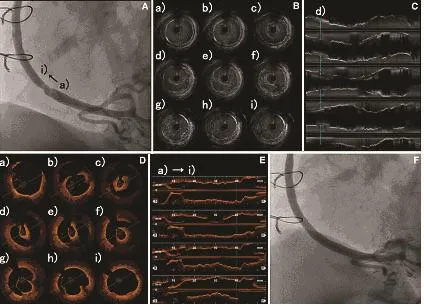
图6 静脉瓣致SVG狭窄
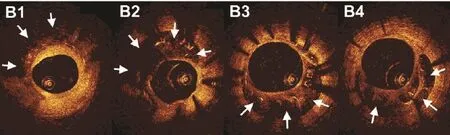
图7 SVG支架内再狭窄
[1]胡宾,周玉杰,史冬梅,等.三种代谢综合征工作定义在冠心病患者中应用的比较.中国医药,2014,9:14-17.
[2]Hillis LD,Smith PK,Anderson JL,et al.2011ACC/AHA Guideline for Coronary Artery Bypass Graft Surgery.A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation,2011,124:e653-735.
[3]Ong AT,Serrryus PW,Mohr FW,et al.The synergy between percutaneous coronary intervention with TAXUS and cardiac surgery(SYNTAX)study:design,rationale,and run-in phase. Am Heart J,2006,151:1194-1204.
[4]FitzGibbon GM,Kafka HP,Leach AJ,et al.Coronary bypass graft fate and patient outcome:angiographic follow-up of 5065 grafts related to survival and reoperation in 1388 patients during 25 years.J Am Coll Cardiol,1996,28:616-626.
[5]Chesebro JH,Fluster V,Elveback LR,et al.Effect of dipyridamole and asprin on late vein graft patency after coronary bypass operations.N Engl J Med,1984,310:209-214.
[6]Bourassa MG,Fisher LD,Campeau L,et al.Long-term fate of bypass grafts:the Coronary Artery Surgery Study(CASS)and Montreal Heart Institute experiences.Circulation,1985,72:V71-78.
[7]高鹏,陈步星.频域光学相干断层成像应用进展.中国心血管病研究,2011,9:868-870.
[8]Brown EN,Burris NS,Gu J,et al.Thinking inside the graft:Applications of optical coherence tomography in coronary artery bypass grafting.J Biomed Opt,2007,12:051704.
[9]Brown EN,Kon ZN,Tran R,et al.Strategies to reduce intraluminal clot formation in endoscopically harvested saphenous veins. J Thorac Cardiovasc Surg,2007,134:1259-1265.
[10]Parang P,Arora R.Coronary vein graft disease:Pathogenesis and prevention.Can J Cardiol,2009,25:e57-62.
[11] Kwei S,Stavarkis G,Takahas M,et al.Early adaptive responses of the vascular wall during venous arterialization in mice.Am J Pathol,2004,164:81-89.
[12]Radomski MW,Palmer RM,Moncada S.The anti-aggregating properties of vascular endothelium: interactions between prostacyclin and nitric oxide.Br J Pharmacol,1987,92:639-646.
[13]Radomski MW,Palmer RM,Moncada S.Endogenous nitric oxide inhibits human platelet adhesion to vascular endothelium. Lancet,1987,2:1057-1058.
[14]Mitra AK,Gangahar DM,Agrawal DK.Cellular,molecular and immunological mechanisms in the pathophysiology of vein graft intimal hyperplasia.Immunol Cell Biol,2006,84:115-124.
[15]Wong DT,Soh SY,Meredith IT,et al.Saphenous vein graft arterialization assessed by optical coherence tomography.Int J Cardiol,2013,167:e121-122.
[16]Kobayashi T,Makuuchi H,Naruse Y,et al.Assessment of saphenousvein graftwallchatacteristicswith intravascular ultrasound imaging.Jpn J Thorac Cardiovasc Surg,1998,46:701-706.
[17]Hong M,Mintz GS,Hong MK,et al.Intravascular ultrasound assessment of the presence of vascular remodeling in diseased human saphenous bypass grafts.Am J Cardiol,1999,84:992-998.
[18]Davlouros P,Damelou A,Karantails V,et al.Evaluation of culprit saphenous vein graft lesions with optical coherence tomography in patients with acute coronary syndromes.JACC,2011,6:683-693.
[19]Parang P,Arora R.Coronary vein graft disease:pathogenesis and prevention.Can J Cardiol,2009,25:e57-62.
[20]Motwani JG,Topol EJ.Aortocoronary saphenous vein graft disease:pathogenesis,predisposition and prevention.Circulation,1998,97:916-931.
[21]Gonzalo N,Serruys PW,Okamura T,et al.Optical coherence tomography patterns of stent restenosis.Am Heart J,2009,158:284-293.
[22]Koeda Y,Itoh T,Fusazaki T,et al.A unique stenosis in saphenous vein graft visualized by optical coherence tomography. Heart Vessels,2014,29:278-281.
[23]Dascenzo F,Gonella A,Longo G,et al.Short and long-term outcomes of percutaneous revascularization in patients with prior coronary artery bypass graft.Minerva Cardioangiol,2010,58:291-299.
[24]Nakazawa G,Otsuka F,Nakano M,et al.The pathology of neoatherosclerosis in human coronary implants bate-metal and drug-eluting stents.J Coll Cardiol,2011,57:1314-1322.
[25]Yonetsu T,Kato K,Kim SJ,et al.Predictors for neoatherosclerosis:a retrospective observational study from the optical coherence tomography registry.Cardiovasc Imaging,2012,5:660-666.
[26]Lee SY,Shin DH,Mintz GS,et al.Optical coherence tomography-based evaluation of in-stent neoatherosclerosis in lesions with more than 50%neointimal cross-sectional area stenosis. EuroIntervention,2013,9:945-951.
[27]Ybarra LF,Weisz G,Rached FH,et al.Saphenous vein graft in-stent neoatherosclerosis by optical coherence tomography. Can J Cardiol,2014,30:1462e15-1462e16.
[28]Koga S,Ikeda S,Maemura K.Honeycomb-like neointima of sirolimus-eluting stent in saphenous vein graft:insight from OCT and IVUS.Int J Cardiol,2014,172:522-523.
[29]Yamaguchi H,Arikawa R,Takaoka J,et al.Association of morphologic characteristics on optical coherence tomography and angiographic progression patterrns of late restenosis after drug-eluting stent implantation.Cardiocasc Revasc Med,2015,16:32-35.
[30]Lee R,Antoniades C,Adlam D,et al.Treatment of recurrent vein graft“stent-in-stent”re-stenosis guided by optical coherence tomography.Int J Cardiol,2012,156:e20-21.
Application of OCT in the field of saphenous vein graft
Saphenous vein graft; OCT; Application
300457 天津市,泰达国际心血管病医院心血管内科
林文华,E-mail:linwernhua@sina.com
10.3969/j.issn.1672-5301.2016.04.005
R543.6
A
1672-5301(2016)04-0305-04
2015-10-29)
