主动脉夹层合并下肢灌注不良临床治疗分析
2016-09-11孙磊吴海卫许飚王常田张雷李德闽
孙磊 吴海卫 许飚 王常田 张雷 李德闽
主动脉夹层合并下肢灌注不良临床治疗分析
孙磊 吴海卫 许飚 王常田 张雷 李德闽
作者单位:210002 江苏省南京市,南京军区南京总医院心胸外科
目的 总结主动脉夹层合并下肢灌注不良的治疗经验。方法 南京军区南京总医院2010年1月至2015年5月收治伴有下肢灌注不良的主动脉夹层患者13例,回顾分析其治疗方法及近中期随访结果。结果 所有患者均接受手术。7例B型夹层患者行胸主动脉腔内修复术(TEVAR),其中4例植入裸支架;6例支架释放后造影见原发破口隔绝,真腔扩张,受累髂动脉显影良好,1例术后右下肢缺血坏死行截肢术,后因多器官功能衰竭死亡。6例A型夹层患者,2例术前评估下肢缺血症状明显,急诊行内膜开窗恢复髂动脉血流,二期行杂交手术;其余4例一期行升主动脉、主动脉弓置换+降主动脉覆膜支架植入术,术后造影见下肢动脉恢复真腔供血。术后患者存活12例,下肢缺血症状明显缓解。所有患者均获随访,患者无胸背部剧痛及下肢缺血表现,髂动脉显影良好。结论 主动脉夹层合并下肢灌注不良应尽早干预,主动脉腔内修复术可消除原发破口,恢复真腔血流,改善大部分患者的缺血症状。
主动脉夹层;下肢;缺血;腔内修复术
主动脉夹层是一种病情凶险、死亡率高的急性主动脉疾病,当夹层累及髂、股动脉时可出现下肢疼痛、麻木、无脉等灌注不良的表现,临床上易误漏诊。采用腔内修复、人造血管置换、内膜开窗等方法法可恢复下肢动脉的血运,从而改善灌注不良的症状[1]。本研究通过回顾分析我院13例合并下肢灌注不良的主动脉夹层患者的临床表现及治疗方法,旨在为其治疗策略提供借鉴。
1 资料与方法
1.1 一般资料 我院2010年1月至2015年5月共收治13例合并下肢灌注不良的主动脉夹层患者,其中男性 10 例、女性 3 例,年龄 36~73(51.3±14.7)岁。Stanford A型主动脉夹层6例,Stanford B型主动脉夹层7例。发病时间2周以内12例,2周以上1例;伴有高血压病史10例。11例患者有胸背部、腰腹部剧烈疼痛的典型表现,2例患者首发症状仅为急性下肢缺血疼痛。所有患者均经主动脉CT血管造影(CT angiography,CTA)确诊。
1.2 治疗方法 患者经确诊后立即予平卧位制动,严格控制血压、心率及缓解疼痛。根据术前CTA了解夹层累及的范围、破口位置及髂动脉等分支血管的堵塞情况,制订具体手术方案。所有手术在我院复合手术室完成。对于B型主动脉夹层患者,予数字减影血管造影(digital subtraction angiography,DSA)行降主动脉覆膜支架植入术封堵近端第一破口。如降主动脉远端真腔受假腔压迫明显狭窄,可于覆膜支架远端预先植入裸支架;如原发破口位于左锁骨下动脉,锚定区不足,于TEVAR前先行主动脉弓分支血管旁路重建,支架植入后再次造影评估髂动脉情况。对于A型主动脉夹层患者行杂交手术,先于体外循环下行升主动脉+主动脉弓置换,然后在DSA下经股动脉逆行植入覆膜血管支架行腔内修复。对于术前评估髂股动脉堵塞严重、下肢缺血症状明显者,先急诊行内膜开窗术重建血运,待下肢缺血改善、病情稳定后二期行杂交手术。术后1、3、6个月,1年及以后每年患者行主动脉CTA检查随访。
2 结果
本组患者均接受CTA检查,其中动力型堵塞10例、静力型堵塞3例。所有患者均接受手术治疗。7例B型主动脉夹层患者于DSA下行TEVAR术,植入覆膜血管支架7枚,包括Valiant(Medtronic,美国)支架 2枚、Hercules(Microport,中国)支架4枚、Ankura(Lifetech,中国)1枚;4例患者植入裸支架Sinus-XL(Optimed,德国)4枚。1例因锚定区不足行左颈总动脉-左锁骨下动脉旁路术。6例患者支架释放后再次造影见夹层动脉瘤完全隔绝,近段假腔内未显影,远端真腔扩张,受累髂动脉显影良好(图1、2)。1例造影见右侧髂总动脉延迟显影,可触及足背动脉搏动,右下肢皮温改善,但术后因缺血再灌注损伤致急性肾衰竭,行CRRT治疗,且出现骨筋膜室综合征,右下肢缺血坏死,复查CTA提示右髂外动脉假腔血栓形成,真腔闭塞,行右大腿中下段截肢术,后因多器官衰竭死亡。本组6例A型主动脉夹层患者,2例因术前评估下肢缺血症状明显,急诊行内膜开窗术,开窗后髂动脉搏动恢复,待下肢缺血明显改善后二期行杂交手术;其余4例均一期行升主动脉、主动脉弓置换+降主动脉覆膜支架植入术,共植入Valiant(Medtronic,美国)支架 3 枚、Hercules(Microport,中国)支架 3 枚、裸支架Sinus-XL stent(Optimed,德国)4枚。术后造影见下肢动脉恢复真腔供血。
术后患者存活12例,下肢缺血症状明显缓解,恢复良好出院。1例截肢患者死亡。出院后随访时间3个月至5年,随访12例,所有患者均存活,无胸背部剧烈疼痛及下肢疼痛、麻木等缺血表现。复查主动脉CTA示支架位置形态良好,无移位、变形及明显内漏发生,假腔内血栓形成,受累髂动脉真腔显影良好。见图3。
3 讨论
主动脉夹层是指血液通过主动脉的内膜破口进入管壁从而造成其分离,大多数患者表现为典型的胸背部撕裂样剧痛,累及重要分支血管时可导致相应脏器缺血,如累及髂、股动脉可出现疼痛、感觉异常、无力、皮温下降及脉搏消失或减弱等下肢灌注不良的表现[2]。近年来的病例统计发现约12.7%的Stanford A型夹层患者伴有下肢灌注不良[3],Stanford B型夹层患者中占5%~12%,且下肢缺血易同时合并内脏或肾动脉等其他器官灌注不良,其病死率明显提高[4]。由于末梢缺血的症状易被主动脉夹层本身症状掩盖,或者部分患者以下肢缺血为主诉就诊,易被误诊为动脉栓塞,临床上合并下肢灌注不良的患者漏诊、误诊并不少见。本组患者有2例仅有下肢缺血症状,在外院误诊为动脉栓塞,来我院确诊为主动脉夹层时其中1例已经出现下肢缺血坏死。
主动脉夹层引起分支血管灌注不良包含动力型和静力型的双重机制[5-7],其中约80%为动力型堵塞[8]。动力型堵塞是指由于分支血管近端或开口周围主动脉真腔明显狭窄或真腔塌陷导致分支血管血流减少,分支血管完全由真腔供血,解剖上仍然保持完整。静力型堵塞指主动脉夹层剥离至分支动脉开口,或向分支动脉腔内继续剥离,有时伴有分支动脉内膜撕裂甚至完全断裂,致使分支动脉开口血肿压迫或分支夹层形成,阻碍脏器供血,包括分支血管完全由真腔供血、分支血管双腔供血、完全假腔供血三种类型。术前明确下肢血管受累的机制对于制订有效的治疗方案尤为关键。主动脉CTA、血管造影、经食管超声心动图、血管内超声等可确定夹层的类型及破口位置,辨认真假腔及伴有灌注不良的动脉情况,明确血管堵塞的机制。血管内超声对于判断分支血管受累准确性非常高,但价格昂贵,且为有创性检查,因此我们认为CTA更适合术前评估伴有灌注不良的主动脉夹层分支血管情况。
对于合并下肢灌注不良的主动脉夹层,治疗的主要目标是尽可能地恢复下肢灌注[4]。腔内修复、人造血管置换、旁路重建、开窗技术、球囊血管成形、分支血管支架植入是主要的治疗选择[9,10]。对于动力型堵塞,消除原发内膜破口,恢复真腔血流,扩张真腔,可使下肢缺血症状得到改善。如果下肢缺血,仍可行外科旁路重建术。如果是静力型堵塞,真腔供血和双腔供血型原发破口消除后真腔扩大,多数分支动脉血供会随之得到改善,如果分支动脉有血栓形成可能需行分支动脉支架植入或溶栓;而假腔供血型则应行开窗技术、球囊血管成形等穿透内膜,重建受压真腔内的血流。TEVAR手术对于下肢灌注不良的B型主动脉夹层患者是很好的选择。使用覆膜支架隔绝近端破口后大部分的下肢动脉灌注可以得到明显改善,对于少部分静力型病例,支架释放后再次造影评估髂动脉情况,决定是否行进一步治疗。本组患者中动力型堵塞10例,静力型堵塞3例,术后DSA造影仅有1例髂动脉延迟显影,其余受累髂动脉均显影良好。因此,无论对于动力型还是静力型,覆膜支架植入都可改善大部分分支血管的灌注。
目前孙氏手术是国内复杂型A型主动脉夹层外科治疗的标准[11],支架象鼻直视下顺行植入降主动脉后能封闭内膜破口、扩大真腔,使假腔血栓化和重塑主动脉壁。然而对于伴有下肢灌注不良的患者,我们借鉴B型夹层TEVAR手术的经验,先外科手术完成根部替换及弓部血管重建,再于DSA介入下逆行植入覆膜支架行腔内修复术,既可以避免深低温停循环,又可以于支架释放后再次造影评估髂动脉情况,如髂动脉仍闭塞可行分支血管支架植入等处理改善下肢血供。对于术前评估下肢缺血症状明显且原发破口位于升主动脉的A型夹层,考虑一期手术创伤大、手术时间长,为尽早恢复下肢真腔血流,我们先行内膜开窗,使真假腔压力平衡,改善下肢供血,再二期行杂交手术,2例患者均获得满意疗效。
由于大部分下肢灌注不良患者胸主动脉远端真腔明显狭窄,Canaud等[12]总结分析了108例主动脉夹层治疗经验认为,覆膜支架联合远端裸支架可明显改善真腔供血,扩大管径。对于术前评估降主动脉真腔狭窄严重者,本组中有8例使用了覆膜支架联合远端裸支架进行腔内治疗,结果证实真腔开放理想,远端髂动脉血流恢复。
本组1例死亡患者术前因右下肢已缺血坏死,虽行TEVAR手术恢复了真腔血流,但因缺血再灌注损伤导致急性肾衰竭,最后进展成多器官功能衰竭。因此,如果靶器官缺血时间过长,已经出现下肢缺血坏死等不可逆改变,即使恢复灌注,肢体功能也难以恢复甚至出现缺血再灌注损伤,对于此类病例建议一期行截肢手术。
主动脉夹层合并下肢灌注不良并不少见,一旦确诊应尽早进行干预,术前应密切观察下肢缺血的病情进展,准确评估分支血管的受累情况。对于伴有下肢灌注不良的B型夹层,TEVAR术可隔绝原发破口,恢复真腔血流,改善大部分患者的下肢缺血症状。对于A型夹层,杂交手术也不失为一种可行的办法。由于本组例数有限,随访时间较短,远期疗效有待进一步观察。
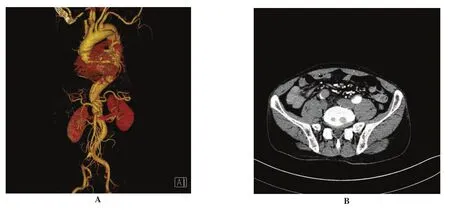
图1 术前CTA示B型主动脉夹层,右髂总动脉起始部真腔明显狭窄
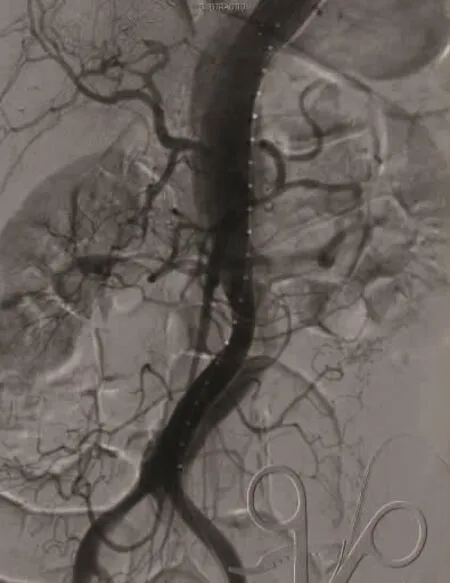
图2 术中DSA造影示右髂动脉显影良好

图3 术后CTA示支架位置良好,无内漏,右髂动脉通畅
[1]丁旭,陈丽娟,金春杰,等.主动脉夹层的临床特征及治疗进展.中国医药,2012,7:247-249.
[2]White RA,Miller DC,Criado FJ,et al.Report on the results of thoracic endovascular aortic repair for acute,complicated,type B aortic dissection at 30 days and 1 year from a multidisciplinary subcommittee of the Society for Vascular Surgery Outcomes Committee.Vasc Surg,2011,53:1082-1090.
[3]Geirsson A,Szeto WY,Pochettino A,et al.Significance of malperfusion syndromes prior to contemporary surgical repair for acute type A dissection:outcomes and need for additional revascularizations.Eur J Cardiothorac Surg,2007,32:255-262.
[4]Gargiulo M,Bianchini Massoni C,Gallitto E,et al.Lower limb malperfusion in type B aortic dissection:a systematic review.Ann Cardiothorac Surg,2014,3:351-367.
[5]O′Donnell S,Geotchues A,Beavers F,et al.Endovascular management of acute aortic dissections.J VascSurg,2011,54:1283-1289.
[6]Greenberg R,Khwaja J,Haulon S,et al.Aortic dissections:new perspectives and treatment paradigms.Eur J Vasc EndovascSurg,2003,26:579-586.
[7]Sfyroeras GS,Rubio V,Pagan P,et al.Endovascular management of malperfusion in acute type B aortic dissections.J Endovasc Ther,2011,18:78-86.
[8]Willianls DM,Lee DY,Hamilton BH,et al.The dissected aorta:partⅢ.Anatomy and radiologic diagnosis of branch-vessel compromise.Radiology,1997,203:37-44.
[9]van Bogerijen GHW,Williams DM,Patel HJ.TEVAR for complicated acute type B dissection with malperfusion.Ann Cardiothorac Surg,2014,3:423-427.
[10]Uchida N,Shibamura H,Katayama A,et al.Surgical strategies for organ malperfusions in acutetypeB aorticdissection.Interact Cardiovasc Thorac Surg,2009,8:75-78.
[11]朱俊明,孙立忠,赵海鹏,等.孙氏手术在复杂主动脉夹层中的应用.中华胸心血管外科杂志,2013,29:581-584.
[12]Canaud L,Patterson BO,Peach G,et al.Systematic review of outcomes of combined proximal stent grafting with distal bare stenting for management of aortic dissection.J Thorac Cardiovasc Surg,2013,145:1431-1438.
Clinical analysis of aortic dissection with lower limb malperfusion
SUN Lei,WU Hai-wei,XU Biao,et al.Department of Cardiothoracic Surgery,Nanjing General Hospital of Nanjing Military Command,Nanjing 210002,China
LI De-min,E-mail:dr.demin@126.com
Objective To explore the treatment experience of aortic dissection with lower limb malperfusion.Methods 13 patients with aortic dissection complicated by lower limb malperfusion were the subjects,who were admitted to our institution From Jan 2010 to May 2015.The short and midterm follow-up results and managements were retrospectively reviewed.Results All patients underwent surgery.There were 7 patients with Stanford type B aortic dissection
thoracic endovascular aortic repair(TEVAR),4 patients needed additional bare stenting.Among them,malperfusion of the iliac artery was improved in 6 cases after closure of the primary entry tear.Another patient died due to multiple organ failure who was performed amputation after the right lower limb ischemic necrosis.In the type A aortic dissection group,emergent fenestration was performed to restore blood flow of the iliac artery in 2 cases who had serious ischemic symptoms.The remaining 4 patients received the treatment by hybrid procedure which consisted of ascending aorta replacement,aorta arch branch vascular bypass reconstruction and TEVAR.A total of 13 cases were followed up,12 patients survived without severe chest pain and lower limb ischemia.CT angiography showed unobstructed blood flow of the iliac artery.Conclusion Lower limb malperfusion syndrome is associated with high mortality and should be intervened as soon as possible.Endovascular aortic repair can improve the ischemic symptoms in most patients by covering the proximal entry tear and recovery perfusion of the lower limbs.
Aortic dissection;Lower extremity;Ischemia;Endovascular repair
李德闽,E-mail:dr.demin@126.com
10.3969/j.issn.1672-5301.2016.03.010
R654.2
B
1672-5301(2016)03-0225-04
2015-10-18)
