不同采收成熟度和降温方式对鸭梨POD活性及果心褐变的影响
2016-09-10韩艳文廉双秋韩云云李晓丹闫师杰
韩艳文,廉双秋,韩云云,李晓丹,闫师杰,4,*
(1.天津农学院园艺园林学院,天津 300384;2.北京正大果业有限公司,北京 101206;3.天津农学院食品科学与生物工程学院,天津 300384;4.天津市农副产品深加工技术工程中心,天津 300384)
不同采收成熟度和降温方式对鸭梨POD活性及果心褐变的影响
韩艳文1,廉双秋2,韩云云1,李晓丹3,闫师杰3,4,*
(1.天津农学院园艺园林学院,天津 300384;2.北京正大果业有限公司,北京 101206;3.天津农学院食品科学与生物工程学院,天津 300384;4.天津市农副产品深加工技术工程中心,天津 300384)
通过对早、中、晚3种不同采收成熟度的鸭梨果实分别采用急速与缓慢降温处理,并对鸭梨贮藏过程中果心褐变指数、果心过氧化物酶(POD)活性及同工酶活性等指标进行测定,结果表明:缓慢降温处理鸭梨果心的POD同工酶活性比同时期采摘的急速降温处理的鸭梨POD活性高,这与鸭梨果心褐变指数的变化趋势相反,说明POD同工酶与鸭梨果心褐变密切相关;缓慢降温贮藏鸭梨能有效抑制褐变。同时,中采鸭梨的POD同工酶活性最高,早采次之,晚采最低,说明成熟度也是影响鸭梨果心褐变的重要因素。缓慢降温结合中采鸭梨可以有效抑制鸭梨果心的褐变。
鸭梨,果心,褐变,POD同工酶
鸭梨(PyrusbretschneideriRehd cv. Yali),原产于中国,是中国白梨品系的主栽品种,但鸭梨储运、贮藏过程中经常伴随褐变现象,严重影响鸭梨的品质[1]。因此,研究果实褐变机理,减缓褐变发生,对鸭梨保鲜具有一定的意义。鸭梨褐变首先表现在果心局部变褐,然后褐变程度逐步增强,使整个果心、果肉都发生变褐[2]。鸭梨褐变主要是酶促褐变,一般认为,果实中的多酚氧化酶(PPO)是引起果实酶促褐变的主要酶类[3],而过氧化物酶(POD)是植物逆境环境下体内酶促防御系统中一个重要的酶,它能将细胞中H2O2还原成H2O,从而清除果实中的自由基,进而减轻果实褐变[4]。同时,POD又是果蔬成熟和衰老的一个指标,若能较好地维持POD的活性可以有效延缓翠冠梨的衰老[5]。同工酶是基因的直接产物,具有明显的种属、组织和发育阶段特异性,植物体内的许多生理过程及植物的不同发育时间,环境条件的变化常与同工酶的种类及活性有关[6]。有研究显示苹果的POD酶活性与其同工酶分析,发现POD活性与同工酶谱的活性表达一致[6]。国内外对于一些外源处理调节POD及同工酶活性对果实褐变情况影响方面的研究较多。1-MCP处理可诱导果实POD活性,对延缓西洋梨果实的衰老有很好的效果[7]。短波紫外线对木薯[8]和龙眼[9]进行照射处理以及1-MCP对无核寒香蜜葡萄[10]进行采前处理都可以维持POD活性在较高的水平,保持果实的贮藏品质,推迟果实的成熟软化过程。但是不同成熟度结合两种降温方式对POD及同工酶活性与鸭梨果心褐变的影响还鲜有报道,本文拟对此进行研究,为延长鸭梨的贮藏品质提供理论依据。
1 材料与方法
1.1材料与仪器
套袋鸭梨(PyrusbretschneideriRehd cv. Yali)采自河北省深州,早、中和晚采分别于2014年9月6日、9月16日和9月26日,采摘后挑选(230±5) g大小、无机械伤、无病虫害的果实,套网套装入纸箱中运抵天津农学院冷库;微孔膜大小85×70 cm、厚度0.05~0.06 mm、孔径15~20 μm,由国家农产品保鲜工程技术研究中心(天津)生产。
HERMLE Z323K高速冷冻离心机德国Hermle(哈默)公司;XH-D漩涡振荡器江苏天翎仪器有限公司;超低温冰箱 Thermo Scientific Forma-86 ℃ ULTThermo Fisher Scientific;伯乐基础电泳电源Biorad Powerpac Basic 041BR81404上海珂淮仪器有限公司;Biorad Mini-PROTEAN Tetra Cell电泳槽上海珂淮仪器有限公司;UV-1800 240V 岛津紫外分光光度法岛津公司。
1.2实验方法
1.2.1预处理鸭梨进行挑选后装入内衬微孔膜的专用包装纸箱中[11],每箱50个鸭梨,共6个处理:早采+急降温处理(早急)、早采+缓降温处理(早缓)、中采+急降温处理(中急)、中采+缓降温处理(中缓)、晚采+急降温处理(晚急)、晚采+缓降温处理(晚缓)。缓降温处理的鸭梨放入12 ℃冷库中,每5 d降2 ℃,30 d将温度降至(0±1) ℃,然后在此温度下贮藏;急降温处理的鸭梨直接放入(0±1) ℃冷库中贮藏。每20 d取样进行指标测定,每次随机选取20个鸭梨果实,沿果心线外侧分开果心,迅速将果心切成块状的样品用液氮急冻,然后置于-70 ℃下保存[12]。
1.2.2鸭梨果心褐变指数的测定将鸭梨果实沿中心部位横切,根据果实横切面果心组织的褐变程度和面积划分为4个褐变级别。0级:无褐变;1级:轻微褐变(果心个别心皮内壁有褐斑);2级:轻微至20%褐变(1~2个果心室褐变);3级:褐变面积在20%~50%之间;4级:褐变面积大于50%。每个处理随机选取30个鸭梨果实进行统计,按下面公式计算:
1.2.3鸭梨果心POD活性及POD同工酶的测定
1.2.3.1POD酶活测定愈创木酚法,参考王伟玲[13]的方法,略有改动。
POD粗酶液的提取:称取果心冻样3.0 g放入研钵中,加入1 mL已预冷的0.05 mol/L磷酸缓冲液(pH8.0)中,充分研磨,再加入9 mL提取液,全部转移到10 mL的离心管中,漩涡震荡混匀。4 ℃下12000×g离心10 min,上清液即为POD粗酶提取液,立即测定酶活。
POD酶活反应体系为:pH8.0的磷酸缓冲液2.2 mL、H2O2(0.46%)0.1 mL,愈创木酚(2%)0.2 mL和酶液0.5 mL。将2.5 mL反应混合液静置于25 ℃恒温水浴中10 min,酶液加入混合液后自动反应3 min,测定470 nm处OD值,每30 s读数记录OD值变化。空白为以0.5 mL pH8.0的磷酸缓冲液替代POD酶液,其余同反应体系。酶活计算:1个活性单位U为每分钟内OD值变化0.01,每个样品重复测3次,用U/min·g表示酶活性。
1.2.3.2POD同工酶的测定POD同工酶测定采用聚丙烯酰胺凝胶电泳(PAGE),方法参见李学强等[14],并加以改进。凝胶浓度分别为:浓缩胶浓度为5%,分离胶浓度为8%,其浓缩胶与分离胶配比见表1。上样量为20 μL,当前沿指示剂迁移到距离凝胶底部约0.5 cm处,停止电泳。用醋酸联苯胺溶液(现用现配)进行染色。
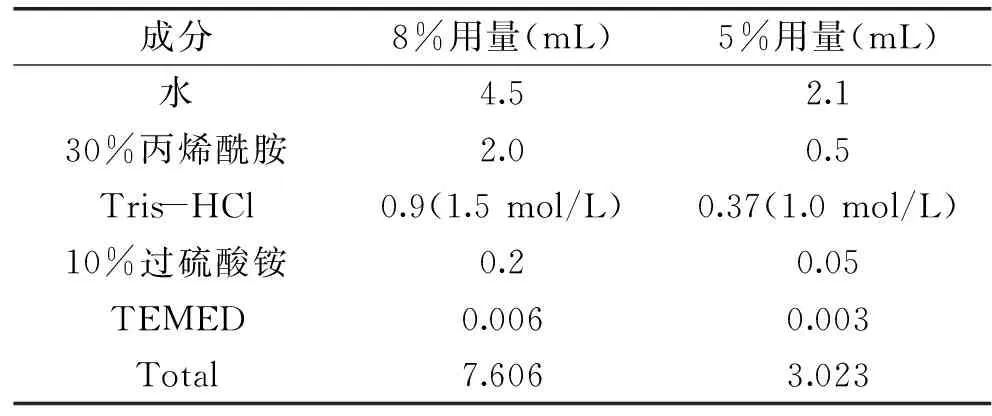
表1 PAGE分离胶Table 1 PAGE separation gel
1.3数据统计分析与制图方法
用Excel 2003统计分析数据并制图,用 SPSS11.5软件进行分析。
2 结果与分析
2.1成熟度及降温方法不同对果心褐变指数的影响

图3 不同降温方法对早采鸭梨果心POD同工酶的影响Fig.3 Effects of different cooling methods on POD isozymes of fruit core of early adoption Yali pear
由图1看出成熟度及降温方法不同对采后鸭梨果心褐变指数的影响较大,并随着贮藏期的延长,鸭梨果心的褐变程度逐渐增大。早、中和晚采鸭梨的变化规律为:急速降温>缓慢降温,褐变指数最高的处理方案为晚采急降,最低的处理为中采缓降。晚采急降在贮藏期0 d就出现了褐变现象,晚采缓降和中采急降在20 d时开始出现褐变,而中采缓降、中采急降和早采缓降在40 d时才开始出现褐变,果心整体在贮藏前100 d褐变均较为缓慢,最高为晚采急降,其褐变指数为0.26,最低为中采缓降褐变指数0.1。随后鸭梨果心褐变速度加快,到180 d 时,晚采急降最高达到0.8,中采缓降最低为0.62。整体看相同采收期的缓慢降温果心褐变指数均低于急速降温果心褐变指数,而中采鸭梨果心褐变指数增加趋势均小于早采鸭梨果心褐变指数,早采褐变指数增加趋势小于晚采。这可能是因为早采鸭梨果实还未成熟,生理还没有发育完全,鸭梨果实一部分能量要用于其果实的后熟,而另一部分才用于果实的抗氧化,所以其相同贮藏时间的鸭梨果心褐变指数要大于中采鸭梨褐变指数;晚采鸭梨果心褐变现象相对早采果实和中采果实严重,是因为晚采鸭梨采收时间晚,果实已走向衰老所致;而中采鸭梨适时采收,果实抗氧化能力相对较强,进而减少了鸭梨果心的褐变,从而达到良好的贮藏效果[15],因此中采结合缓慢降温贮藏可以减少和延缓鸭梨果心褐变。
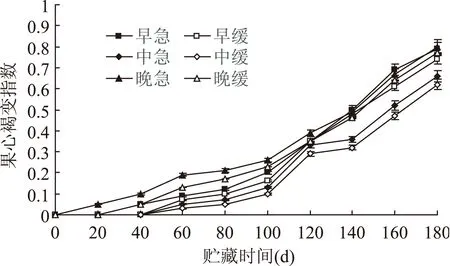
图1 成熟度及降温方法不同对鸭梨果心褐变指数的影响Fig.1 Effects of different cooling methods on fruit core browning index of Yali pear
2.2成熟度及降温方法对果心POD活性的影响
由图2可知,采后鸭梨果心POD活性总体呈缓慢下降趋势。不同采收期的鸭梨经缓慢降温处理后,其果心POD活性都高于相同贮藏期的急速降温的POD活性,缓慢降温贮藏鸭梨减缓POD活性的降低,进而延缓了鸭梨果心的褐变。相同的降温方法,晚采果心POD活性下降幅度大于早采的,中采鸭梨果心POD活性下降趋势略小于早采的。综上所述,成熟度及降温方法对鸭梨果实贮藏中果心的POD活性影响较大,随着贮藏时间的延长,果心POD活性降低,晚采急降的果实POD活性降低速度最快,这与晚采急降的鸭梨果心褐变指数变化趋势相反,说明POD活性与褐变指数有关。

图2 成熟度及降温方法对鸭梨果心POD活性的影响Fig.2 Effects of different cooling methods on POD activity of fruit core of different maturity Yali pear
2.3成熟度及降温方法对果心POD同工酶活性的影响
从图3~图5中都可以看到,出现了两条谱带,按分子量从小到大标记为A、B,A条带为迁移率(Rf)0.84的谱带,B为迁移率0.59的谱带。由图3可知,不同成熟度的鸭梨果心的POD同工酶谱带相同,且不同降温方法对同工酶的表达有影响;早采果心中的B条带为主谱带,颜色较深,说明这种POD同工酶得到较好的表达。由图3a可知,A同工酶在贮藏前120 d均有表达,在贮藏后期无表达,B条带的颜色随贮藏时间的延长缓慢变浅,由图3b知,A、B条带的颜色变化不明显,同时图3b中的A条带的颜色比图3a中的深。
由图4可知,中采果心中的B条带为主谱带,颜色较深,说明这种POD同工酶得到较好的表达。由图4a可知,A同工酶在贮藏前期有表达,B条带的颜色随贮藏时间的延长缓慢变浅。由图4b可知,A同工酶在整个贮藏期间均有表达,但表达量相对B同工酶表达量低,B条带的颜色随贮藏时间的延长变化不明显,同时图4b中的A、B两条带的颜色都比图4a中的深。

图4 不同降温方法对中采鸭梨果心POD同工酶的影响Fig.4 Effects of different cooling methods on POD isozymes of fruit core of middle adoption Yali pear

图5 不同降温方法对晚采鸭梨果心POD同工酶的影响Fig.5 Effects of different cooling methods on POD isozymes of fruit core of late adoption Yali pear
由图5可知,晚采果心B条带的颜色随贮藏时间的延长缓慢变浅。由图5a可知,A条带只在贮藏前60 d有表达,B条带的颜色随贮藏时间缓慢变浅。由图5b知,B条带的颜色随贮藏时间的延长缓慢变浅,A条带只在贮藏前140 d有表达。同时图5b中的A、B两条带的颜色都比图5a中的亮。
总体来说,同一成熟度不同处理的鸭梨果心的同工酶谱带相同,均为2条。但是缓降处理的鸭梨果心的同工酶谱带比急降的颜色深,说明缓慢降温处理后POD同工酶表达优于急速降温处理。
3 讨论
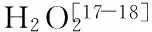
4 结论
本实验研究了急速降温和缓慢降温处理对不同采收成熟度(早采、中采、晚采)的鸭梨贮藏期间果心中POD活性、POD同工酶的影响及其与果心褐变的关系。结果表明:不同成熟度的鸭梨在两种降温方式处理后,贮藏期间果心褐变指数与POD活性变化趋势相反,中采缓降褐变指数最低,POD活性高且降低速度慢;晚采急降褐变指数最高,POD活性降低速度最快。则中采的果实选用缓慢降温方式处理后,有利于POD活性的保持,减缓鸭梨果心褐变,提高鸭梨品质。在POD同工酶中,果心仅有2条POD同工酶酶带,其中B谱带为鸭梨的特征谱带,而此条谱带同工酶随着贮藏时间的延长表达量降低,与鸭梨果心POD的活性变化趋势相一致,而与褐变指数变化趋势相反,同样说明POD同工酶与鸭梨果实的褐变有一定关系,特别是对主酶带B的影响较大;贮藏期间,主酶带B的表达量一直很高,采收成熟度对其影响较大;急速降温处理的鸭梨果心中的POD同工酶带B的表达量总体要比缓慢降温中低,说明降温方法主要对主酶带B有影响,从而影响到鸭梨的褐变。
[1]李晓丹,宋方圆,闫师杰,等.鸭梨采后果肉LOX同工酶变化及其与果实褐变关系的研究[J].华北农学报,2013,28(4):214-217.
[2]闫师杰,梁丽雅,陈计峦,等.降温方法对不同采收期鸭梨采后果心褐变和膜脂组分的影响[J].农业工程学报,2010,26(8):356-360.
[3]张亚伟,陈义伦.不同品种梨汁酶促褐变因子及相关性
[J].中国农业科学,2011,44(9):1880-1887.
[4]李江阔,曹森,张鹏,等.1-MCP采前处理对葡萄采后相关酶活性与品质的影响[J].食品科学,2014,35(22):270-275.
[5]周翠英,汤瑾,周建俭,等.气调包装保鲜翠冠梨的实验[J].江苏农业科学,2015,43(8):281-283.
[6]张丽敏,邓晨光,齐兴天,等.苹果过氧化物酶活性及同工酶分析[J].黑龙江农业科学,2014(11):18-20.
[7]侯玉茹,李文生,王宝刚,等.1-MCP处理对贮藏后西洋梨货架期品质的影响[J].食品工业科技,2015,36(20):335-228.
[8]王中元,王展,李雯,等.短波紫外线处理对木薯保鲜效果及生理指标的影响[J].食品科学,2016,37(2):256-260.
[9]蒋紫洮,袁孟玲,钟曼茜,等.紫外照射处理对龙眼果实常温下保鲜效果的研究[J].食品科技,2016,41(1):22-26.
[10]李江阔,曹森,张鹏,等.1-MCP采前处理对葡萄采后相关酶活性与品质的影响[J].食品科学,2014,35(22):270-275.
[11]李家政,毕大鹏.微孔膜包装对鸭梨贮藏品质的影响(英文)[J].果树学报,2010,27(l):57-62.
[12]宋方圆,陈计峦,闫师杰,等.不同采收期鸭梨果皮脂氧合酶同工酶的变化及其与果实褐变关系的研究[J].保鲜与加工,2012,12(3):11-14.
[13]王伟玲,王展,王晶英.植物过氧化物酶活性测定方法优化[J].实验室研究与探索,2010,29(4):21-23.
[14]李学强,李秀珍,王祥.5种樱桃属植物的POD、CAT和SOD同工酶分析[J].生物学通报,2010,45(2):46-49.
[15]何利华.鸭梨采后多酚氧化酶PPO同工酶及基因与果实褐变关系的研究[D].石河子:石河子大学,2010.
[16]Claudia Cosio,Christophe Dunand. Specific functions of individual ClassIII peroxidase genes[J]. Journal of Experimental Botany,2009:391-408.
[17]Erman JE,Vitello LB. Yeast cytochrome c peroxidase:mechanistic studies via protein engineering[J]. Biochimica et Biophysica Acta,2002:193-220.
[18]Shigeoka S,Ishikawa T,Tamoi M,et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany,2002,53:1305-1319.
[19]Ruiz-Duenas FJ,Camarero S,Perez-Boada M,et al. A new versatile peroxidase from Pleurotus[J].Biochemistry Society Transactions,2001,29:116-122.
[20]Piontek K,Smith AT,Blodig W. Lignin peroxidase structure and function[J]. Biochemistry Society Transactions,2001,29:111-116.
[21]Marjamaa K,Hilden K,Kukkola E,et al. Cloning,characterization and localization of three novel ClassIII peroxidases in lignifying xylem of Norway spruce(Piceaabies)[J]. Plant Molecular Biology,2006,61:719-732.
[22]Welinder KG,Justesen AF,Jensen RB,et al. Structural diversity and transcription of ClassIII peroxidases from Arabidopsis thaliana[J].European Journal of Biochemistry,2002,269:6063-6081.
[23]Matsui T,Nakayama H,Yoshida K,et al. Vesicular transport route of horseradish C1a peroxidase is regulated by N-and C-terminal propeptides in tobacco cells[J].Applied Microbiology and Biotechnology,2003,62:517-522.
[24]Erman JE,Vitello LB. Yeast cytochrome c peroxidase:mechanistic studies via protein engineering[J]. Biochimica et Biophysica Acta,2002:193-220.
[25]董剑寒,王然,宫静静,等.不同梨果实褐变特异性分析[J].中国农学通报,2007,23(4):285-288.
[26]张慎举,袁仲.南瓜过氧化物酶特性及褐变控制[J].商丘职业技术学院学报,2005,5(4):55-56.
[27]刘春丽,陈欲云.鲜切茄子酶促褐变的过氧化物酶的特性研究[J].四川理工学院学报:自然科学版,2012,25(2):8-11.
[28]吴振先,苏美霞,陈维信,等.贮藏荔枝果皮多酚氧化酶及过氧化物酶与褐变的研究[J].华南农业大学学报,1998,19(1):12-15.
Effect of different harvest maturity and cooling methods on POD activity and browning of Yali pear
HAN Yan-wen1,LIAN Shuang-qiu2,HAN Yun-yun1,LI Xiao-dan3,YAN Shi-jie3,4,*
(1.College of Horticulture and Landscape,Tianjin Agricultural University,Tianjin 300384,China;2.Beijing Chia Tai Fruit Industry Company Limited,Beijing 101206,China;3.College of Food Science and Biotechnology,Tianjin Agricultural University,Tianjin 300384,China;4.Tianjin Engineering and Technology Research Center of Agricultural Products Processing,Tianjin 300384,China)
The indexes of browning index,peroxidase(POD)and isozymes activity were determined,which was after the rapid and slow cooling treatment of different maturity of pears. The results showed that the POD isozymes activity of slow cooling treatment pear core was higher than that of rapid cooling at the same period. The change trend was opposite to pear core browning index trend. It was shown that the POD isozymes was closely related to the browning of pear core and slow cooling storage of pear could effectively inhibit browning. Meanwhile,the POD isozymes activity of mid-harvest pear was highest,early picking follows by,and late picking was the lowest. So different maturities were also the factors affected the browning of pear. Slow cooling in combination with mid-harvest pears could effectively inhibit browning.
Yali pear;core;browning;POD isozymes
2016-01-06
韩艳文(1990-),女,硕士研究生,主要从事果蔬贮藏与保鲜方面的研究,E-mail:sxtyhanyw@126.com。
闫师杰(1971-),男,博士,教授,研究方向:果蔬贮藏保鲜、食品质量与安全,E-mail:yanshijie@126.com。
国家自然科学基金项目(31471630)。
TS255.36
A
1002-0306(2016)14-0320-05
10.13386/j.issn1002-0306.2016.14.055
