鳕鱼蛋白酶解肽不同分子量组分抗炎活性的比较研究
2016-09-10唐季清郭珊珊罗永康
唐季清,郭珊珊,罗永康,景 浩,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.山东滨州万嘉生物科技有限公司,山东滨州 256600)
鳕鱼蛋白酶解肽不同分子量组分抗炎活性的比较研究
唐季清1,郭珊珊2,罗永康1,景浩1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.山东滨州万嘉生物科技有限公司,山东滨州 256600)
本研究比较了鳕鱼蛋白酶解肽(Cop protein hydrolytic peptide,CPHP)不同分子量组分对细胞炎症因子释放的抑制作用。鳕鱼蛋白经复合蛋白酶酶解制备得到鳕鱼蛋白酶解肽(CPHP),并进一步超滤得到三个不同分子量组分CPHP1(>5000 u)、CPHP2(<3000 u)和CPHP3(3000~5000 u)。用LPS诱导RAW264.7细胞炎症因子释放为模型,分别采用Griess法和ELISA分析NO和TNF-α、IL-1β、IL-6等细胞炎症因子的含量。结果表明,CPHP不同分子量组分对LPS(500 μg/mL)所致的RAW264.7细胞生长抑制均有显著保护作用(p<0.05),其保护作用随CPHP不同分子量组分的浓度升高而逐渐增强;CPHP和CPHP1的保护作用强于CPHP2和CPHP3。CPHP不同分子量组分对LPS(1 μg/mL)诱导RAW264.7细胞NO、IL-1β、IL-6和TNF-α等炎症因子释放均有显著的抑制作用(p<0.05),其抑制作用随CPHP不同分子量组分的浓度升高而逐渐增强;CPHP和CPHP1的抑制作用强于CPHP2和CPHP3。总之,CPHP不同分子量组分对LPS所致的细胞生长抑制均有显著的保护作用(p<0.05),对LPS诱导的细胞炎症因子的释放均有显著抑制作用(p<0.05);CPHP和CPHP1的细胞保护作用和炎症因子释放抑制作用均强于CPHP2和CPHP3的。
鳕鱼酶解肽,RAW264.7细胞,炎症因子
近年来研究发现鱼蛋白酶解肽具有较好的生物活性。Liang等[1]将大马哈鱼皮蛋白酶解得到鱼皮蛋白酶解肽,通过给大鼠饲喂酶解肽,证实了酶解肽可以有效减少肿瘤大鼠的死亡,并延长肿瘤大鼠的存活时间;Wu等[2]对鲭鱼蛋白酶解得到酶解肽,酶解肽的DPPH自由基清除率和还原能力随着酶解时间的延长而逐渐升高;且酶解肽与分离纯化得到的较小分子量多肽相比,具有较强的抗氧化活性。
目前已有一些关于鱼蛋白酶解肽抗炎活性的报道。Sung等[3]报告用胰蛋白酶和α-凝乳蛋白酶酶解香鱼蛋白制备得到酶解肽对LPS诱导RAW264.7细胞NO以及TNF-α、IL-6等炎症因子的释放具有抑制作用。Ahn等[4]采用胃蛋白酶酶解三文鱼胸鳍蛋白制备得到酶解肽及其1000~2000 u组分,后者对LPS诱导的RAW264.7细胞NO以及TNF-α、IL-6和IL-1β等炎症因子释放的抑制作用强于前者。Cheng等[5]采用碱性蛋白酶酶解金枪鱼蛋白制备得到酶解肽,并分离纯化得到两条十一肽(1543.8 u和1211.5 u),结果显示两条十一肽对LPS诱导RAW264.7细胞TNF-α、IL-2、IFN-γ等炎症因子释放的抑制作用均强于酶解肽的。
鳕鱼是一种主要分布于北太平洋和北大西洋两侧寒冷地带的海洋经济鱼类[6]。鳕鱼蛋白经胰蛋白酶酶解制得的酶解肽具有促进脾淋巴细胞增殖的作用[7];经风味蛋白酶酶解制得的酶解肽具有较好的抗氧化活性[8]。王珊珊等[9]从鳕鱼骨肉经胰蛋白酶酶解得到的骨胶原酶解肽中分离纯化得到两个组分BCH1(2000~6000 u)和BCH2(<2000 u)。BCH1和BCH2均可促进成骨细胞的增殖与分化,其中BCH2的作用高于BCH1的。目前有关鳕鱼酶解肽抗炎活性的研究未见报道,而且鳕鱼酶解肽不同分子量组分的抗炎活性还有待比较确定。
为了研究比较鳕鱼蛋白酶解肽不同分子量组分对细胞炎症因子释放的抑制活性,本研究采用复合蛋白酶酶解鳕鱼蛋白制备得到鳕鱼蛋白酶解肽(CPHP),并进一步超滤得到CPHP1(>5000 u)、CPHP2(<3000 u)和CPHP3(3000~5000 u)。用LPS诱导RAW264.7细胞炎症因子释放作为模型,采用Griess法和ELISA测定了CPHP不同分子量组分对LPS诱导RAW264.7细胞释放NO和IL-1β、IL-6、TNF-α炎症因子的抑制作用。
1 材料与方法
1.1材料与仪器
冷冻鳕鱼肉山东滨州万嘉生物科技有限公司;小鼠单核巨噬细胞RAW264.7索莱宝生物科技有限公司;DMEM培养基美国Invitrogen公司;胎牛血清(FBS)北京鼎国生物技术有限责任公司;胰蛋白酶、脂多糖(LPS)、二甲基亚砜(DMSO)美国Sigma公司;NO检测试剂盒、青霉素/链霉素溶液(100×)碧云天生物技术研究所;四甲基偶氮唑蓝(MTT)美国Amresco公司;IL-1β、IL-6、TNF-α定量ELISA检测试剂盒美国Biolegend公司;0.22 μm注射器滤膜美国Millipore公司;溶液配制采用去离子水。
680型酶标仪美国Bio-Rad公司;PHS-3C+型酸度计成都市纪方舟科技有限公司;XB 220A型电子天平德国Precisa Gravimetrics AG公司;R800001236型孔板振荡美国Biocote公司;MCO-15Acv型细胞培养箱日本Sanyo公司;BSC-1500IIA2-X型生物安全柜中国Biobase公司。
1.2实验方法
1.2.1鳕鱼蛋白酶解肽的制备鳕鱼蛋白酶解及分离纯化过程如下:将冷冻鳕鱼鱼肉解冻,按料液比1∶1.5向鱼肉中加水,95 ℃加热15 min将内源酶灭活,搅匀后用复合蛋白酶50 ℃酶解4 h。将酶解产物于95 ℃加热15 min将复合蛋白酶灭活,再经5000×g离心15 min。取其上清,得到酶解肽(CPHP)。将CPHP通过5000 u孔径的中空纤维超滤膜,得到分子质量>5000 u酶解肽组分(CPHP1)以及<5000 u的酶解肽组分,再将分子量<5000 u的组分通过3000 u孔径的中空纤维超滤膜,得到分子量<3000 u的酶解肽组分(CPHP2)和3000~5000 u酶解肽组分(CPHP3)。四种不同分子量组分溶液最后经冷冻干燥处理后制成粉末。称取CPHP不同分子量组分冻干粉末于无菌离心管中,于生物安全柜中,加入无菌PBS(pH=7.4)分别配制成1、2和3 mg/mL的CPHP不同分子量组分溶液。
1.2.2RAW264.7细胞培养RAW264.7细胞在细培养皿(直径100 mm)内用DMEM10(含10%胎牛血清的DMEM)培养,于37 ℃、5% CO2培养箱。当细胞生长至覆盖孔底面积的90%时,弃去培养液,向培养皿内倒入约1 mL胰酶消化液(0.01% EDTA,0.25%胰酶),将培养皿放入37 ℃培养箱,放置15 min,向培养皿中加入5~7 mL DMEM10终止消化,用移液管反复吹打,显微镜下观察直至形成单颗细胞悬液,接种于培养皿。每2~3 d传代一次。
1.2.3细胞生长抑制的测定将RAW264.7细胞以1×105个/mL密度100 μL接种于96孔板,于37 ℃、5% CO2培养箱中培养12 h后,弃培养基,加入100 μL不同终浓度的CPHP不同分子量组分溶液(0、1、2和3 mg/mL),于CO2培养箱中培养3 h后,弃上清,加入50 μL含LPS的培养基,于CO2培养箱中继续培养24 h。培养结束后,弃培养基,加入70 μL含0.5 mg/mL MTT的DMEM,继续培养4 h后,小心弃去上清,加入70 μL含0.04 N HCl的异丙醇溶液,震荡5 min,在490 nm波长处检测吸光值。以对照组为100%,计算细胞生长抑制百分率。
1.2.4细胞炎症因子的测定将RAW264.7细胞以1×105个/mL密度1 mL接种于24孔板,于37 ℃、5% CO2培养箱中培养12 h后,弃培养基,加入1 mL不同终浓度的CPHP不同分子量组分溶液(0、1、2和3 mg/mL),于CO2培养箱中培养3 h后,弃上清,加入500 μL含LPS的培养基,于CO2培养箱中继续培养24 h。每孔吸取200 μL培养液于1.5 mL离心管作为样品。采用NO检测试剂盒检测样品中NO的浓度,具体操作按照试剂盒说明书进行。简述如下,将NaNO2标准品浓度稀释至1~100 μmol/L(0、1、2、5、10、20、40、60、100 μmol/L)。取96孔板,每孔依次加入50 μL标准品或样品、50 μL Griess Reagent I和50 μL Griess Reagent II,避光放置5 min,在540 nm波长处检测吸光值。根据NaNO2浓度和吸光值标准曲线,计算样品中NO含量。分别采用IL-1β、IL-6和TNF-α的ELISA试剂盒检测样品中IL-1β、IL-6和TNF-α的浓度,具体操作按照试剂盒说明书进行。在450 nm波长处检测吸光值。根据IL-1β、IL-6和TNF-α的浓度和吸光值标准曲线,计算样品中对应炎症因子的含量。
1.2.5统计学分析所有实验均重复3次,数据结果以平均值±标准差(Mean±SD)表示。单因素方差分析采用Minitab17.1.0软件的one way ANOVA程序进行分析。均数间比较利用Turkey检验分析,显著性水平设定为p<0.05。
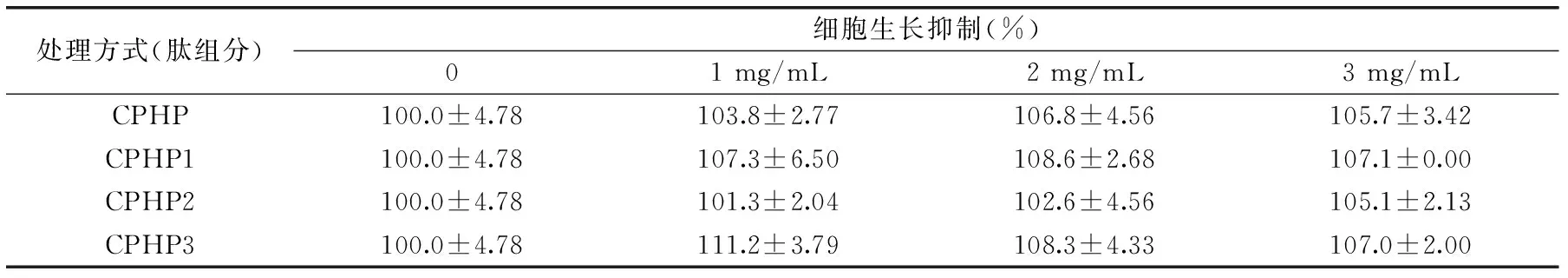
表1 CPHP不同分子量组分对RAW264.7细胞生长的影响Table 1 Effects of CPHP fractions on RAW264.7 cell growth

表2 CPHP不同分子量组分对LPS所致的RAW264.7细胞生长抑制的影响Table 2 Effects of CPHP fractions on LPS-induced RAW264.7 cell growth inhibition
注:同列不同小写字母表示差异显著(p<0.05);同行不同大写字母表示差异显著(p<0.05);表3~表6同。
2 结果与分析
2.1CPHP不同分子量组分对LPS所致的RAW264.7细胞生长抑制的保护作用
2.1.1LPS和CPHP不同分子量组分对RAW264.7细胞生长的影响LPS在1~100 μg/mL时对RAW264.7细胞生长无显著影响(p>0.05);在200 μg/mL时,LPS对RAW264.7细胞生长开始有显著抑制作用(p<0.05);在200~1000 μg/mL时,随着浓度的升高,LPS导致RAW264.7细胞生长的抑制作用逐渐增强(图1)。因为浓度为500 μg/mL时LPS对RAW264.7细胞生长的抑制作用为50%左右,所以采用500 μg/mL作为致细胞生长抑制的LPS作用浓度。

图1 LPS对RAW264.7细胞生长的影响Fig.1 Effects of LPS on RAW264.7 cell growth 注:a~d不同字母表示各组平均值之间 具有显著差异(p<0.05)。
由表1可知,CPHP不同分子量组分各浓度下(1、2和3 mg/mL)对RAW264.7细胞生长均无显著影响(p>0.05)。
2.1.2CPHP不同分子量组分对LPS所致的RAW264.7细胞生长抑制的保护作用由表2可知,LPS在500 μg/mL时对RAW264.7细胞生长具有显著的抑制作用(p<0.05)。CPHP不同分子量组分对LPS导致的RAW264.7生长抑制均有显著的保护作用(p<0.05)。随着CPHP不同分子量组分的浓度升高(1→2→3 mg/mL),其对LPS导致的RAW264.7细胞生长抑制的保护作用逐渐增强。对CPHP不同分子量组分的保护作用的比较表明,CPHP和CPHP1的强于CPHP2和CPHP3的,CPHP2与CPHP3无显著性差异(p>0.05);在1 mg/mL时,CPHP与CPHP1无显著差异(p>0.05);在2、3 mg/mL时,CPHP1的强于CPHP的。总之,CPHP不同分子量组分对LPS所致的细胞损伤均具有较好的保护作用,CPHP和CPHP1的保护作用强于CPHP2和CPHP3。
2.2CPHP不同分子量组分对LPS诱导的RAW264.7细胞炎症因子释放的影响
2.2.1CPHP不同分子量组分对LPS诱导的RAW264.7细胞NO释放的影响由表3可知,LPS诱导RAW264.7细胞NO释放显著升高(p<0.05)。CPHP不同分子量组分对LPS诱导NO释放均有显著的抑制作用(p<0.05)。随着CPHP不同分子量组分的浓度升高(1→2→3 mg/mL),其对LPS诱导NO释放的抑制作用逐渐增强。对CPHP不同分子量组分的抑制作用的比较表明,CPHP和CPHP1的强于CPHP2和CPHP3的,CPHP1的强于CPHP的;在1、2 mg/mL时,CPHP2与CPHP3无显著差异(p>0.05);在3 mg/mL时,CPHP3的强于CPHP2的(p<0.05)。总之,CPHP不同分子量组分对LPS诱导的NO释放均有较好的抑制作用,CPHP和CPHP1的抑制作用强于CPHP2和CPHP3的。

表3 CPHP不同分子量组分对LPS诱导RAW264.7细胞NO释放的影响Table 3 Effects of CPHP fractions on LPS-induced NO release of RAW264.7 cells

表4 CPHP不同分子量组分对LPS诱导RAW264.7细胞IL-1β释放的影响Table 4 Effects of CPHP fractions on LPS-induced IL-1β release of RAW264.7 cells
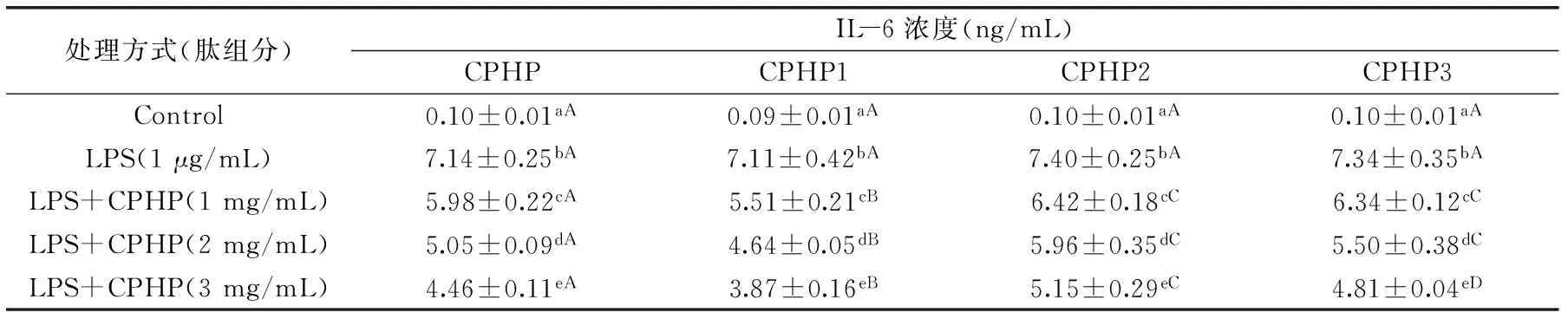
表5 CPHP不同分子量组分对LPS诱导RAW264.7细胞IL-6释放的影响Table 5 Effects of CPHP fractions on LPS-induced IL-6 release of RAW264.7 cells
2.2.2CPHP不同分子量组分对LPS诱导的RAW264.7细胞IL-1β释放的影响由表4可知,LPS诱导RAW264.7细胞IL-1β释放显著升高(p<0.05)。CPHP不同分子量组分对LPS诱导RAW264.7细胞IL-1β释放均有显著的抑制作用(p<0.05)。随着CPHP不同分子量组分的浓度升高(1→2→3 mg/mL),其对LPS诱导IL-1β释放的抑制作用逐渐增强。对CPHP不同分子量组分的抑制作用的比较表明,CPHP和CPHP1的强于CPHP2和CPHP3的,CPHP1的强于CPHP的;在1、2 mg/mL时,CPHP2与CPHP3无显著差异(p>0.05);在3 mg/mL时,CPHP3的强于CPHP2的。总之,CPHP不同分子量组分对LPS诱导的IL-1β释放均有较好的抑制作用,CPHP和CPHP1的抑制作用强于CPHP2和CPHP3的。
2.2.3CPHP不同分子量组分对LPS诱导的RAW264.7细胞IL-6释放的影响由表5可知,LPS诱导RAW264.7细胞IL-6释放显著升高(p<0.05)。CPHP不同分子量组分对LPS诱导RAW264.7细胞IL-6释放均有显著的抑制作用(p<0.05)。随着CPHP不同分子量组分的浓度升高(1→2→3 mg/mL),其对LPS诱导IL-6释放的抑制作用逐渐增强。对CPHP不同分子量组分的抑制作用的比较表明,CPHP和CPHP1的强于CPHP2和CPHP3的,CPHP1的强于CPHP的;在1、2 mg/mL时,CPHP2与CPHP3无显著差异(p>0.05);在3 mg/mL时,CPHP3的强于CPHP2的。总之,CPHP不同分子量组分对LPS诱导的IL-6释放均有较好的抑制作用,CPHP和CPHP1的抑制作用强于CPHP2和CPHP3的。
2.2.4CPHP不同分子量组分对LPS诱导的RAW264.7细胞TNF-α释放的影响由表6可知,LPS诱导RAW264.7细胞TNF-α释放显著升高(p<0.05)。CPHP不同分子量组分对LPS诱导RAW264.7细胞TNF-α释放均有显著的抑制作用(p<0.05)。随着CPHP不同分子量组分的浓度升高(1→2→3 mg/mL),其对LPS诱导TNF-α释放的抑制作用逐渐增强。对CPHP不同分子量组分的抑制作用的比较表明,CPHP和CPHP1的强于CPHP2和CPHP3的,CPHP1的强于CPHP的;在1、2 mg/mL时,CPHP2与CPHP3无显著差异(p>0.05);在3 mg/mL时,CPHP3的强于CPHP2的。因此,CPHP不同分子量组分对LPS诱导的TNF-α释放均有较好的抑制作用,CPHP和CPHP1的抑制作用强于CPHP2和CPHP3的。

表6 CPHP不同分子量组分对LPS诱导RAW264.7细胞TNF-α释放的影响Table 6 Effects of CPHP fractions on LPS-induced TNF-α release of RAW264.7 cells
3 讨论
LPS等炎性刺激因子可以与Toll样受体4(Toll-like receptor 4,TLR4)结合,激活髓样分化因子88(Myeloid differentiation factor88,MyD88)信号通路,最终激活核因子-κB(nuclear factor kappa-B,NF-κB),导致诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOs)、TNF-α、IL-1β、IL-6和COX-2(PGE2)等炎症因子的转录和释放[10]。NO由iNOS催化生成,可进一步生成RNS(Reactive nitrogen species)导致细胞的氧化损伤[11]。TNF-α有肿瘤细胞杀伤作用[12],可使血管内皮细胞通透性增加,趋化炎性细胞,还可通过激活NF-κB通路促使其他细胞因子的合成和释放[13]。IL-1β能促使细胞粘附因子的合成和释放,加速单核细胞与内皮细胞的粘附[14]。IL-6促进T细胞、B细胞以及NK细胞的增殖分化[15]。这些细胞因子在细胞炎性反应和慢性病的发病机理中起着重要作用。
Gayle等[16]报告LPS在80 μg/mL时作用72 h会引起胚胎鼠脑神经胶质细胞释放NO、TNF-α和IL-1β等炎症因子,并导致神经胶质细胞生长抑制。Campo等[17]报告LPS在50 μg/mL时作用24 h可抑制软骨细胞生长率至75%,加入1 mg/mL硫酸软骨素可使细胞生长率保持在95%。本实验中,LPS在500(g/mL时作用24 h可抑制RAW264.7细胞生长率至50%。CPHP不同分子量组分在1 mg/mL时,可使RAW264.7细胞生长率保持在54%~58%。
Ahn等[4]报道了三文鱼酶解肽对LPS诱导RAW264.7细胞NO、TNF-α、IL-6和IL-1β等炎症因子释放具有抑制作用,其中1000~2000 u组分的抑制作用强于酶解肽的。De Mejia等[18]报告大豆多肽对LPS诱导的RAW264.7细胞NO、IL-1β、IL-6等炎症因子的释放有较好的抑制作用,其中5 ku多肽的抑制作用强于8、14 ku多肽的。这些结果表明酶解肽低分子量组分对炎症因子释放的抑制作用均强于高分子量组分的。然而Park等[19]报道了紫壳菜蛤蛋白酶解肽对LPS诱导的RAW264.7细胞NO释放具有抑制作用,且>5 ku组分的抑制作用明显强于1~5 ku组分的。本研究中CPHP高分子量组分的抑制作用强于低分子量组分的。这与Park等的研究结果一致。Wu等[2]对鲭鱼蛋白酶解分离纯化得到1400、900和200 u三条多肽,通过抗氧化实验证实了1400 u的多肽相较于900 u和200 u的多肽具有更高的DPPH自由基清除率。这个报告也与本研究结果一致,酶解肽高分子量组分的生物活性强于低分子量组分的。
4 结论
CPHP不同分子量组分对LPS所致的RAW264.7细胞生长抑制均有保护作用,对LPS诱导RAW264.7细胞的炎症因子(NO、IL-1β、IL-6和TNF-α)释放均有抑制作用。CPHP和CPHP1对细胞生长的保护作用和对炎症因子释放的抑制作用均强于CPHP2和CPHP3。
[1]Liang J,Pei XR,Wang N,et al. Marine collagen peptides prepared from chum salmon(Oncorhynchusketa)skin extend the life span and inhibit spontaneous tumor incidence in sprague-dawley rats[J]. Journal of Medicinal Food,2010,13(4):757-770.
[2]Wu HC,Chen HM,Shiau CY. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomberaustriasicus)[J]. Food Research International,2003,36(9):949-957.
[3]Sung NY,Jung PM,Yoon M,et al. Anti-inflammatory effect of sweetfish-derived protein and its enzymatic hydrolysate on LPS-induced RAW264.7 cells via inhibition of NF-κB transcription[J]. Fisheries Science,2012,78(2):381-390.
[4]Ahn CB,Je JY,Cho YS. Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J]. Food Research International,2012,49(1):92-98.
[5]Cheng ML,Wang HC,Hsu KC,et al. Anti-inflammatory peptides from enzymatic hydrolysates of tuna cooking juice[J]. Food and Agricultural Immunology,2015,26(6):1-12.
[6]Ding L,Zhong S. Optimization of enzymolysis technology of codfish protein and antioxidant abilities of its hyrolysate[J]. Food Science,2008,29(8):398-401.
[7]候虎. 鳕鱼免疫活性肽的可控制备及其免疫活性研究[D].青岛:中国海洋大学,2011.
[8]史策,韩烽烽,刘鹏. 鳕鱼和鲅鱼鱼肉蛋白酶解产物功能特性及抗氧化性[J]. 肉类研究,2013(8):5-7.
[9]王珊珊. 鳕鱼骨胶原肽与活性钙的制备及其抗骨质疏松活性研究[D]. 青岛:中国海洋大学,2013.
[10]Cheng BCY,Yu H,Su T,et al. A herbal formula comprising Rosae Multiflorae Fructus and Lonicerae Japonicae Flos inhibits the production of inflammatory mediators and the IRAK-1/TAK1 and TBK1/IRF3 pathways in RAW 264.7 and THP-1 cells[J]. Journal of Ethnopharmacology,2015,174:195-199.
[11]Wink DA,Hines HB,Cheng RYS,et al. Nitric oxide and redox mechanisms in the immune response[J]. Journal of Leukocyte Biology,2011,89(6):873-891.
[12]Allensworth JL,Sauer SJ,Lyerly HK,et al. Smac mimetic Birinapant induces apoptosis and enhances TRAIL potency in inflammatory breast cancer cells in an IAP-dependent and TNF-α-independent mechanism[J]. Breast Cancer Research and Treatment,2013,137(2):359-371.
[13]Leppkes M,Roulis M,Neurath MF,et al. The pleiotropic functions of TNF-αin the regulation of the intestinal epithelial response to inflammation[J]. International Immunology,2014:dxu051.
[14]Bayat H,Schröder K,Pimentel DR,et al. Activation of thromboxane receptor modulates interleukin-1β-induced monocyte adhesion-A novel role of Nox1[J]. Free Radical Biology and Medicine,2012,52(9):1760-1766.
[15]Naugler WE,Karin M. The wolf in sheep’s clothing:the role of interleukin-6 in immunity,inflammation and cancer[J]. Trends in Molecular Medicine,2008,14(3):109-119.
[16]Gayle D A,Ling ZD,Tong CW,et al. Lipopolysaccharide(LPS)-induced dopamine cell loss in culture:roles of tumor necrosis factor-α,interleukin-1β,and nitric oxide[J]. Developmental Brain Research,2002,133(1):27-35.
[17]Campo GM,Avenoso A,Campo S,et al. Glycosaminoglycans modulate inflammation and apoptosis in LPS-treated chondrocytes[J]. Journal of Cellular Biochemistry,2009,106(1):83-92.
[18]De Mejia EG,Dia VP. Lunasin and lunasin-like peptides inhibit inflammation through suppression of NF-κB pathway in the macrophage[J]. Peptides,2009,30(12):2388-2398.
[19]Park SY,Ahn CB,Je JY. Antioxidant and anti-inflammatory activities of protein hydrolysates from mytilus edulis and ultrafiltration membrane fractions[J]. Journal of Food Biochemistry,2014,38(5):460-468.
Comparison of anti-inflammatory activity of four different molecular fractions of cod protein hydrolytic peptides
TANG Ji-qing1,GUO Shan-shan2,LUO Yong-kang1,JING Hao1,*
(1.College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China;2.Shandong Wanjia Biological Science and Technology Co.,Ltd.,Binzhou 256600,China)
Effects of four different molecular fractions of cod protein hydrolytic peptides(CPHP)on LPS-induced release of inflammatory cytokines were compared. CPHP was a whole mixture of cod protein hydrolytic peptides hydrolyzed by complex protease. The peptides were further fractionated by ultrafiltration into three fractions of CPHP1(>5000 u),CPHP2(<3000 u)and CPHP3(3000~5000 u). Griess assay and ELISA kits were used to measure the levels of NO and inflammatory cytokines(TNF-α,IL-1βand IL-6),respectively. The results showed that the all CPHP fractions protected RAW264.7 cells from LPS(500 μg/mL)induced cell growth inhibition,in a dose dependent manner,and protective effects of CPHP and CPHP1 were higher than that of CPHP2 and CPHP3. All CPHP fractions inhibited release of NO,IL-1β,IL-6 and TNF-αfrom RAW264.7 cells induced by LPS(1 μg/mL),in a dose dependent manner. The inhibitory effects of CPHP and CPHP1 were higher than that of CPHP2 and CPHP3. In conclusion,all four fractions of CPHP had protective effect against LPS induced cell growth inhibition and release of inflammatory cytokines. The CPHP and CPHP1 had higher activity than that of CPHP2 and CPHP3.
cod protein hydrolytic peptide;RAW264.7 cells;inflammatory cytokines
2016-01-04
唐季清(1989- ),男,博士研究生,研究方向:营养与食品安全,E-mail:qing19890604@sina.cn。
景浩(1957- ),男,教授,主要从事食品营养方面的研究,E-mail:haojing@cau.edu.cn。
TS201.4
A
1002-0306(2016)14-0344-06
10.13386/j.issn1002-0306.2016.14.060
