葛根素衍生物对局灶性脑缺血再灌注的保护作用及对caspase-3表达的影响
2016-09-09张宏伟聊城市人民医院临床药学室山东聊城5000重庆医科大学药学院生化与分子药理研究室重庆400006海南省药品检验所海南省药物质量研究重点实验室海南海口5706
张宏伟,张 帆,董 志,朱 毅(.聊城市人民医院临床药学室,山东 聊城 5000;.重庆医科大学药学院生化与分子药理研究室,重庆 400006;.海南省药品检验所海南省药物质量研究重点实验室,海南 海口 5706)
·实验研究·
葛根素衍生物对局灶性脑缺血再灌注的保护作用及对caspase-3表达的影响
张宏伟1,2,张 帆1,董 志2,朱 毅3
(1.聊城市人民医院临床药学室,山东 聊城 252000;2.重庆医科大学药学院生化与分子药理研究室,重庆 400006;3.海南省药品检验所海南省药物质量研究重点实验室,海南 海口 570216)
目的:观察葛根素衍生物(G20)对局灶性脑缺血再灌注损伤大鼠是否具有保护作用,并探讨其作用机制,其保护作用是否与caspase-3的表达具有相关性。方法:以Longa发明的线栓法制作局灶性脑缺血再灌注模型,大鼠被随机分为6组,分别为假手术组、模型组、G(25.0 mg·kg-1)组、G20(12.5、25.0、50.0 mg·kg-1)组,给药组于缺血后1.5 h及6 h两次尾静脉给药。通过评价大鼠缺血后神经行为学、脑梗死面积及脑含水量的变化,HE染色观察脑组织神经元病理学改变,以观察G20是否具有脑缺血再灌注损伤保护作用;并以原位末端标记法检测大脑神经元凋亡数目的改变及免疫组化法检测其caspase-3的表达来探讨其作用机制。结果:G20能改善脑缺血后4 h、24 h的神经肌肉运动和前庭运动功能,减少脑缺血再灌注后脑梗死面积及降低脑含水量,减轻脑组织的病理形态学改变,与G组比较,未见大鼠尿液变红等不良反应。G20明显减少了脑组织凋亡细胞的数目,减少了caspase-3的表达。结论:G20对大鼠脑缺血再灌注损伤有保护作用,其机制可能是通过抑制caspase-3的表达发挥抗神经元凋亡作用。
葛根素;葛根素衍生物;局灶性脑缺血再灌注;凋亡;Caspase-3
葛根素注射液为血管扩张药,有扩张冠状动脉和脑血管、降低心肌耗氧量,改善微循环和抗血小板聚集的作用,但其相关的不良反应报道也越来越多(如溶血等)[1],葛根素等中药及方剂也是脑缺血损伤治疗药物的研究热点[2]。有关学者将葛根素结构进行改造,生成了一系列的衍生物,G20就是其中之一。鄢良春等[3]已证明G20能较好的降低心肌缺血再灌注损伤的作用,本文通过线栓法制作了大鼠的局灶性脑缺血再灌注模型,以观察G20是否具有神经保护作用。caspase-3在Caspase家族中具有中心地位,其活化后可以激活核因子及DNA修复酶等,导致DNA裂解、染色体浓缩和凋亡小体形成等,最终引起细胞凋亡。有研究[4]表明,急性脑缺血中大脑内皮细胞DNA被切成片段之前,caspase-3被快速激活。本研究重点观察G20是否可以减轻大脑皮质caspase-3蛋白的表达,是否具有抗凋亡作用。
1 材料
1.1主要仪器
恒温水浴锅(北京长安科学仪器厂);IEC CENTRA-7R低温离心机(赛默飞世尔科技公司);DHG-9240A电热恒温鼓风干燥箱(上海一恒科技有限公司);Motic Med 6.0数码医学图像分析系统(北京麦克奥迪仪器仪表有限公司)。
1.2主要试剂
G(葛根素,海南斯达制药有限公司,批号0304070);G20(军事医学科学院药理及毒理研究所药物化学研究室合成,纯度> 90%);TTC(上海化学试剂公司,批号20031212);TUNEL试剂盒(武汉博士德生物工程有限公司);SABC免疫组化染色试剂盒(武汉博士德生物工程有限公司);caspase-3抗体试剂盒(武汉博士德生物工程有限公司)。
1.3动物
SD大鼠,280 ~ 320 g,雄性,81只,由军事医学科学院实验动物中心提供,动物合格证号为SCSK-(军)-2002-001,饲养于清洁级环境内,日常饲喂以60Co照射消毒饲料及饮用消毒用水,室温20 ~ 25 ℃,湿度40% ~ 70%,12 h照明,12 h黑暗。实验经过北京市实验动物福利伦理审查分会许可。
2 方法与分组
2.1模型制作
参照Longa等[5]研究中右侧大脑中动脉的缺血再灌注模型方法,并进行改良[6]。模型组大鼠术前12 h禁食,允许自由饮水。以水合氯醛进行腹腔注射全身麻醉后,取颈部正中切口,结扎颈总动脉和颈外动脉,于颈总动脉开口插入线栓(直径0.26 ~ 0.28 mm,长度5 cm),经动脉分叉处至颈内动脉1.9 ~ 2.2 cm(假手术组为1.5 ~ 1.7 cm)稍感阻力停止,实现了右侧大脑中动脉的缺血,栓塞90 min后退出线栓使大脑中动脉再通,实现大脑中动脉的缺血后再灌注。
2.2分组
大鼠随机分为假手术组、模型组、G(25.0 mg·kg-1)组、G20(12.5、25.0、50.0 mg·kg-1)组,每组至少8只;给药组于缺血后1.5 h及6 h两次尾静脉给药。
2.3神经学评价方法
根据相关研究[7]的行为学评价标准改制,缺血后4 h及24 h进行评定两种功能:神经肌肉功能,前庭运动功能。
2.4脑组织染色及梗死面积
缺血24 h后,取脑除去嗅球、小脑和低位脑干,称重(G1)后置入- 20 ℃冰箱20 min后,冠状切为5片,置1% TTC中37 ℃温孵30 min。10%甲醛固定、拍照,将染色后的白色组织分离称重(G2),梗死面积(%)=坏死脑组织的重量(G2)/脑重量(G1)×100%。
2.5脑含水量
将上述大鼠的左右脑分别称重后,置110 ℃烤箱中烤干至恒重(G3),计算干湿比。脑含水量(%)=[脑湿重(G1) -干重(G3)]/脑湿重(G1)×100%。
2.6病理切片
另取假手术组、模型组、G(25.0 mg·kg-1)及G20 (25.0 mg·kg-1,为前期实验证实效果较好的一个剂量)组大鼠各6只,开胸暴露心脏,在升主动脉处插管灌以4%多聚甲醛,取出大脑,于视交叉后4 mm处取4 mm厚的冠状切片,将其进行固定,一片做HE染色,一片做细胞凋亡检测,另一片做caspase-3检测。
2.7凋亡细胞计数及caspase-3
将上述脑切片,利用寡核苷酸末端脱氧核糖核酸转移酶介导的dUTP缺口末端标记(TUNEL)技术,检测细胞核内的原位标记的DNA特征性片段,细胞核中有棕黄色颗粒者为阳性细胞,即凋亡的细胞,在高倍视野(40×10)下随机观察大鼠右侧脑组织的六个视野,计数神经元细胞中阳性细胞数。利用SABC免疫组化方法检测大鼠右侧脑组织神经元胞浆caspase-3阳性细胞的原位表达,caspase-3阳性细胞胞浆呈棕黄色。
2.8药品不良反应
在实验过程中,密切观察各组大鼠是否有尿血现象的发生。
2.9统计学处理
3 结果
3.1神经行为学
3.1.1神经肌肉运动功能评分 除假手术组外,脑缺血再灌注后4 h提鼠尾可见大鼠左前肢内收,左前肢肌张力下降,左肩阻力明显下降,行走时向左转圈,提示神经肌肉运动功能的损伤。由表1所示,用药组较模型组大鼠的神经肌肉运动功能评分降低,其中G (25.0 mg·kg-1)及G20(25.0 mg·kg-1)明显减低脑缺血后4 h及24 h的神经肌肉运动功能评分,与模型组比较有显著性差异(P < 0.05)。
表1 G20对脑缺血再灌注大鼠神经肌肉运动功能评分的影响.Tab 1 Influence of G20 on neuromuscular function scale in rats subjected to cerebral ischemia and reperfusion.

表1 G20对脑缺血再灌注大鼠神经肌肉运动功能评分的影响.Tab 1 Influence of G20 on neuromuscular function scale in rats subjected to cerebral ischemia and reperfusion.
注:与模型组比较,*P < 0.05,**P < 0.01Note: compared with model group,*P < 0.05,**P < 0.01
?
3.1.2前庭运动功能评分 除假手术组外,脑缺血再灌注后4 h大鼠在平衡木上不能站稳,一般的左前肢偏离平衡木,严重的会掉下平衡木,均有前庭运动功能的损伤。由表2所示,与模型组比较,用药后评分均有降低,其中G(25.0 mg·kg-1)及G20(25.0 mg·kg-1)明显降低脑缺血后4 h及24 h的前庭运动功能评分,与模型组比较差异有统计学意义(P < 0.05)。
表2 G20对脑缺血再灌注大鼠前庭运动功能评分的影响.Tab 2 Influence of G20 on vestibular motor function scales in rats subjected to cerebral ischemia and reperfusion.
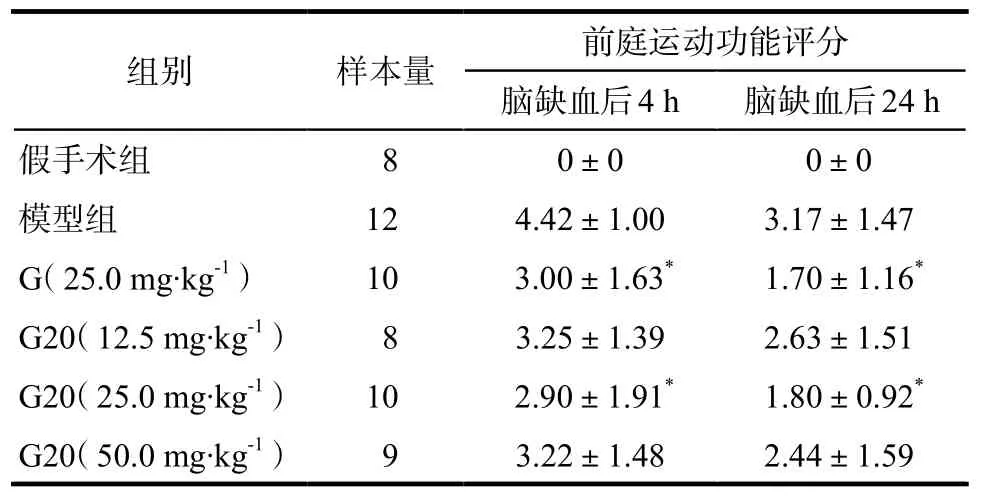
表2 G20对脑缺血再灌注大鼠前庭运动功能评分的影响.Tab 2 Influence of G20 on vestibular motor function scales in rats subjected to cerebral ischemia and reperfusion.
注:与模型组比较,*P < 0.05Note: compared with model group,*P < 0.05
?
3.2脑梗死面积
由图1所示,除假手术组外,各组脑缺血再灌注后脑组织经TTC染色均有明显的苍白色区域,表明模型制作成功。用药后苍白区域面积均有减少,其中G20(25.0 mg·kg-1)及G(25.0 mg·kg-1)明显减少脑梗死面积,与模型组比较差异有统计学意义(P < 0.05)。

图1 TTC染色的大鼠脑冠状切面
3.3脑含水量
由表3所示,除假手术组外,各组脑缺血再灌注后脑含水量均明显增大,表明缺血再灌后均有脑水肿形成。用药后含水量均有减少,尤以G(25.0 mg·kg-1)及G20(25.0 mg·kg-1)降低脑含水量明显,与模型组比较有显著性差异(P < 0.05)。
Tab 3 Influence of G20 on the content of brain edema in rats subjected to cerebral ischemia and reperfusion.
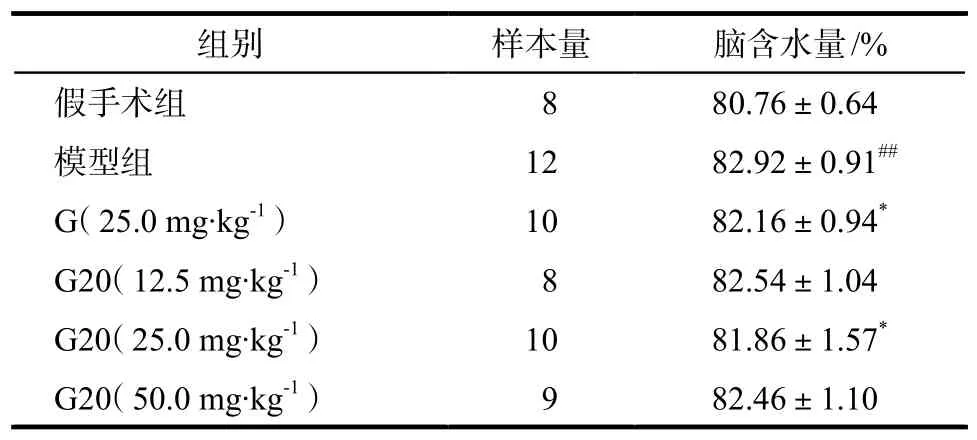
注:与假手术组比较,##P < 0.01;与模型组比较,*P < 0.05Note: compared with sham-operation group,##P < 0.01; compared with model group,*P < 0.05
3.4病理组织学
假手术组:细胞形态正常,核仁清楚,神经细胞胞体有突起伸出,间质内未见出血、坏死及水肿。模型组:右侧大脑缺血范围内,可见皮质及纹状体区有片状坏死,细胞水肿明显,细胞外间隙增宽,细胞核固缩,核仁消失。G20(25.0 mg·kg-1)及G(25.0 mg·kg-1)组:缺血区水肿较缺血组明显减轻,只有少量灶状坏死,胞浆及核较清晰,细胞周围间隙增宽不明显,细胞核固缩减轻,还可见核仁等结构,详见图2。
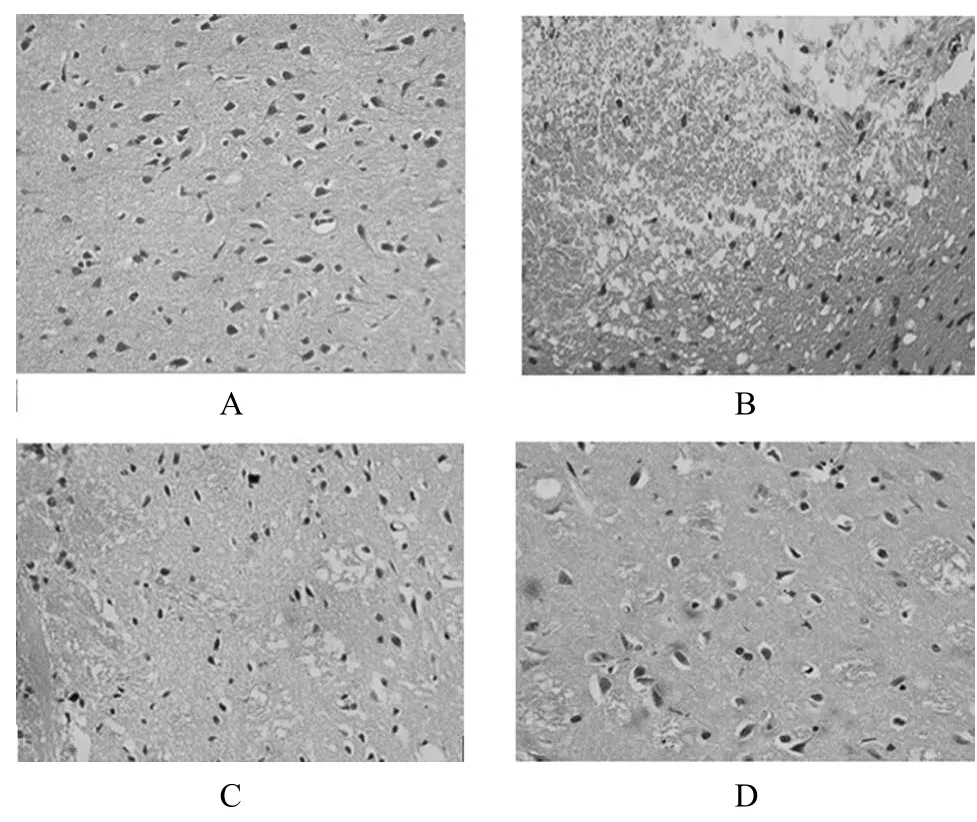
图2 G20对脑缺血再灌注大鼠脑组织病理形态学的影响A -假手术组,B -模型组,C - G组(25.0 mg·kg-1),D - G20组(25.0 mg·kg-1)( HE ×200)Fig 2 The effect of G20 on the pathomorphology of rat brain after cerebral ischemia and reperfusionA - sham-operation group, B - model group, C - G group (25.0 mg·kg-1), D - G20 group (25.0 mg·kg-1) (HE ×200)
3.5神经细胞凋亡
由图3所示:假手术组几乎没有凋亡细胞形成。模型组有较多的凋亡细胞,细胞染色质浓缩、边缘化,核膜裂解、染色质分割成块状。G20(25 mg·kg-1)组凋亡细胞数量减少,有较少的细胞染色质的浓缩,与模型组比较,有显著性差异(P < 0.05)。
3.6Caspase-3蛋白
由图4所示:假手术组大鼠脑组织的caspase-3阳性细胞较少,模型组大鼠缺血侧脑组织的caspase-3阳性较多,其表达主要位于神经元胞质及部分突起,一部分位于核内。G20(25.0 mg·kg-1)及G(25.0 mg·kg-1)与模型组比较,缺血侧脑组织的caspase-3阳性表达较少。
3.7药品不良反应
G组大鼠在用药过程中有2/8(25%)大鼠出现尿液变红的现象;G20组大鼠未出现尿液变红的现象。
4 讨论
4.1新药研究的必要性
现有的神经保护药物米帕明、阿司匹林等报道有抗脑缺血再灌注损伤作用[8],但大多疗效不佳、副作用较多,临床迫切需要一种既能减轻再灌注损伤,副作用又少的药物。
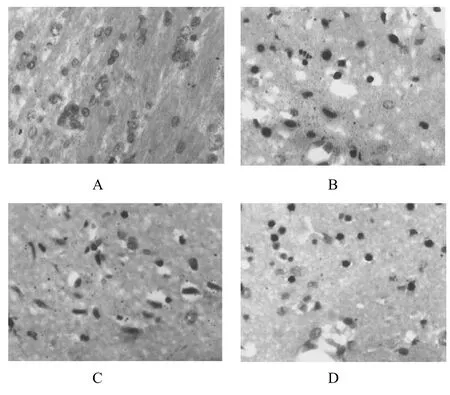
图3 G20对脑缺血再灌注大鼠神经元凋亡数目的影响A - 假手术组,B - 模型组,C - G组(25.0 mg·kg-1),D - G20组(25.0 mg·kg-1)(TUNEL×400)Fig 3 The effect of G20 on the number of neuronal apoptosis in rats after cerebral ischemia and reperfusionA - sham-operation group, B - model group, C - G group (25.0 mg·kg-1), D - G20 group (25.0 mg·kg-1) (TUNEL×400)

图4 G20对脑缺血再灌注大鼠脑组织caspase-3表达的影响A - 假手术组,B - 模型组,C - G组(25.0 mg·kg-1),D - G20组(25.0 mg·kg-1)(SABC×200)Fig 4 The effect of G20 on the expression of caspase-3 in cerebral ischemia reperfusion brain tissue in ratsA - sham-operation group, B - model group, C - G group (25.0 mg·kg-1), D - G20 group (25.0 mg·kg-1) (SABC×200)
4.2模型的制作
本实验选取最常用的局灶性脑缺血再灌注损伤模型,操作方法简单,手术时间从动物麻醉至造模成功一般只需在20 min内即可完成,本实验的造模成功率为80%左右,神经缺损较明显,梗死灶部位比较恒定,与陈卫伟等[9]造模成功率相似。实验过程中通过观察脑缺血后4 h及24 h的大鼠神经行为学、脑梗死面积、脑含水量及病理形态学改变,一方面证明了模型制作的成功,另一方面证实了G20可明显减轻脑缺血再灌注损伤。
4.3脑缺血再灌注损伤机制
脑缺血再灌注损伤机制较为复杂,主要与自由基过度形成、兴奋性氨基酸毒性作用、细胞内钙超载、炎性反应等多种机制有关[10]。近年来研究表明,神经细胞凋亡与脑缺血性损伤有着密切关系,细胞凋亡可能受相关凋亡基因调控[11]。葛根素的保护机制非常复杂,已经较多报道[12],如能上调大鼠海马梗死灶周围Bcl-2的表达,抑制Bax的表达减轻大鼠海马区缺血再灌注损伤[13]。本实验证实G与G20均可减少缺血区凋亡细胞的数目,从而起到神经保护作用。
Caspase家族在细胞凋亡的分子机制中居中心地位,Li等[14]研究表明,干预caspase-3的激活,可有效抑制凋亡的发生。Nadia等[15]也证实己酮可可碱可以减轻脑缺血再灌注大鼠的神经细胞凋亡,减少caspase-3的表达。Hu等[16]研究证实川芎内酯也通过下调caspase-3发挥脑保护性作用。本实验脑缺血再灌注损伤后大鼠凋亡细胞数目及caspase-3的表达较假手术组明显增加,G20组减少了大鼠凋亡细胞数目及caspase-3的表达,究竟G20是否是通过减少caspase-3的表达来减少细胞凋亡的,还需要进一步的研究加以证实。
4.4药品不良反应的观察结果
本实验观察到了葛根素可引起大鼠尿液变红这一现象,但未对G及G20进行溶血性实验比较,以进一步验证G20较G产生溶血反应少,是本实验存在的局限性。
综上所述,G20对局灶性脑缺血再灌注损伤大鼠具有保护性作用,并且可能通过减少caspase-3的表达减轻细胞凋亡,未发现溶血现象,其具体作用机制将进行更深入的研究。
[1] 黄敏娟,贺煜星,丁选胜.不同输液配伍葛根素注射液对溶血的影响[J].中国医院药学杂志,2015,35(5):425-429.
[2] 陈小飞,王永安.氨基酸及其受体在脑缺血中的作用及相关药物应用[J].中国药物应用与监测,2010,7(2):116-119.
[3] 鄢良春,王林,吕秋军,等.葛根素衍生物抗心肌缺血再灌注损伤的活性筛选[J].中国药房,2008,19(3):172-174.
[4] Zehendner CM, Librizzi L, de Curtis M, et al. Caspase-3 contributes to ZO-1 and Cl-5 tight-junction disruption in rapid anoxic neurovascular unit damage[J]. PLoS One, 2011, 6(2): e16760.
[5] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989, 20(1): 84-91.
[6] 张荣媛,张宏伟,尚爱加.大鼠大脑中动脉缺血再灌注模型制备及行为学评价标准的改进[J].军医进修学院学报,2008,29 (5):422-423.
[7] Petullo D, Masonic K, Lincoln C, et al. Model development and behavioral assessment of focal cerebral ischemia in rats[J]. Life Sci, 1999, 64(13): 1099-1108.
[8] 王立英,杨世杰.脑缺血再灌注损伤机制及其药物治疗方法的研究进展[J].吉林大学学报,2012,38(6):1227-1231.
[9] 陈卫伟,杨留才,潘施文,等.线栓法制备SD大鼠局灶性脑缺血再灌注损伤模型[J].中国组织工程研究与临床康复,2011,15(50):9377-9380.
[10] 王光胜,耿德勤.脑缺血/再灌注损伤机制研究进展[J].医学综述,2011,17(24):3753-3756.
[11] 陈东丽,陈旭东,夏翠英.天麻对大鼠脑缺血再灌注神经细胞凋亡的影响[J].中国实验方剂学杂志,2011,17(3):148-150.
[12] 黄雄峰,汪建民.葛根素的神经保护作用机制研究进展[J].中国实验方剂学杂志,2015,21(4):224-230.
[13] 丁小明,廖丹琼.葛根素减轻大鼠海马区缺血/再灌注损伤[J].基础医学与临床,2016,36(4):534-536.
[14] Li Q, Li Z, Xu XY, et al. Neuroprotective properties of picroside Ⅱ in a rat model of focal cerebral ischemia[J]. Int J Mol Sci,2010, 11(11): 4580-4590.
[15] Nadia Sharifi Z, Movassaghi S, Mohamadzadeh F, et al. Reduction in ischemic brain injury following the administration of pentoxifylline after transient global ischemia-reperfusion in a rat model[J]. Med J Islam Repub Iran, 2015, 29: 193.
[16] Hu Y, Duan M, Liang S, et al. SenkyunolideⅠ protects rat brain against focal cerebral ischemia-reperfusion injury by upregulating p-Erk1/2, Nrf2/HO-1 and inhibiting caspase-3[J]. Brain Res, 2015, 1605: 39-48.
Neuroprotective effects of puerarin derivative on focal cerebral ischemia and reperfusion and its effect on expression of caspase-3 in rats
ZHANG Hong-wei1,2, ZHANG Fan1, DONG Zhi2, ZHU Yi3
(1. Department of Clinical Pharmacy, Liaocheng City People's Hospital,Liaocheng 252000, China; 2. Teaching and Research Section of Biochemical and Molecular Pharmacology, College of Pharmacy, Chongqing Medical University, Chongqing 400006, China; 3. Hainan Provincial Key Laboratory for Pharmaceutical Quality Research, Hainan Provincial Institute for Drug Control, Haikou 570216, China)
Objective: To observe the protection effect of puerarin derivative (G20) on focal cerebral ischemia and reperfusion injury in rats, and explore whether its mechanism is associated with the expression of caspase-3. Methods: Model of focal cerebral ischemia and reperfusion was induced using an intraluminal monofilament blockade by Longa. The rats were randomly divided into six groups, which were the sham-operation group, the model group, G group (puerarin 25.0 mg·kg-1), G20 groups (12.5,25.0, 50.0 mg·kg-1). The rats in drug groups were administrated drugs in 1.5 h and 6 h after ischemia by tail vein. The neurological deficits were evaluated with neuroethology, the infarction size and brain edema after ischemia, respectively. The pathology of cerebral tissue was evaluated after ischemia by HE dyeing for observing the protective effect of G20. Neuronal apoptosis by TUNEL and the expression of caspase-3 by SABC were used for researching the mechanism. Results: G20 obviously improved movement of neuromuscular and vestibular function in 4 h and 24 h after ischemia, and obviously reduced the infarction size and brain edema,improved pathological morphology of rat brain after cerebral ischemia and reperfusion. Compared with G group, no adverse reaction such as red urine was found in G20 group. G20 decreased neuronal apoptosis and down-regulated the expression of caspase-3 of rats brain after cerebral ischemia and reperfusion. Conclusion: G20 had the protective effect on brain tissue damaged by focal ischemia and reperfusion in rats. The mechanism of G20 may be related to the inhibition of apoptosis by down-regulating the expression of caspase-3.
Puerarin; Puerarin derivative; Focal cerebral ischemia and reperfusion; Apoptosis; Caspase-3
R96
A
1672 - 8157(2016)04 - 0206 - 05
国家自然科学基金面上项目(81173066)
董志,男,教授,博士生导师,主要从事神经药理方面的研究。E-mail:zhidong073@hotmail.com
张宏伟,女,主管药师,主要从事临床药学工作。E-mail:zhhwchq@163.com
2016-04-01
2016-06-17)
