酚妥拉明联合多巴胺治疗新生儿坏死性小肠结肠炎的回顾性研究
2016-09-08刘春义范丽莉
刘春义 范丽莉
·论著·
酚妥拉明联合多巴胺治疗新生儿坏死性小肠结肠炎的回顾性研究
刘春义范丽莉
目的探讨酚妥拉明联合多巴胺(P+D)治疗新生儿坏死性小肠结肠炎的临床效果。方法2014年至2016年医院治疗的43例患儿进行回顾性研究,比较患儿的临床资料、疾病严重程度、平均住院时间和平均禁食时间等。结果胎龄<34周或者出生体重<1 500 g的患儿,P+D组治疗未能明显减少住院时间、禁食时间和需要手术治疗的患儿比例(P>0.05);胎龄>34周或者出生体重>1 500 g的患儿,治疗能明显减少住院时间、禁食时间和需要手术治疗的患儿比例(P<0.05)。结论P+D治疗对胎龄>34周或者出生体重>1 500 g的患儿有明显疗效。
坏死性小肠结肠炎;酚妥拉明;多巴胺;住院时间;禁食时间
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NNE)多见于早产儿,表现为肠道不同程度的损伤,从仅有肠道黏膜受累到肠道全层深度损伤直至穿孔[1]。据加拿大相关机构(Canadian Neonatal Network)调查发现在胎龄小于33周的NNE的概率是5.1%[2];英国在2005至2006年全国医院NICU(Neonatal Intensive Care Unit)中住院的新生儿有2%是坏死性小肠结肠炎患儿[3]。随着医疗和护理技术的进步,越来越多的早产、低体重儿出生,在NICU中发现NNE的几率会越来越大。尽管护理技术在最近几十年有了明显的进步,但是NNE的病死率仍然居高不下,达到30%~50%[4]。痊愈的患儿有一部分出现神经发育迟缓,直接导致患儿和患儿父母家庭生活质量下降、经济负担加重[1]。NNE按照疾病严重程度、使用国际公认的Bell方法分为五级:Ⅰ、ⅡA、ⅡB、ⅢA和ⅢB[5]。从疑似NNE的Ⅰ级到出现穿孔的ⅢB级。临床上对从Ⅰ级到ⅢA级的患儿普遍采取保守治疗方法,包括:禁食、胃肠减压、抗感染、静脉补充液体和营养物质、改善循环功能等方法。如何降低疾病致死率、缩短住院时间、提高患儿痊愈后生活质量是临床研究的关键。酚妥拉明联合小剂量多巴胺的治疗具有扩张血管和改善微循环的功能,在临床治疗中取得了比较好的疗效。2014至2016年我院儿科NICU中治疗的NNE患儿、并接受了酚妥拉明联合小剂量多巴胺治疗的患儿共有25例,没有接受酚妥拉明联合小剂量多巴胺治疗的患儿共有18例。本研究对患儿的临床资料、疾病严重程度、平均住院时间、平均禁食时间进行回顾性研究。
1 资料与方法
1.1一般资料2014至2016年在我院儿科NICU中治疗的NNE患儿、接受了酚妥拉明联合小剂量多巴胺治疗并存活的患儿共25例(P+D组),没有接受酚妥拉明联合小剂量多巴胺治疗并存活的患儿共18例(无P+D组)。NNE患儿按照Bell法对疾病进行分级,患儿的性别、胎龄、出生体重、Apgar评分、坏死性小肠结肠炎评级等临床信息如下所示。见表1。
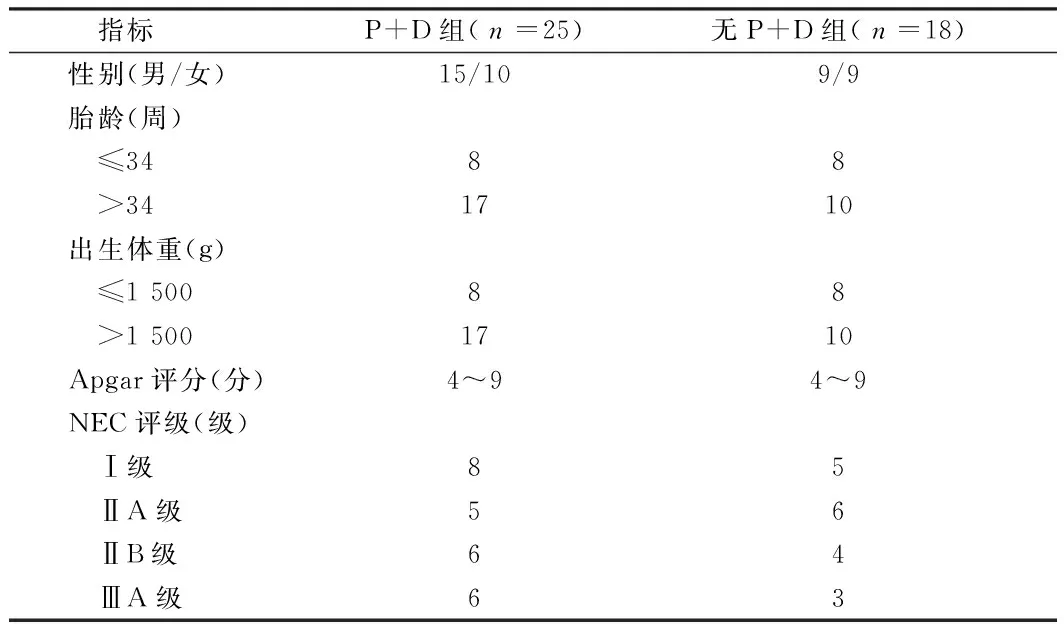
表1 患儿一般资料情况比较 例
1.2治疗方法患儿给予输液泵进行治疗,酚妥拉明药物剂量为1.5 μg·kg-1·min-1,多巴胺药物剂量为2.5 μg·kg-1·min-1,融入到100 ml 5%葡萄糖液中,剂量为每小时5 ml。2组患儿都给予了常规治疗,包括:禁食、胃肠道减压、抗感染和支持治疗。待患儿的肠道恢复正常(无腹胀、无便血、肠鸣音正常)即停止酚妥拉明联合多巴胺治疗,患儿开始接受少量母乳或牛乳喂养,逐渐增加直至完全使用母乳或牛乳喂养。

2 结果
2.12组患儿平均住院时间比较在P+D组中,胎龄<34周和出生体重<1 500 g的患儿,平均住院时间为(20.4±2.5)d,胎龄>34周和出生体重>1 500 g的患儿,平均住院时间为(13.7±1.8)d;在无P+D组中,胎龄<34周和出生体重<1 500 g的患儿,平均住院时间为(21.7±2.8)d;胎龄>34周和出生体重>1 500 g的患儿,平均住院时间为(18.4±2.7)d。在胎龄<34周和出生体重<1 500 g的患儿,P+D组没有明显缩短住院时间(P>0.05);胎龄>34周和出生体重>1 500 g的患儿,P+D组能够明显缩短住院时间(P<0.05)。见表2,图1。

表2 2组患儿平均住院时间比较 ±s
注:与无P+D组比较,*P<0.05

图1 2组患儿平均住院时间比较
2.22组患儿禁食时间比较在P+D组中,胎龄<34周或出生体重<1 500 g的患儿有8例,平均禁食时间是(14.3±2.5)h;胎龄>34周或出生体重>1 500 g的患儿有17例,平均禁食时间是(5.4±0.6)h。在无P+D组中,胎龄<34周或出生体重<1 500 g的患儿有8例,平均禁食时间是(15.3±2.4)h;胎龄>34周或出生体重>1 500 g的患儿有17例,平均禁食时间是(10.6±1.5)h。对于胎龄<34周或出生体重<1 500 g的患儿,P+D组未能明显缩短禁食时间(P>0.05);对于胎龄>34周或出生体重>1 500 g的患儿,P+D组能明显缩短禁食时间(P<0.05)。见表3,图2。
2.32组患儿需要手术治疗比例比较在P+D组中,胎龄<34周或出生体重<1 500 g的患儿有8例,需要手术治疗的有4例,比例为50.0%;胎龄>34周或出生体重>1 500 g的患儿有17例,需要手术治疗的有4例,比例为23.5%。在无P+D组中,胎龄<34周或出生体重<1 500 g的患儿有8例,需要手术治疗的有4例,比例为50.0%;胎龄>34周或出生体重>1 500 g的患儿有10例,需要手术治疗的有4例,比例为40.0%。对于胎龄<34周或出生体重<1 500 g的患儿,P+D组对需要手术治疗的例数没有影响;胎龄>34周或出生体重>1 500 g的患儿,P+D组能够减少需要手术的例数,减少的比例为16.5%(P<0.05)。见表4,图3。
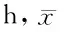
表3 2组患儿禁食时间比较 ±s
注:与无P+D组比较,*P<0.05

图2 2组患儿禁食时间比较

表4 2组患儿需要手术治疗比例比较 %
注:与无P+D组比较,*P<0.05

图3 2组患儿需要手术治疗比较
3 讨论
NNE是一种严重威胁新生儿生命的疾病,患儿主要表现为腹胀、便血、呕吐和休克,X线影像表现为肠壁囊样积气,是在NICU中最常见的急腹症,有的患儿疾病发展迅速,导致穿孔、感染性休克、弥漫性血管内凝血而死亡。NNE病情发展多变、迅速、反复,临床治疗有相当的难度,有时起病隐匿,为该病的诊断带来困难。所以能够尽早确诊,会为患儿带来更多治愈的希望。
酚妥拉明是β受体拮抗剂,能够扩张小动脉和毛细血管,显著降低外周血管阻力,增加心肌收缩力,有助于减轻肠壁水肿和腹胀。多巴胺即可通过兴奋心脏β1受体增加心脏输出量,又能和肠系膜上的多巴胺受体结合增加肠管的血液供应量,有助于改善肠壁损伤。本结果发现:酚妥拉明联合多巴胺治疗对于胎龄<34周或出生体重<1 500 g的患儿没有明显缩短住院时间、禁食时间和减少需要手术的比例(P>0.05);对于胎龄>34周或出生体重>1 500 g患儿能够明显缩短住院时间、禁食时间和减少需要手术的个案比例(P<0.05)。这种现象可以解释为胎龄<34周或体重小于1 500 g的患儿的脏器功能不完善,酚妥拉明和多巴胺不能起到应起的作用。从我们的结果中还可以看出胎龄>34周或出生体重>1 500 g患儿即使没有接受联合治疗,恢复的状况也比低胎龄和低体重儿要好。随着医护水平的提高,超早产儿和低体重儿已经越来越多见了,针对胎龄<34周或体重小于1 500 g的患儿的临床诊疗方案还需要继续摸索。
对NNE的早期诊断能够明显减少致死率。X射线造影结果是诊断NNE的基础,除此以外,多普勒超声可以检测腹腔干动脉和肠系膜上动脉的血流量,不仅可以用来检测肠道的供血状况,还可以用来检测疑似患儿,为早期诊断该病提供证据[6,7]。近红外光谱学(near-infrared spectroscopy)被认为能够实时反映组织供氧状况,为NNE的早期诊断提供新的选择[8,9]。
在需要手术治疗的患儿中有40%不能根据临床资料作出穿孔的预判,这也是该病致死率居高不下的一个主要原因。研究人员在不断的尝试发现能够预测坏死性小肠结肠炎的生物因子,平滑肌actin蛋白、脂肪酸结合蛋白(fatty acid binding protein)、白介素8(Interleukin 8)被认为能够起到预测的作用[10]。
对于胎龄<34周或出生体重<1 500 g的患儿应该从预防入手,预防性肠内益生菌和合生素的使用能够降低患坏死性小肠结肠炎的几率[11]。在NEC动物模型和少范围临床试验上使用可控的低温手段可以预防肝衰竭、较少中性粒细胞在肺部和肠道的浸入、延长存活期[12]。在NEC大鼠模型上使用腹腔注射干细胞,干细胞可以整合到肠壁上,可以减少肠壁损伤,提高存活率[13]。可控的低温手段已经在临床上使用,治疗效果还有待观察。
本回顾性研究只是针对患儿在住院期间的临床资料,对于患儿出院以后的情况没有收入研究内。
本研究建议在临床治疗NNE的患儿时,在患儿的胎龄>34周或出生体重>1 500 g时,及早使用酚妥拉明联合多巴胺治疗会明显缩短住院时间、禁食时间和减少手术治疗几率。
1Neu J, Walker WA.Necrotizing enterocolitis. N Engl J Med,2011,364: 255-264.
2Yee WH, Soraisham AS, Shah VS, et al. Incidence and timing ofpresentation of necrotizing enterocolitis in preterm infants. Pediatrics,2012,129:e298-e304.
3Rees CM, Eaton S, Pierro A. National prospective surveillance study ofnecrotizing enterocolitis in neonatal intensive care units. J Pediatr Surg,2010,45: 1391-1397.
4Rees CM, Pierro A, Eaton S. Neurodevelopmental outcomes of neonates withmedically and surgically treated necrotizing enterocolitis. Arch DisChild FetalNeonatal Ed,2007,92: F193-198.
5Hall NJ, Eaton S, Pierro A. Royal Australasia of Surgeons Guest Lecture.Necrotizing enterocolitis: prevention, treatment, and outcome.J Pediatr Surg, 2013,48:2359-2367.
6Faingold R, Daneman A, Tomlinson G, et al. Necrotizing enterocolitis:assessment of bowel viability with color doppler US. Radiology,2005,235:587-594.
7Yikilmaz A, Hall NJ, Daneman A, et al. Prospective evaluation of the impact of sonography on the management and surgical intervention of neonates withnecrotizing enterocolitis. Pediatr Surg Int,2014,30:1231-1240.
8Sylvester KG, Ling XB, Liu GY, et al. A novel urine peptide biomarker-based algorithm for the prognosis of necrotising enterocolitis in human infants. Gut,2014,63:1284-1292.
9Evennett N, Cerigioni E, Hall NJ, et al. Smooth muscle actin as a novel serologicmarker of severe intestinal damage in rat intestinal ischemia-reperfusion andhuman necrotising enterocolitis. J Surg Res,2014,191:323-330.
10Ng EW, Poon TC, Lam HS et al.Gut-associated biomarkers L-FABP, I-FABP, and TFF3 and LIT score for diagnosis of surgical necrotizing enterocolitis in preterm infants.Ann Surg,2013,258:1111-1118.
11AlFaleh K, Anabrees J.Probiotics for prevention of necrotizing enterocolitisin preterm infants.Cochrane Database Syst Rev,2014,4:CD005496.
12Stefanutti G, Pierro A, Parkinson EJ, et al. Moderate hypothermia as a rescue therapy against intestinal ischemia and reperfusion injury in the rat.Crit Care Med,2008,36:1564-1572.
13Zani A, Cananzi M, Fascetti-Leon F, et al. Amniotic fluid stem cells improve survival and enhance repair of damaged intestine in necrotising enterocolitisvia a COX-2 dependent mechanism.Gut,2014,63:300-309.
10.3969/j.issn.1002-7386.2016.17.034
050031石家庄市,河北省儿童医院
R 574.621
A
1002-7386(2016)17-2672-03
2016-02-19)
