柔毛水杨梅对人微血管内皮细胞增殖、迁移、成管能力的影响
2016-09-08刘城宋雨鸿王月刚裴静娴赖艳娴申艳
刘城, 宋雨鸿, 王月刚, 裴静娴, 赖艳娴, 申艳
(广州市第一人民医院心血管内科,广东广州 510180)
柔毛水杨梅对人微血管内皮细胞增殖、迁移、成管能力的影响
刘城,宋雨鸿,王月刚,裴静娴,赖艳娴,申艳
(广州市第一人民医院心血管内科,广东广州510180)
【目的】 研究柔毛水杨梅对人微血管内皮细胞增殖、迁移、成管能力的影响。【方法】将不同浓度(0~200 ng/mL)柔毛水杨梅作用于人微血管内皮细胞(HMVEC-Ls),分别采用MTS法检测细胞的增殖活性,划痕法检测细胞的迁移能力,Matrigel法检测细胞的成管能力以及Western blot法验证低氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)、端粒酶逆转录酶(TERT)的表达水平。【结果】MTS结果显示:柔毛水杨梅与HMVEC-Ls共同培养7 d,25~200 ng/mL不同浓度组均可促进HMVEC-Ls增殖,与对照组(0 ng/mL)比较,差异均有统计学意义(P<0.05),以100 ng/mL组促进HMVEC-Ls增殖能力最显著(P<0.05)。划痕实验结果显示:与对照组比较,50~150 ng/mL组HMVEC-Ls迁移率显著增大,差异均有统计学意义(P<0.05),以150 ng/mL组HMVEC-Ls迁移率最高。成管实验结果:与对照组比较,50~150 ng/mL组HMVECLs成管长度显著增加,差异均有统计学意义(P<0.05),亦以150 ng/mL组HMVEC-Ls成管长度最大。Western blot检测结果:与对照组比较,150 ng/mL柔毛水杨梅浓度组HIF-1α、TERT和VEGF表达均显著升高(P<0.05)。【结论】柔毛水杨梅可通过促进人微血管内皮细胞增殖、迁移、管样形成而发挥促血管新生效应,其机制可能与HIF-1α-TERT-VEGF途径介导的血管新生有关。
柔毛水杨梅;人微血管内皮细胞;血管新生;细胞培养
血管新生是机体对组织缺氧的一个适应性反应,在一系列的生理和病理过程中发挥重要作用,如:胚胎发育、伤口愈合、炎症、肿瘤生长和血管瘤的形成等[1]。促血管新生已成为缺血性血管疾病(如:冠心病、缺血性脑血管病以及外周血管病)的治疗新方向[2]。柔毛水杨梅(Geum japonicum Thunb. var.chinense F.Bolle,GJ)是蔷薇科路边青属植物,性寒,味苦、辛,功能补肾平肝、活血消肿,目前还发现其具有较强的促血管新生效能,但国内外对柔毛水杨梅的促血管新生研究相对较少。本研究拟通过观察柔毛水杨梅对体外培养的人微血管内皮细胞(HMVEC-Ls)增殖、迁移、成管能力的影响,并同时对低氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)、端粒酶逆转录酶(TERT)等促血管新生基因或相关基因表达的影响,以期初步探讨柔毛水杨梅促血管新生的机制,现报道如下。
1 材料和方法
1.1药物、试剂与仪器柔毛水杨梅为柔毛水杨梅全草(购自贵州省贵阳市孟关地区)的甲醇提取物[3];HMVEC-Ls及其专用培养基(美国Clonetics公司);CellTiter 96 Assay MTS/PES试剂盒(美国Promega公司);Growth factor-reduced Matrigel(美国BD Bioscience公司);鼠抗人β-actin单克隆抗体(美国Santa Cruz公司);鼠抗人HIF-1α、TERT 及VEGF单克隆抗体(美国Chemicon公司),2.5 g/L胰酶溶液 [不含乙二胺四乙酸二钠(ethylene diamine tetraacetic acid,EDTA)]/(含EDTA)(美国Gibco公司);细胞用1285型生物安全柜(美国Thermo公司);TS100-F型倒置显微镜(日本Nikon公司);Z2型细胞计数仪(美国Beckman Coulter公司);550伯乐550酶标仪(美国Bio-Rad公司);全自动Western blot实验系统(美国ProteinSimple公司)。
1.2细胞增殖评价96孔板中以2.0×103cells/孔的密度铺板。8 h后换成HMVEC-Ls专用培养基维持24 h,将柔毛水杨梅用HMVEC-Ls专用培养基(不含FBS和生长因子)进行不同浓度梯度的倍比稀释后每孔加入100 μL,使终浓度分别为0、25、50、75、100、150、200 ng/mL,种植在96孔培养板中,每组实验重复3次,每组每次为6个孔,分别于接种后的第7天应用MTS/PES试剂盒测细胞增殖率。在Bio-Rad 550型酶标仪于490 nm波长处测量吸光度(D),细胞增殖能力用细胞增殖率表示:p细胞增殖(%)=D给药组/D对照组×100%。
1.3划痕实验将HMVEC-Ls以1.0×104cells/皿的密度接种于35 mm培养皿内,并置于37℃、体积分数5%CO2饱和湿度培养箱内培养72 h以形成完全融合的单细胞层,于白纸上每隔3 mm划平行线,将完全融合的HMVEC-L培养皿置于其上,使用200 μL无菌吸头沿线进行划痕;然后用PBS轻轻洗去脱落细胞碎片,用分别含有0、50、100、150 ng/mL柔毛水杨梅的HMVEC-Ls专用培养基(不含FBS和生长因子)并置于37℃、体积分数5%CO2饱和湿度中继续培养;于12 h后拍照并使用图像分析软件IPP 6.1分析。细胞迁移能力以迁移率表示:p细胞迁移(%)=(原划痕面积-残留面积)/原划痕面积×100%。
1.4成管实验将Matrigel基质胶及96孔板置于4℃冰箱中过夜,向预冷的96孔板中加入Matrigel基质胶,每孔80 μL,37℃放置 2 h成胶。将HMVEC-Ls以1.0×104cells/孔的密度接种于预先由Matrigel基质胶包被的96孔板中并置于37℃体积分数5%CO2孵箱中培养;待细胞贴壁后,立即更换为含有0、50、100、150 ng/mL柔毛水杨梅的HMVEC-Ls专用培养基(不含FBS和生长因子)继续培养;于12 h后在光学显微镜下观察管样结构并用图像分析软件IPP 6.1分析。细胞成管能力以每视野(×100)下所有管样结构长度之和表示:l成管(mm/视野)=Σ(l1+l2+…+ln)/视野。
1.5Western blot检测HIF-1α、TERT、VEGF的表达HMVEC-Ls以1×105接种到75 cm2培养瓶并置于37℃、体积分数5%CO2细胞培养箱中继续培养,8 h后更换为HMVEC-Ls专用培养基(体积分数2%FBS,不含生长因子)继续培养;24 h后再次更换为分别含有0、50、100、150 μg/mL柔毛水杨梅的HMVEC-Ls专用培养基(2%FBS,不含生长因子)继续培养;96 h后分别收集细胞,用预冷的RIPA液裂解细胞,离心后,取上清测蛋白浓度,进行Western blot检测。结果采用光密度扫描仪扫描、影像软件Gel-pro analysis分析,用目的条带的灰度值代表表达量,灰度值=面积×密度。
1.6统计方法采用SPSS 20.0统计软件,应用One-way ANOVA方差分析。方差齐性时组间比较采用LSD法,方差不齐时采用Games-Howell检验。
2 结果
2.1柔毛水杨梅对HMVEC-Ls增殖的影响如图1所示,将不同浓度的柔毛水杨梅与HMVEC-Ls共同孵育7 d后,不同浓度柔毛水杨梅均能显著促进HMVEC-Ls增殖(P<0.05)。当柔毛水杨梅浓度<100 ng/mL时,HMVEC-Ls的细胞生长率随柔毛水杨梅浓度的增加而增高(P<0.05),呈明显的浓度依赖关系。但当柔毛水杨梅浓度>100 ng/mL后,HMVEC-Ls的细胞生长率显著下降(P<0.05)。

图1 不同浓度柔毛水杨梅对HMVEC-Ls增殖的影响Figure 1 Effects of GJ at various concentrations on HMVEC-Ls proliferation (±s,n=6)
2.2柔毛水杨梅对HMVEC-Ls迁移的影响图2、图3结果显示:与0 ng/mL柔毛水杨梅组比较,50、100、150 ng/mL柔毛水杨梅组HMVEC-Ls迁移率显著增大,差异均有统计学意义(P<0.05),且以150 ng/mL柔毛水杨梅组迁移能力最强(P<0.05)。说明柔毛水杨梅能促进HMVEC-Ls迁移,且促HMVEC-Ls迁移的能力随浓度增加而增强。

图2 不同浓度柔毛水杨梅对HMVEC-Ls迁移的形态学观察(×100)Figure 2 The histological feature of HMVEC-Ls migration affected by different concentrations of GJ(×100)
2.3柔毛水杨梅对HMVEC-Ls成管的影响图4结果显示:HMVEC-Ls细胞接种于Matrigel基质胶后起始呈圆形或卵圆形,1~2 h后各浓度柔毛水杨梅组HMVEC-Ls细胞逐渐伸展开并伸出突起,4~5 h后相邻突起相互连接形成小管样结构。图5结果显示:与0 ng/mL柔毛水杨梅组比较,50、100、150 ng/mL柔毛水杨梅组成管长度显著增加,差异均有统计学意义(P<0.05),且以150 ng/mL柔毛水杨梅组成管长度最长(P<0.05)。表明柔毛水杨梅能促HMVEC-Ls成管,且促HMVEC-Ls成管的能力随浓度增加而增强。
2.4柔毛水杨梅对HIF-1α、TERT及VEGF表达的影响图6、图7结果显示:与0 ng/mL柔毛水杨梅组比较,50、100、150 ng/mL柔毛水杨梅组HIF-1α蛋白表达显著增加,差异均有统计学意义(P<0.05)。同时,与0、50 ng/mL柔毛水杨梅组比较,100、150 ng/mL柔毛水杨梅组TERT的表达亦显著增加,差异均有统计学意义(P<0.05)。而150 ng/mL柔毛水杨梅组VEGF的表达显著高于0、50、100 ng/mL柔毛水杨梅浓度组(均P<0.05)。而且在150 ng/mL柔毛水杨梅组,HIF-1α、TERT及VEGF的表达均最强。
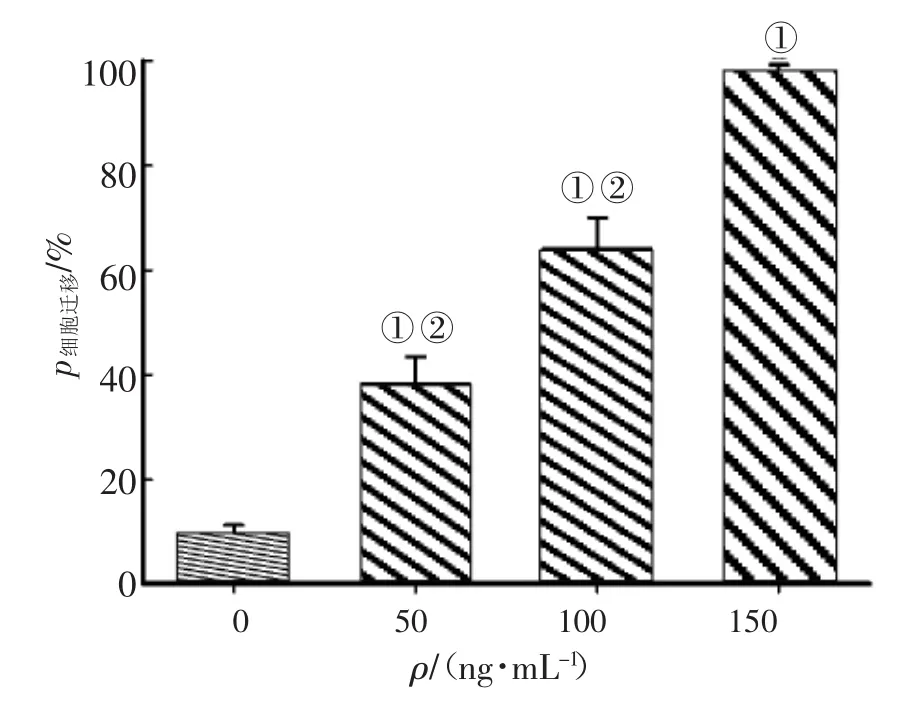
图3 不同浓度柔毛水杨梅对HMVEC-Ls迁移的影响Figure 3 Effects of GJ at various concentrations on HMVEC-Ls migration (±s,n=6)

图4 不同浓度柔毛水杨梅对HMVEC-Ls成管的形态学观察(×100)Figure 4 The histological feature of HMVEC-Ls tube formation affected by different concentrations of GJ(×100)

图5 不同浓度柔毛水杨梅对HMVEC-Ls成管的影响Figure 5 Effects of GJ at various concentrations on HMVEC-Ls tube formation (±s,n=6)

图6 不同浓度柔毛水杨梅下HIF-1α、TERT 及VEGF蛋白表达的变化Figure 6 Protein expression levels of HIF-1α,TERT and VEGF in HMVEC-Ls treatd with GJ at various concentrations

图7 不同浓度柔毛水杨梅对HIF-1α、TERT及VEGF表达的影响Figure 7 Effects of GJ at various concentrations on the expression levels of HIF-1α,TERT and VEGF
3 讨论
缺血性血管疾病的预后与相应缺血区域内靶血管的侧支循环状况密切相关,近年来在缺血性血管疾病的防治从单纯改变病变血管供血转向如何促进侧支循环建立,中药促血管新生治疗有望为促侧支循环的建立开辟新的途径,成为目前缺血性血管疾病治疗中具有发展前景的新方向[2]。血管生成是一个复杂的过程,涉及血管内皮细胞的活化、增殖、迁移、管样形成以及毛细血管发芽等过程[4],仅依靠单一的促血管新生因子很难完成[5]。HIF-1α作为一个重要的核转录因子,能直接或间接地调控VEGF等100多种下游促血管新生靶基因参与血管新生过程,具有“总开关”的特点,是血管新生的中心环节[6]。筛选出一种中药能激活HIF-1α并经HIF-1α诱导血管新生途径促血管新生,且弄清其分子调控机制是未来研究的主要方向。本研究发现:在不同浓度柔毛水杨梅的作用下,HMVEC-Ls的增殖、迁移、成管能力增加,且具有浓度依赖性,这表明柔毛水杨梅具有较强的促血管新生的活性,在治疗性血管新生领域具有良好研发前景,但其机制仍不清楚。
HIF-1与下游促血管新生靶基因的VEGF组成的HIF-1α-VEGF途径在血管新生的病理生理过程中最具有代表性[7]。另外一方面,最初认为机体内所有内皮细胞都是均质的,但实质上内皮细胞间还具有功能的异质[8]。尤其是在病理状态下(如缺血性血管疾病),血管内皮细胞会出现老化和功能减弱[9],而通过端粒酶激活可以逆转这种衰老、增加增殖能力[10]。TERT基因的表达水平对端粒酶的活性起关键作用[11]。现有研究发现低氧条件下HIF-1α直接介导TERT表达上调[12],且TERT在VEGF诱导的血管新生中起“催化剂”的作用[13]。由此推论:柔毛水杨梅可能经HIF-1α-TERTVEGF途径促血管新生。为验证前述假设,本研究运用Western blot等分子生物学实验方法,发现柔毛水杨梅能上调HIF-1α表达,而作为HIF-1α下游促血管新生靶基因的VEGF,其表达则随HIF-1α的表达上调而上调。与此同时,治疗性血管新生中维护靶细胞微血管内皮细胞功能的关键因素——TERT的表达在该过程中亦上调,且与其上调HIF-1α、VEGF表达具有一致性。说明柔毛水杨梅促血管新生效应与HIF-1α-TERT-VEGF途径诱导的血管新生有关。然而,HIF-1α、TERT、VEGF之间的调节关系目前仍不清楚,需要进一步深入研究。
综上所述,柔毛水杨梅可通过调节血管内皮细胞的活化、增殖、迁移、管样形成从而发挥促血管新生效应,为治疗性血管新生带来新希望。
[1]Fong G H.Mechanisms of adaptive angiogenesis to tissue hypoxia [J].Angiogenesis,2008,11(2):121.
[2]郭浩,李磊,侯金才,等.中药促治疗性血管新生防治缺血性心脑血管疾病的研究进展[J].中国中药杂志,2015,40(1):24
[3]李建宽,刘宏伟,王乃利,等.柔毛水杨梅的化学成分[J].沈阳药科大学学报,2006,23(11):694.
[4]Kalkunte S,Brard L,Granai C O,et al.Inhibition of angiogenesis by vitamin D-binding protein:characterization of anti-endothelial activity of DBP-maf[J].Angiogenesis,2005,8(4):349.
[5]吴平生,刘城,陶宇.促血管新生治疗的现状与展望[J].中国医学前沿杂志(电子版),2010,2(3):9.
[6]Weidemann A,Johnson R S.Biology of HIF-1alpha[J].Cell Death Differ,2008,15(4):621.
[7]Masoud G N,Li W.HIF-1alpha pathway:role,regulation and intervention for cancer therapy[J].Acta Pharm Sin B,2015,5(5):378.
[8]Muller A M,Hermanns M I,Cronen C,et al.Comparative study of adhesion molecule expression in cultured human macro-and microvascular endothelial cells[J].Exp Mol Pathol,2002,73 (3):171.
[9]Kroenke C H,Pletcher M J,Lin J,et al.Telomerase,telomere length,and coronary artery calcium in black and white men in the CARDIA study[J].Atherosclerosis,2012,220(2):506.
[10]Chang H,Rha S Y,Jeung H C,et al.Telomerase-and angiogenesis-related gene responses to irradiation in human umbilical vein endothelial cells[J].Int J Mol Med,2013,31 (5):1202.
[11]Yu Y F,Zhang Y,Shen N,et al.Effect of VEGF,P53 and telomerase on angiogenesis of gastric carcinoma tissue[J].Asian Pac J Trop Med,2014,7(4):293.
[12]Nishi H,Nakada T,Kyo S,et al.Hypoxia-inducible factor 1 mediates upregulation of telomerase(hTERT)[J].Mol cell biol,2004,24(13):6076.
[13]Hartwig F P,Nedel F,Collares T V,et al.Telomeres and tissue engineering:the potential roles of TERT in VEGF-mediated angiogenesis[J].Stem cell reviews,2012,8(4):1275.
【责任编辑:黄玲】
Effect of Geum japonicum Thunb.var.chinense F.Bolle on Proliferation,Migratio and Tube Formation of Human Microvascular Endothelial Cellsin Vitro
LIU Cheng,SONG Yuhong,WANG Yuegang,PEI Jingxian,LAI Yanxian, SHEN Yan
(Dept.of Cardiology,Guangzhou First People’s Hospital,Guangzhou 510180 Guangdong,China)
ObjectiveTo study the effects of Geum japonicum Thunb.var.chinense F.Bolle(GJ)on the proliferation,migration and tube formation of human microvascular endothelial cells(HMVEC-Ls)in vitro. Methods The HMVEC-Ls were treated with different concentrations of GJ methanol extract.HMVEC-Ls proliferation,migration and tube formation were measured by MTS assay,wound-healing cell migration assay and Matrigel assay,respectively.The effect of GJ methanol extract on the expression levels of hypoxia inducible factor 1α(HIF-1α),telomerase reverse transcriptase(TERT)and vascular endothelial growth factor(VEGF)were detected by Western blotting method.Results MTS results showed that HMVEC-Ls proliferation index in 25-200 ng/mL of GJ groups was increased(P<0.05 as compared with that of the control group),the effect of 100 ng/mL of GJ group being the best.HMVEC-Ls migration ratio in 50-150 ng/mL of GJ groups was enhanced(P<0.05 as compared with that of the control group),the effect of 150 ng/mL of GJ group being the best.The tube length of HMVEC-Ls in 50-150 ng/mL of GJ groups was enhanced(P<0.05 as compared with that of the control group),the effect of 150 ng/mL of GJ group being the best.In addition,HIF-1α,TERT and VEGF protein expression levels were also significantly up-regulated by GJ(P<0.05).Conclusion GJ can promote HMVEC-Ls proliferation,migration and tube formation,and the mechanism is related with angiogenesis mediated by HIF-1α-TERT-VEGF pathway.
Geum japonicum Thunb.var.chinense F.Bolle(GJ);human microvascular endothelial cells (HMVEC-Ls);angiogenesis;cell culture
R285.5
A
1007-3213(2016)04-0551-05
10.13359/j.cnki.gzxbtcm.2016.04.025
2016-02-12
刘城(1981-),男,副主任医师;E-mail:adrian_liu@msn.cn
国家自然科学基金资助项目(编号:81100235)
