早期中药配合肠内营养与单纯肠外营养对食管癌术后患者血缩胆囊素及T细胞亚群的影响
2016-09-08叶文锋娄宁丘惠娟张蓓
叶文锋, 娄宁, 丘惠娟, 张蓓
(华南肿瘤学国家重点实验室//中山大学肿瘤防治中心,广东广州 510060)
早期中药配合肠内营养与单纯肠外营养对食管癌术后患者血缩胆囊素及T细胞亚群的影响
叶文锋,娄宁,丘惠娟,张蓓
(华南肿瘤学国家重点实验室//中山大学肿瘤防治中心,广东广州510060)
【目的】探讨中药配合肠内营养与单纯肠外营养支持对食管癌术后患者血缩胆囊素及T细胞亚群的影响。【方法】收集147例食管癌术后患者,按不同主诊治疗分为中药配合肠内营养组75例、肠外营养组72例。2组患者均于术后第1天开始进行营养支持,持续8 d,患者的营养需要量根据Harris-Benedict公式供给。在术前及术后第8天分别测定血缩胆囊素、T细胞亚群(CD4、CD8及CD56)水平。【结果】术后第8天,2组患者血缩胆囊素水平均较术前下降,中药配合肠内营养组显著高于肠外营养组(P<0.05);中药配合肠内营养组患者CD4/CD8比值较术前明显升高,且显著高于肠外营养组(P<0.05);2组患者CD4、CD56水平与术前比较均有下降,且中药配合肠内营养组显著高于肠外营养组(P<0.05)。【结论】早期中药配合肠内营养可有效维持食管癌术后患者血缩胆囊素和T细胞亚群的水平。
食管癌;肠内营养;肠外营养;缩胆囊素;淋巴细胞亚群
目前,临床营养支持的目的已不再是单纯地从改善患者营养状况出发,而是要保护与支持患者器官、组织的结构和功能,维护细胞的正常代谢,参与机体的生理功能和免疫功能的调控与修复[1-5]。研究表明,食管癌患者存在细胞免疫改变,表现为自然杀伤细胞(NK细胞)活性明显受到抑制、辅助细胞与抑制细胞比值(CD4/CD8比值)降低[6-7];而且,食管癌手术后除淋巴细胞总数降低外,CD4/CD8比值也明显下降[8]。肠内营养与肠外营养对食管癌术后营养状况的维持差别不大[1],但不同营养支持方式对食管癌患者及其术后细胞免疫状态的影响仍存在争议。有研究提示肠内营养可改善患者细胞免疫功能状况[4]。缩胆囊素是一种小肠激素,是胆囊收缩和胰酶分泌的主要调节物之一,能增加淋巴细胞和单核细胞内的钙离子,并且它是一种淋巴细胞的辅助分裂素[9-10]。肠内营养能使缩胆囊素升高,可以起到上调肠道免疫反应的作用,肠外营养使缩胆囊素降低,会减少炎症介质的产生下降的趋势[9-12]。基于上述研究,本研究观察早期中药配合肠内营养及单纯肠外营养对食管癌术后患者血缩胆囊素及T细胞亚群的影响,以期初步探讨该2种营养支持方式的生理、免疫调控机制,现将结果报道如下。
1 材料与方法
1.1研究对象
本研究病例均来自中山大学肿瘤防治中心胸科2014年9月至2015年6月期间被诊断为食管癌或食管胃交界癌且可行手术切除的患者147例,按不同主诊治疗分为中药配合肠内营养组(75例)和肠外营养组(72例)。
1.2诊断标准所有患者在手术前均行食管镜活检或涂片取得病理学依据。
1.3纳入标准
①潜在可切除的食管癌或食管胃交界癌患者; ②未行抗肿瘤治疗的初治患者;③预计生存期大于6个月;④年龄18~70岁;⑤白细胞≥4.0×109/L,中性粒细胞≥1.5×109/L,血小板≥100.0×109/L, 血红蛋白 ≥ 90 g/L;⑥肝肾功能正常;⑦卡氏(KPS)功能状态评分>90分。
1.4排除标准
①已行抗肿瘤治疗(包括化疗、放疗、手术);②已经存在或合并存在出血性疾病者;③其他不可控制的不可手术的患者;④处于怀孕期或哺乳期的女性患者;⑤由于以往手术导致本次手术不能应用胃代食管重建消化道者;⑥有10年以上糖尿病史,血糖水平控制不满意的患者;⑦入组前除食管癌外有其他恶性肿瘤病史的患者,非黑色素瘤的皮肤癌,原位宫颈癌,或治愈的早期前列腺癌除外;⑧有严重心、肺、肝、肾功能不良,造血系统疾病、免疫系统疾病、恶病质等不可耐受手术治疗的患者。
1.5治疗方法
2组患者均于术后第1天开始进行营养支持,持续8 d,患者的营养需要量根据Harris-Benedict公式[13]供给。
1.5.1肠外营养组给予腔静脉置管进行肠外营养,使用量按患者的营养需要量供给。其方法是通过穿刺锁骨下静脉或颈内静脉,向近心端插入导管,使其头端达上腔静脉起始部。肠外营养配方由葡萄糖、脂肪乳、氨基酸、电解质、水溶性维生素、脂溶性维生素及微量元素按需要量组成。
1.5.2中药配合肠内营养组在术中置入十二指肠营养管或空肠造瘘管,每天注入肠内营养乳剂(TPF-T),使用量按患者的营养需要量供给;再注入溶解后的中药颗粒,其处方组成:党参15 g、白术15 g、茯苓15 g、黄芪30 g、陈皮6 g、法夏12 g、佛手12 g、鸡内金15 g、麦芽30 g、布渣叶12 g、山楂6 g、甘草6 g,日1剂。
1.6观察指标及检测
术前及术后第8天分别抽取患者血液样本,测定T淋巴细胞亚群、缩胆囊素。采用流式细胞仪(FACSCalibur流式细胞仪,美国BD公司)测定T淋巴细胞亚群,包括CD4、CD8及CD56。采用竞争放射免疫测定方法(RIA)测定血缩胆囊素。
1.7统计处理
采用SPSS 13.0统计软件进行数据的统计分析。计量资料以均数 ±标准差(±s)表示,采用组间及组内样本t检验,计数资料采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.12组患者一般资料比较
表1结果显示:2组患者年龄、性别、临床分期、病理分型等比较,差异均无统计学意义(P>0.05),具有可比性。
2.22组机体营养与内脏蛋白变化情况
表2结果显示:中药配合肠内营养组与肠外营养组术前、术后第8天红细胞数(RBC)、血红蛋白(HB)、总蛋白(TP)、白蛋白(ALB)和球蛋白(GLO)比较,差异均无统计学意义(P>0.05)。结果说明,中药配合肠内营养在维护食管癌术后患者机体营养与蛋白状况方面与肠外营养作用相当。

表1 患者临床资料Table 1 General data of the two groups
表2 2组患者手术前后机体营养与蛋白状况水平的比较Table 2 Comparison of nutrition and protein levels in the two groups before and after operation (±s)

表2 2组患者手术前后机体营养与蛋白状况水平的比较Table 2 Comparison of nutrition and protein levels in the two groups before and after operation (±s)
?
2.32组缩胆囊素的变化
表3结果显示:食管癌患者术前缩胆囊素高于正常水平(正常健康人的正常值是在空腹时≤1.12 pmol/L[14])。术前,2组患者缩胆囊素水平比较,差异无统计学意义(P>0.05)。术后第8天,2组患者缩胆囊素水平均有降低的趋势,但中药配合肠内营养组与术前比较,差异无统计学意义(P>0.05),而肠外营养组与术前比较,差异有统计学意义(P<0.05)。术后中药配合肠内营养组显著高于术后肠外营养组(P<0.05),说明中药配合肠内营养支持可有效维持食管癌术后患者血缩胆囊素水平。
表3 2组患者手术前后血缩胆囊素水平的比较Table 3 Comparison of cholecystokinin level in the two groups before and after operation [±s,c/(pmol·L-1)]
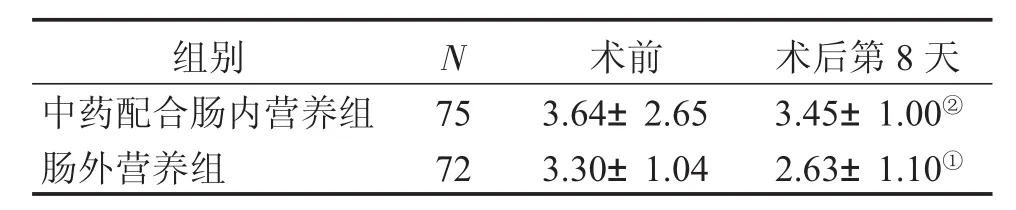
表3 2组患者手术前后血缩胆囊素水平的比较Table 3 Comparison of cholecystokinin level in the two groups before and after operation [±s,c/(pmol·L-1)]
①P<0.05,与同组术前比较;②P<0.05,与肠外营养组比较
?
2.42组T淋巴细胞亚群的变化
表4结果显示:术前,2组患者CD4、CD8、CD4/CD8比值、CD56水平比较,差异均无统计学意义(P<0.05)。中药配合肠内营养组患者CD4在术后第8天恢复到术前水平,显著高于术后肠外营养组(P<0.05)。2组患者术后CD8水平均低于术前,2组比较差异无统计学意义(P>0.05)。中药配合肠内营养组患者CD4/CD8比值较术前显著升高(P<0.05),且显著高于术后肠外营养组(P <0.05)。2组患者术后CD56均低于术前,肠外营养组降低更明显,中药配合肠内营养组显著高于肠外营养组(P<0.05)。结果表明,中药配合肠内营养可有效维持食管癌术后患者血CD4/CD8比值及CD4、CD56水平。
表4 2组患者手术前后血T细胞亚群水平的比较Table 4 Comparison of T-cell subsets in the two groups before and after operation (±s)

表4 2组患者手术前后血T细胞亚群水平的比较Table 4 Comparison of T-cell subsets in the two groups before and after operation (±s)
①P<0.05,与肠外营养组比较;②P<0.05,与同组术前比较
组别 N pCD4/% pCD8/% pCD4/CD8 pCD56/%中药配合肠内营养组肠外营养组75 72术前33.5±8.1 34.5±10.0术后第8天33.8±10.7①23.1±10.2②术前27.7±7.8 28.5±8.3术后第8天21.6±7.2②22.3±7.5②术前1.21±0.51 1.21±1.36术后第8天1.56±0.64①②1.03±0.86②术前19.7±10.9 20.5±11.4术后第8天18.3±8.0①13.2±8.2②
3 讨论
研究发现,在肿瘤发展的过程中,细胞免疫受到抑制,而体液免疫则没有受到影响[15-16]。食管癌患者在治疗前对植物血凝素(PHA)反应和NK细胞活性都明显地受到抑制,CD4/CD8比值降低、PHA反应和NK细胞活性在Ⅳ期的患者中受抑制的程度甚于Ⅰ至Ⅲ期的患者[18]。目前认为,外科手术同样可导致机体的细胞免疫功能状况受到抑制。食管癌切除手术的患者,在术后2~3周,免疫球蛋白和补体仍低于术前水平,CD3和CD8在术后也有明显的降低,而CD19、CD4/CD8比值则有明显的增加。Athlin等[19]发现,进行外科手术的创伤病人,术后往往有巨噬细胞的功能抑制。Tsutsui等[20]发现,在食管癌手术后除了淋巴细胞总数降低外,CD4/CD8比值下降,PHA反应与NK细胞活性降低均不明显。本课题前期研究[21]结果也显示:食管癌手术患者在术后表现为CD4、CD8及CD56 (NK细胞)水平降低,而CD4/CD8比值通过术后肠内营养则明显上升,而术后肠外营养并不能改变这种下降趋势。
肠内营养作为癌症患者的一种营养支持治疗手段,已越来越广泛地应用于临床,以预防和纠正患者的营养不良。肠内营养的优点是符合人体生理,应用过程中操作方便、经济等。本课题前期研究[21]结果显示:食管癌患者在术后早期进行肠内营养有良好的效果,但患者在应用时,往往出现恶心、呕吐、早饱感、腹胀等症状与体征,使患者不愿意使用,从而影响患者营养状况的改善。蔡骏等[22]应用中药四君子汤辅助肠内营养能进一步改善胃癌术后机体的细胞免疫功能及部分体液免疫功能。王宏星等[23]在胃癌术后以中药八珍汤加减辅助肠内营养能进一步促进生长激素水平提高,改善机体营养状况和免疫功能情况。本研究采用的方剂组成中,党参、白术、茯苓、甘草补气健脾为主,加上黄芪更增强补气之功;佛手、陈皮、法夏和胃行气止呕;鸡内金、麦芽、布渣叶、山楂开胃消滞。全方配伍,共奏补气健脾、和胃消滞、行气止呕之功。
术后肠内营养是通过什么途径来改善食管癌术后患者的细胞免疫水平?本研究结果显示:术后肠内营养能较好地保持血液中缩胆囊素的水平。缩胆囊素的生物学作用是刺激胆囊收缩、胰酶分泌,增强胰腺外分泌胰激酶诱导水和碳酸氢盐的分泌作用,抑制胃排空。研究发现,肠外营养会减少十二指肠和空肠中含缩胆囊素细胞的数目[24]。Fan等[25]报告,肠外营养会减弱胰腺对缩胆囊素的增生反应,在肠外营养过程中缩胆囊素的作用反而减弱,提示缩胆囊素对胰腺外分泌的影响似乎需要通过肠内营养才能完全表达出来。Lucas等[26]在婴儿中发现,用少量的肠内营养对已经用了长时间肠外营养的病人有临床治疗的效果,这主要体现在肠激素水平的提高。McMillen等[27]研究认为,肠内营养往往与免疫功能的增强有关,缩胆囊素及其激动剂对外周血单核细胞、淋巴细胞内离子钙和淋巴细胞有丝分裂均有影响时,发现缩胆囊素八肽能引起外周血单核细胞和T辅助淋巴细胞的离子钙内流增加,从而认为缩胆囊素八肽可能是引起淋巴细胞钙离子内流激动信号的辅助调节因素,因此认为肠内营养所引起的免疫功能增强,至少部分是由于缩胆囊素水平的增加而介导产生。
综上所述,早期中药配合肠内营养可维持及改善食管癌术后患者的细胞免疫状态,其作用可能是通过较好地保持血液中的缩胆囊素的水平来实现的,但其机制复杂,有待于更深入的机制研究来进一步揭示。
[1]Kobayashi K,Koyama Y,Kosugi S,et al.Is early enteral nutrition better for postoperative course in esophageal cancer patients[J].Nutrients,2013,5(9):3461.
[2]Smedley F,Bowling T,James M,et al.Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and cost of care[J].Br J Surg,2004,91(8):983.
[3]Xiao-Bo Y,Qiang L,Qiong Q,et al.Efficacy of early postoperativeenteralnutritioninsupportingpatientsafter esophagectomy[J].Minerva Chir,2014,69(1):37.
[4]Barlow R,Price P,Reid T D,et al.Prospective multicentre randomised controlled trial of early enteral nutrition for patients undergoing major upper gastrointestinal surgical resection[J].Clin Nutr,2011,30(5):560.
[5]Manba N,Koyama Y,Kosugi S,et al.Is early enteral nutrition initiated within 24 hours better for the postoperative course in esophageal cancer surgery[J].J Clin Med Res,2014,6(1):53.
[6]Tsutsui S,Morita M,Kuwano H,et al.Influence of preoperative treatment and surgical operation on immune function of patients with esophageal carcinoma[J].J Surg Oncol,1992,49(3):176.
[7]Tsutsui S,Sonoda K,Sumiyoshi K,et al.Prognostic significance of immunological parameters in patients with esophageal cancer [J].Hepatogastroenterology,1996,43(9):501.
[8]Rodriguez J M,Arias-Diaz J,Figueredo M A,et al.Lymphocyte subpopulations and surgery.The role of postoperative parenteral nutrition[J].Nutr Hosp,1994,9(5):324.
[9]Farreras N,Artigas V,Cardona D,et al.Effect of early postoperativeenteral immunonutritiononwoundhealingin patients undergoing surgery for gastric cancer[J].Clin Nutr,2005,24(1):55.
[10]Braga M,Gianotti L,Nespoli L,et al.Nutritional approach in malnourished surgical patients:a prospective randomized study [J].Arch Surg,2002,137(2):174.
[11]Lobo D N,Williams R N,Welch N T,et al.Early postoperative jejunostomy feeding with an immune modulating dietinpatients undergoingresectional surgeryforupper gastrointestinal cancer:a prospective,randomized,controlled,double-blind study[J].Clin Nutr,2006,25(5):716.
[12]Fan B G,Axelson J,Sternby B,et al.Total parenteral nutrition affects the tropic effect of cholecystokinin on the exocrine pancreas[J].Scand J Gastroenterol,1997,32(4):380.
[13]Harris J A,Benedict F G.A biometric study of human basal metabolism[J].Proc Natl Acad Sci U S A,1918,4(12):370.
[14]鞠名达,陈景藻,孙传兴.现代临床医学辞典[M].北京:人民军医出版社,1993.
[15]Tashiro T,Yamamori H,Takagi K,et al.Changes in immunefunction following surgery for esophageal carcinoma[J].Nutrition,1999,15(10):760.
[16]Klein S,Kinney J,Jeejeebhoy K,et al.Nutrition support in clinical pratice:review of published data and recommendations for future research directives[J].JPEN,1994,18:398.
[17]Rodriguez J M,Arias-Diaz J,Figueredo M A,et al.Lymphocyte subpopulations and surgery.The role of opstoperative parenteral nutrition[J].Nutr Hosp,1994,9(5):324.
[18]Yamada N,Koyama H,Hioki K,et al.Effect of postoperative total parenteral nutrition(TPN)as an adjunct to gastrectomy for advanced gastric carcinoma[J].Br J Surg,1983,70(5):267.
[19]Athlin L,Holmberg S B,Hafstrom L.Macrophage function and surgery.A clinical review with special reference to phagocytosis [J].Eur J Surg,1991,157(3):163.
[20]Tsutsui S,Sonoda K,Sumiyoshi K,et al.Prognostic significance of immunological parameters in patients with esophageal cancer [J].Hepatogastroenterology,1996,43(9):501.
[21]叶文锋.早期肠内营养与静脉营养支持对食管癌术后病人的影响[D].广州:中山医科大学,2001.
[22]蔡骏,顾晔斌,吴彬,等.四君子汤合肠内营养对胃癌术后患者免疫状况的影响[J].辽宁中医杂志,2008,35(4):485.
[23]王宏星,李建平.胃癌术后八珍汤加减辅助肠内营养对生长激素、营养状况及免疫功能的影响[J].中国中西医结合杂志,2011,31(10):1317.
[24]Buchan A M,Green K A,Innis S M,et al.The effect of total parenteral nutrition in the rat on a sub-group of enteroendocrine cells[J].Regul Pept,1985,11(4):347.
[25]Fan B G,Axelson J,Sternby B,et al.Total parenteral nutrition affects the tropic effect of cholecystokinin on the exocrine pancreas[J].Scand J Gastroenterol,1997,32(4):380.
[26]Lucas A,Bloom S R,Aynsley-Green A.Gut hormones and minimal enteral feeding[J].Acta Paediatr Scand,1986,75 (5):719.
[27]McMillen M A,Ferrara A,Adrian T E,et al.Cholecystokinin effect on human lymphocyte ionized calcium and mitogenesis [J].J Surg Res,1995,58(2):149.
【责任编辑:候丽颖】
Effects of Early Application of Chinese Medicine Combined with Enteral Nutrition and Parenteral Nutrition on Blood Cholecystokinin and T-cell Subsets in Postoperative Patients with Esophageal Carcinoma
YE Wenfeng,LOU Ning,QIU Huijuan,ZHANG Bei
(Sun Yat-sen University Cancer Center,State Key Laboratory of Oncology in Southern China,Collaborative Innovation Center of Cancer Medicine,Guangzhou 510060 Guangdong,China)
Objective To evaluate the effects of early application of Chinese medicine combined with enteral nutrition and total parenteral nutrition on blood cholecystokinin and T-cell subsets in postoperative patients with esophageal carcinoma.Methods One hundred and forty-seven postoperative patients with esophageal carcinoma were divided into enteral nutrition group(EN,N=75)and parenteral nutrition group(PN,N=72).The two groups were given nutritional support from the first postoperative day,lasting for 8 days.The amount of nutrition requirements was calculated according to the formulae of Harris-Benedit.The levels of blood cholecystokinin and T-cell subsets(CD4,CD8,and CD56)weretestedpreoperativelyandontheeighth postoperative day. Results The cholecystokinin level of the two groups on the eighth postoperative day was lower than that before operation,and the cholecystokinin level in EN group was significantly higher than that in PN group(P<0.05). The ratio of CD4/CD8 was increased in EN groupon on the eighth postoperative day compared with that before operation,and was significantly higher than that in PN group(P<0.05).The CD4 and CD56 levels of two groups on the eighth postoperative day was lower than that before operation,and the levels of CD4 and CD56 in EN group was significantly higher than that in PN group(P<0.05).Conclusion Early application of Chinese medicine combined with enteral nutrition is effective on maintaining cholecystokinin levels and T-cell subsets in postoperative patients with esophageal carcinoma.
esophageal carcinoma;enteral nutrition;parenteral nutrition;cholecystokinin;T-cell subsets
R735.1;R459.3
A
1007-3213(2016)04-0461-05
10.13359/j.cnki.gzxbtcm.2016.04.004
2016-04-20
叶文锋(1967-),男,主治医师;E-mail:yewf@sysucc.org.cn
张蓓(1963-),女,主任医师;E-mail:zhangbei@sysucc.org.cn
广东省中医药管理局基金资助项目(编号:20131150)
