电针对不同时间段局灶性脑缺血模型大鼠p-STAT5表达的影响
2016-09-08黄康柏唐纯志钟国新许能贵易玮
黄康柏, 唐纯志, 钟国新, 许能贵, 易玮
(广州中医药大学,广东广州 510006)
电针对不同时间段局灶性脑缺血模型大鼠p-STAT5表达的影响
黄康柏,唐纯志,钟国新,许能贵,易玮
(广州中医药大学,广东广州510006)
【目的】 观察电针对局灶性脑缺血大鼠缺血灶周围区不同时间段磷酸化信号传导转录活化因子5(p-STAT5)表达的影响,探讨电针治疗脑缺血疾病的可能作用机制。【方法】将SD大鼠随机分为假手术组、模型组、电针组(电针百会、大椎)、AG490(阻滞剂)组和AG490+电针组,各组又分为术后2 h、l d、3 d、7 d、21 d 5个时段组。采用电凝闭大脑中动脉法复制局灶性脑缺血(MCAO)模型,AG490组及AG490+电针组于术前20 min行右侧脑室注射AG490进行干预。采用免疫荧光及蛋白印迹技术检测病灶侧皮质p-STAT5的表达含量。【结果】各组各时间段的p-STAT5表达在免疫荧光及蛋白印迹检测中具有相似的发展趋势。假手术组在各时间段的检测中均只有少量表达,模型组2 h至7 d时间段p-STAT5表达较假手术组显著升高(均P<0.01);电针组3 d至7 d时间段免疫荧光检测p-STAT5表达较模型组显著升高(P<0.05或P<0.01),在3 d时间段蛋白印迹检测p-STAT5表达较模型组显著升高(P<0.01);AG490组和AG490+电针组2 h至3 d时间段免疫荧光检测p-STAT5表达较模型组与电针组均显著降低(P<0.05或P<0.01),7 d时间段p-STAT5表达较电针组显著降低(P<0.01);而在2 h至7 d时间段蛋白印迹检测p-STAT5蛋白表达较模型组与电针组显著降低(P<0.05或P<0.01)。【结论】电针改善缺血性脑损伤的内在机制可能与电针通过激活JAK2从而提高脑缺血病灶区p-STAT5的表达水平有关。
脑缺血/针刺疗法;p-STAT5;AG490;脑皮质/病理学;蛋白表达;疾病模型,动物;大鼠
信号传导和转录活化因子5(signal transducer and activator of transcription 5,STAT5)是一种能与靶基因调控区DNA结合的胞浆蛋白。局灶性脑缺血后,STAT5参与调节促红细胞生成素(EPO)提高缺血灶周围区神经元耐缺氧作用,达到抑制神经元凋亡的目的[1]。目前研究发现脑缺血后EPO与其受体(EPOR)特异性结合,通过活化酪氨酸蛋白激酶2(Janus kinase,JAK2),激活JAK2/STAT5信号通路从而介导STAT5持续高水平表达,发挥抑制神经细胞凋亡,保护脑组织及修复受损神经元的重要作用[2-3]。本研究采用电凝闭大脑中动脉法复制局灶性脑缺血大鼠模型,观察脑缺血及阻滞剂AG490干预缺血后2 h、1 d、3 d、7 d、21 d不同时间段p-STAT5表达的动态变化,以及电针的调节作用,探讨电针疗法治疗脑缺血的内在可能机制,现报道如下。
1 材料与方法
1.1动物分组广州中医药大学动物实验中心SPF级SD雄性成年大鼠250只。体质量180~220 g,自来水喂养,饲用普遍颗粒型大鼠饲料。按体质量随机分为假手术组、模型组、电针组、AG490组、AG490+电针组,每组又分为2 h、1 d、3 d、7 d、21 d 5个时间段亚组,共25小组,每小组10只大鼠。
1.2试剂及仪器AG490(德国Merck公司);二甲基亚砜(DMSO,美国Sigma公司);p-STAT5兔多克隆抗体(美国Abnova公司);辣根过氧化物酶标记山羊抗兔IgG(美国Benthyl公司);荧光素标记山羊抗兔IgG(Goat Anti-Rabbit IgG/FITC)(北京博奥森生物技术有限公司);抗荧光衰减封片剂、蛋白提取试剂盒、化学发光显色(ECL)试剂盒(北京普利莱基因技术有限公司),二氨基联苯胺(DAB)显色剂试剂盒(武汉博士德公司)。LSM 510 META型激光共聚焦显微镜(德国Zeiss公司);TGL-18R台式冷冻高速离心机(日本HEMA公司)。
1.3造模方法局灶性脑缺血模型采用电凝闭大鼠大脑中动脉的造模方法[4]。常规麻醉大鼠后,沿右侧耳眼连线中点切开皮肤打开颞骨,暴露大脑中动脉,电凝闭枪轻触之,予以凝闭复制局灶性脑缺血大鼠模型。假手术组各亚组的大鼠麻醉后只暴露大脑中动脉。各组大鼠术后以1×105U/L青霉素连续治疗3 d,常规饲养。
1.4侧脑室注射AG490[4]量取19 mL双蒸水溶解1 mL二甲基亚砜,再取5 mg AG490溶于20 mL体积分数5%二甲基亚砜溶液,配制AG490注射液。大鼠麻醉后固定于立体定向仪,标记Bregma点。在其后0.8 mm,矢状缝右侧1.5 mm,进针深至腹侧4.8 mm[5]。用微量注射器缓慢匀速推注AG490注射液10 μL。于局灶性脑缺血大鼠模型术前20 min对AG490组及AG490+针刺组按要求行右侧脑室注射AG490。
1.5电针方法电针组和AG490+电针组在造模1 h后选用针刺督脉百会穴(GV20)和大椎穴(GV14)进行针刺。选用华佗牌0.30 mm×25 mm一次性针灸针向后平刺百会0.5寸,直刺大椎0.3寸,连接G-6805电针仪,采用频率为20次/min的疏密波,强度约2~3 V,针刺时间30 min/次,每天均在相同时间治疗1次。其他3组大鼠在同等条件下饲养,除常规抓取外不予任何处理。
1.6脑组织的采集和固定在脑缺血后2 h、1 d、3 d、7 d、21 d 5个时间段各组大鼠分别随机抽取6只用于取材。以100 mg/L的水合氯醛按3.3 mL/kg腹腔注射麻醉大鼠。常规灌注固定后断头取脑,于恒冷箱冰冻切片机切片,从视交叉水平开始进行冠状切片,片厚20 μm。每份样本各取10张切片,用于免疫荧光检测。
随机抽取各组4只大鼠用于Western blotting法检测,常规麻醉后迅速断头取脑,冰上分离缺血灶周围皮层脑组织,经0℃磷酸盐缓冲液(PBS)冲洗后,迅速置于液氮罐中低温保存备用。
1.7免疫荧光检测p-STAT5表达严格按照试剂盒说明书操作,设立阴性对照滴加PBS代替一抗。PBS漂洗晾干后,用抗荧光衰减封片剂封片,激光共聚焦扫描显微镜下进行荧光观察及拍片。光源采用490 nm波长的激光激发绿色荧光,观测图像的显微镜选用目镜10×和物镜40×的视野,数值孔径为1.3,激光功率为30 mW,光切厚度为1 μm,电子放大为2.0,扫描方式为XYZ,图像存为1024 ×1024像素类型。配置激光共聚焦扫描显微镜图像处理系统进行分析,于细胞显影密集区域连续扫描5个约0.053 1 mm2大小的视野,采用平均荧光强度值作为p-STAT5的相对表达量。
1.8Western blotting蛋白印迹检测p-STAT5蛋白严格按照试剂盒说明书操作,采用ECL显影,洗片后以培清凝胶成像分析系统拍照。采用SensiAnsys软件分析结果,蛋白杂交条带的灰度值以光密度值作为该蛋白的相对表达量。
2 结果
2.1不同时间段病灶侧皮质p-STAT5免疫荧光检测结果激光共聚焦扫描显微镜下观察,阳性荧光点呈绿色表现。表1、图1结果显示:假手术组在各时间段均检测到少量p-STAT5。模型组2 h至7 d时间段p-STAT5表达较假手术组显著升高(均P<0.01),电针组3 d与7 d时间段p-STAT5表达较模型组显著升高(P<0.05或P<0.01);AG490组和AG490+电针组2 h至3 d时间段p-STAT5表达较模型组与电针组均显著降低(P<0.05或P<0.01),7 d时间段p-STAT5表达较电针组显著降低(P<0.01)。
表1 不同时间段病灶侧皮质p-STAT5免疫荧光检测结果Table 1 Expression levels of p-STAT5 in rat affected cortex of different groups detected by immunofluorescence technique (±s,I平均荧光强度)
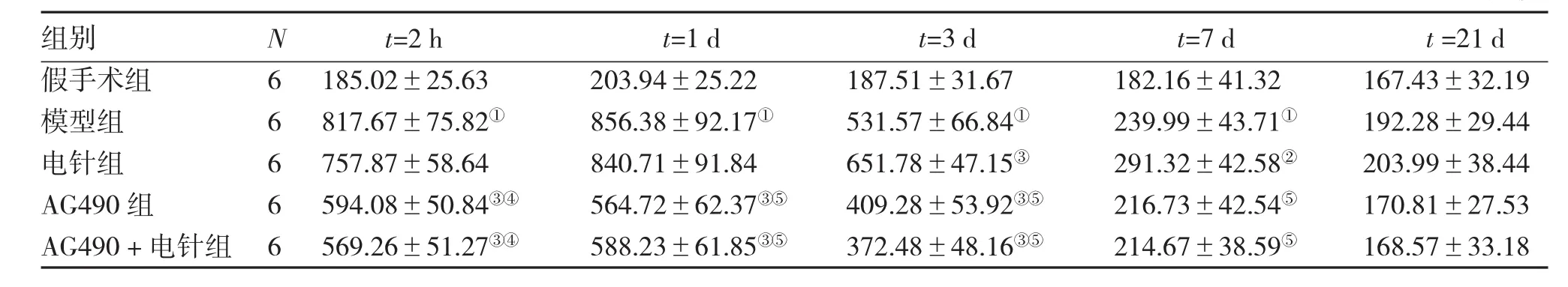
表1 不同时间段病灶侧皮质p-STAT5免疫荧光检测结果Table 1 Expression levels of p-STAT5 in rat affected cortex of different groups detected by immunofluorescence technique (±s,I平均荧光强度)
①P<0.01,与假手术组比较;②P<0.05,③P<0.01,与模型组比较;④P<0.05,⑤P<0.01,与电针组比较
组别假手术组模型组电针组AG490组AG490+电针组N 6 6 6 6 6 t=2 h 185.02±25.63 817.67±75.82①757.87±58.64 594.08±50.84③④569.26±51.27③④t=1 d 203.94±25.22 856.38±92.17①840.71±91.84 564.72±62.37③⑤588.23±61.85③⑤t=3 d 187.51±31.67 531.57±66.84①651.78±47.15③409.28±53.92③⑤372.48±48.16③⑤t=7 d 182.16±41.32 239.99±43.71①291.32±42.58②216.73±42.54⑤214.67±38.59⑤t=21 d 167.43±32.19 192.28±29.44 203.99±38.44 170.81±27.53 168.57±33.18
2.2不同时间段病灶侧皮质p-STAT5蛋白印迹检测结果图2结果显示:经Western-blotting蛋白印迹检测,各组大鼠缺血侧皮质p-STAT5蛋白在92 kD的位置可见特异的发光条带。假手术组在各时间段均几乎检测不到p-STAT5蛋白的表达。表2结果显示:模型组2 h至7 d时间段p-STAT5蛋白表达较假手术组均显著升高(均P<0.01);电针组3 d时间段p-STAT5蛋白表达较模型组显著升高(P<0.01);AG490组和AG490+电针组2 h至7 d时间段p-STAT5蛋白表达较模型组与电针组均显著降低(P<0.05或P<0.01)。
3 讨论
STAT5是JAK2的目的蛋白和直接底物[6],参与由EPO-EPOR结合而介导的细胞信号网络,对脑缺血后的神经细胞损伤发挥抗炎抗凋亡的保护作用[7]。近年研究发现局灶性脑缺血后海马CA3区中EPO和STAT5表达水平具有协同作用的正相关性[8],局灶性脑缺血后EPO通过介导EPOR-JAK2-STAT5信号转导途径,启动下游因子STAT5磷酸化,活化的STAT5能有效上调B淋巴细胞瘤-2基因(B cell lymphoma 2,Bcl-2)等抗凋亡蛋白的表达,并能良性下调Bcl-2相关X蛋白(Bcl-2 Associated X protein,BAX)和含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,caspase-3)等促凋亡蛋白的表达[9]。
本研究发现模型组在脑缺血2 h至1 d后出现p-STAT5的高水平表达,由此推断p-STAT5表达的高峰出现在脑缺血损伤早期,可能是由于脑缺血后机体应激性上调STAT5的表达,达到提高修复受损神经元能力的目的。在脑缺血后3 d,模型组p-STAT5表达开始下降,这可能与缺血再灌注损伤程度加深以及缺血持续时间加长所导致,是缺血损伤程度超过了机体自我修复能力的表现。电针组在缺血早期同样可见p-STAT5的高水平表达,与同时间段模型组p-STAT5的含量无显著性差异。而当脑缺血持续3 d后,电针组p-STAT5的含量显著高于模型组,并且能在较长的一段时间内高水平表达,表明电针刺激已启动了机体内自稳态调节机制,良性上调p-STAT5的表达,并促使其保护效应维持一段较长的时间,抑制神经元凋亡,发挥保护脑组织作用。同时观察结果提示,电针刺激在脑缺血早期就能发挥修复受损脑组织的作用,应尽早介入治疗。

图1 不同时间段病灶侧皮质p-STAT5免疫荧光检测结果(×400)Figure 1 Expression levels of p-STAT5 in rat affected cortex of different groups detected by immunofluorescence technique(×400)
脑缺血后EPO和EPOR结合活化JAK2,而介导STAT5磷酸化启动下游因子,抑制神经元凋亡,参与调节脑组织保护作用[10]。AG490是JAK2蛋白激酶的特异性磷酸化抑制剂,其作用是通过竞争受体抑制JAK2磷酸化,从而阻断JAK2/STAT5信号通路,抑制其介导下游因子的转录功能[11]。本研究观察到在脑缺血损伤过程中缺血后2 h、1 d期间p-STAT5的表达达到峰值,AG490+电针组含量只与AG490组相近而显著低于同时段的模型组和电针组。这可能是注射AG490后,特异性抑制JAK2磷酸化,阻滞JAK2/STAT5信号通路的活化,从而降低p-STAT5的表达。同时,本研究结果显示:AG490+电针组p-STAT5的表达均显著低于同时段的电针组。在注射AG490后,电针并没有表现出上调p-STAT5表达,增强p-STAT5活性的效应,表明当阻滞上游启动因子JAK2磷酸化后,电针对STAT5的活化作用并不明显。由此推断电针上调p-STAT5表达水平以抑制神经元凋亡、减轻脑缺血损伤的保护作用,可能是通过启动JAK2/ STAT5信号转导通路实现的。
表2 不同时段病灶侧皮质p-STAT5蛋白表达情况Table 2 Expression levels of p-STAT5 protein in rat affected cortex of different groups detected by Western blotting method (±s,D)
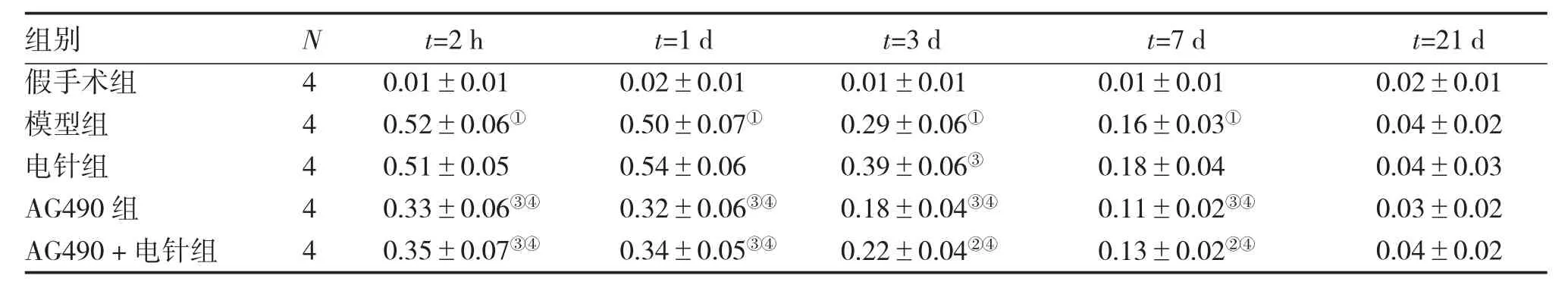
表2 不同时段病灶侧皮质p-STAT5蛋白表达情况Table 2 Expression levels of p-STAT5 protein in rat affected cortex of different groups detected by Western blotting method (±s,D)
①P<0.01,与假手术组比较;②P<0.05,③P<0.01,与模型组比较;④P<0.01,与电针组比较
组别假手术组模型组电针组AG490组AG490+电针组N 4 4 4 4 4 t=2 h 0.01±0.01 0.52±0.06①0.51±0.05 0.33±0.06③④0.35±0.07③④t=1 d 0.02±0.01 0.50±0.07①0.54±0.06 0.32±0.06③④0.34±0.05③④t=3 d 0.01±0.01 0.29±0.06①0.39±0.06③0.18±0.04③④0.22±0.04②④t=7 d 0.01±0.01 0.16±0.03①0.18±0.04 0.11±0.02③④0.13±0.02②④t=21 d 0.02±0.01 0.04±0.02 0.04±0.03 0.03±0.02 0.04±0.02
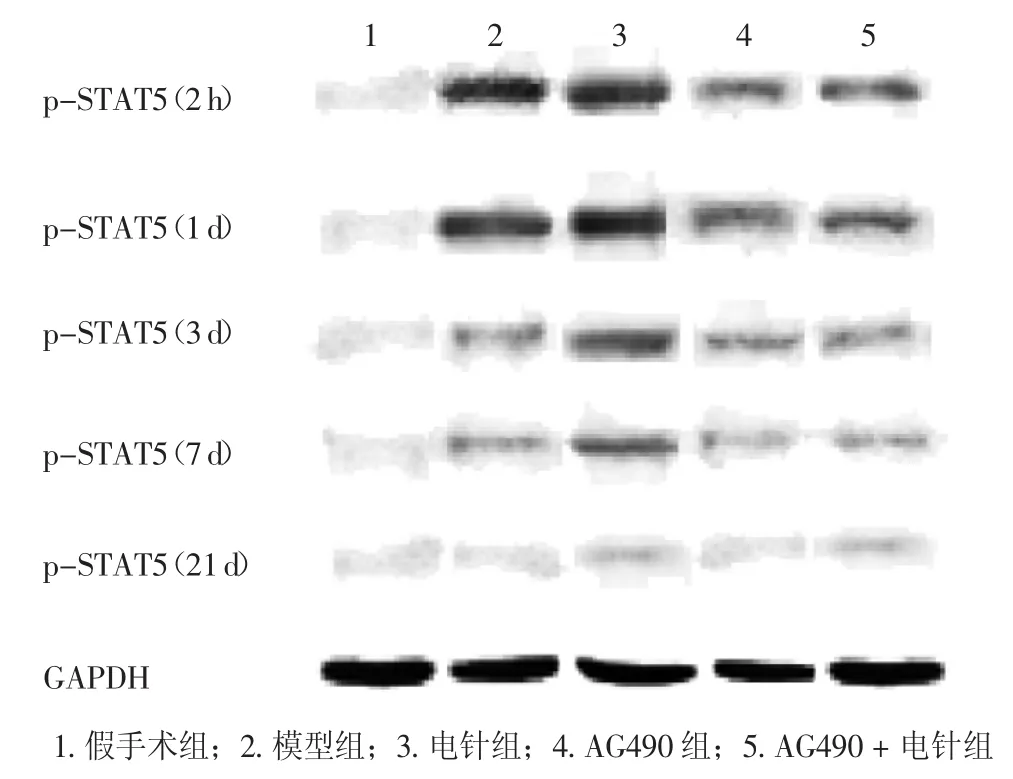
图2 不同时间段病灶侧皮质p-STAT5蛋白印迹图Figure 2 Western blotting results for the expression level of p-STAT5 protein in rat affected cortex of different groups
局灶性脑缺血后STAT5的高表达有利于抑制神经元凋亡从而减轻脑组织的损伤[2]。针刺百会、大椎后能较长时间维持p-STAT5的高水平表达,可能是通过激活JAK2/STAT5信号通路,上调p-STAT5含量,激发机体自我保护机制,从而发挥修复受损神经元的作用,这可能是电针疗法治疗脑缺血疾病的内在作用机制之一。
[1]Miljus N,Heibeck S,Jarrar M,et al.Erythropoietin-mediated protection of insect brain neurons involves JAK and STAT but not PI3K transduction pathways[J].Neuroscience,2014,258(1):218.
[2]Kosan C,Ginter T,Heinzel T,et al.STAT5 acetylation:Mechanisms and consequences for immunological control and leukemogenesis[J].JAKSTAT,2013,2(4):e26102.
[3]Bell B D,Kitajima M,Larson R P,et al.The transcription factor STAT5 is critical in dendritic cells for the development of TH2 but not TH1 responses[J].Nat Immunol,2013,14(4):364.
[4]Liu R,Xu N G,Yi W,et a1.Electroacupuncture effects on cortical neurons,as well as Janus kinase 2-signal transducer and activator of transcription 3 signal transduction pathway,in a rat model of cerebral ischemia[J].Neural Regen Res,2012,7(6):457
[5]Paxinos G,Watson C.The rat brain in stereotaxic coordinates [M].6th Edition.Pittsburgh:Academic Press,2007:402.
[6]Harrison D A.The JAK/STAT pathway[J].Cold Spring Harb Perspect Biol,2012,4(3):1.
[7]Letourneur A,Petit E,Roussel S,et al.Brain ischemic injury in rodents:the protective effect of EPO[J].Methods Mol Biol,2013(982):79.
[8]Ogawa C,Tone Y,Tsuda M,et al.TGF-β mediated Foxp3 gene expression is cooperatively regulated by Stat5,Creb,and AP-1 through CNS2[J].J Immunol,2014,192(1):475.
[9]Shen J,Wu Y,Xu J Y,et al.ERK-and Akt-dependent neuroprotection by erythropoietin(EPO)against glyoxal-AGEs via modulation of Bcl-xL,Bax,and BAD[J].Invest Ophthalmol Vis Sci,2010,51(1):35.
[10]Sola A,Rogido M,Lee B H,et al.Erythropoietin after focal cerebral ischemia activates the Janus kinase-signal transducer and activator of transcription signaling pathway and improves brain injury in postnatal day 7 rats[J].Pediatr Res,2005,57(4):481.
[11]Joung Y H,Na Y M,Yoo Y B,et al.Combination of AG490, aJak2inhibitor, andmethylsulfonylmethane synergistically suppresses bladder tumor growth via the Jak2/ STAT3 pathway[J].Int J Oncol,2014,44(3):883.
【责任编辑:黄玲】
Effect of Electroacupuncture on Phosphorylated Signal Transducer and Activator of Transcription 5 Expression in Rats with Focal Cerebral Ischemia in Different Periods
HUANG Kangbai,TANG Chunzhi,ZHONG Guoxin,XU Nenggui,YI Wei
(Guangzhou University of Chinese Medicine,Guangzhou 510006 Guangdong,China)
ObjectiveTo observe the effects of electroacupuncture(EA)on the phosphorylated signal transducer and activator of transcription 5(p-STAT5)in the marginal zone of the ischemic foci of rats with focal cerebral ischemia at different time points,so as to further explore its underlying mechanism in the treatment of cerebral ischemia.Methods SD rats were randomly divided into sham operation group,model group,EA group (EA on acupoints of Baihui and Dazhui),AG490 group(intracerebroventricular injection with blocker AG490)and AG490+EA group.Heat-coagulation-induced occlusion of the middle cerebral artery was performed toestablish the model of focal cerebral ischemia.AG490 group and AG490+EA group were given intracerebroventricular injection with blocker AG490 20 min before the heat-coagulation-induced occlusion. Immunofluorescence technique and Western blotting method were used to detect the expression of p-STAT5 in rat affected cortex at different time points.Results The expression of p-STAT5 in each group at different time points showed the similar development trend presented by the results of immunofluorescence technique and Western blotting method.The sham operation group had a small amount of p-STAT5 expression at different time points;the model group had higher p-STAT5 expression level than the sham operation group after ischemia for 2 h to 7 d(all P<0.01);EA group hadhigher p-STAT5 expression level showed by immunofluorescence technique than the model group after ischemia for 3 d to 7 d(P<0.05 or P<0.01),and had higher proteinexpression level showed by Western blotting method on ischemia day 3(P<0.01);AG490 group and AG490+EA group had lower p-STAT5 mRNA expression level showed by immunofluorescence technique than the model group and EA group after ischemia for 2 h to 3 d(P<0.05 or P<0.01),had lower mRNA expression level than EA group on ischemia day 7(P<0.01),and had lower p-STAT5 expression level showed by Western blotting method than the model group and EA group after ischemia for 2 h to 7 d(P<0.05 or P<0.01).Conclusion The therapeutic mechanism of EA for ischemic cerebral injury may be related to the up-regulation of p-STAT5 expression in the marginal zone of the ischemic foci through activating JAK2.
cerebral ischemia/acupuncture therapy;p-STAT5;AG490;cerebral cortex/pathology;protein expression;disease models,animal;rats
R246.9
A
1007-3213(2016)04-0515-05
10.13359/j.cnki.gzxbtcm.2016.04.018
2016-03-21
黄康柏(1981-),男,讲师;E-mail:kb_huang@126.com
许能贵(1964-),男,研究员;E-mail:ngxu@tom.com
广东省重点实验室建设项目(编号:2012A061400017);广东省自然科学基金项目(编号:2015A030310375);广东省中医药管理局项目(编号:20151232)
