连花清瘟颗粒抗呼吸道合胞病毒感染BALB/c小鼠的药效作用研究
2016-09-08丁月文曾丽娟李润峰王玉涛陈俏妍杨子峰张奉学
丁月文, 曾丽娟, 李润峰, 王玉涛, 陈俏妍, 杨子峰, 张奉学
(1.广州中医药大学热带医学研究所,广东广州 510405;2.广州医科大学附属第一医院广州呼吸疾病研究所,广东广州 510230;3.广东省中医院,广东广州 510120)
连花清瘟颗粒抗呼吸道合胞病毒感染BALB/c小鼠的药效作用研究
丁月文1,2,曾丽娟1,2,李润峰2,王玉涛2,陈俏妍3,杨子峰2,张奉学1
(1.广州中医药大学热带医学研究所,广东广州510405;2.广州医科大学附属第一医院广州呼吸疾病研究所,广东广州510230;3.广东省中医院,广东广州510120)
【目的】观察连花清瘟颗粒体内抗呼吸道合胞病毒(RSV)感染的药效作用。【方法】采用BALB/c小鼠RSV感染模型,通过观察小鼠体质量变化、肺病毒滴度、肺内炎症因子mRNA表达及肺组织病理变化评价药物的体内抗病毒药效。【结果】连花清瘟颗粒高剂量组可显著降低RSV感染小鼠肺内病毒滴度(P<0.05)。连花清瘟高、低剂量组可显著降低RSV感染小鼠肺内炎症因子白细胞介素IL-6,IL-1β mRNA的表达量(P<0.01);肺组织病理检查结果显示:连花清瘟颗粒高、低各剂量组均可以缓解病毒所致肺组织病理性炎症。【结论】连花清瘟颗粒可有效抑制RSV感染小鼠肺内病毒滴度,对小鼠病毒性肺炎具有一定的改善作用。
连花清瘟颗粒/药理学;呼吸道合胞病毒;肺/病理学;基因表达调控;疾病模型,动物;小鼠
呼吸道合胞病毒(RSV),属于副黏液病毒科。临床感染RSV病毒,通常表现为轻微的上呼吸道疾病,但仍有约5%的1岁以下的患儿需要接受住院治疗[1]。研究表明:RSV感染主要引起毛细支气管病变,也可累及肺泡和支气管而导致呼吸道合胞病毒肺炎,与婴幼儿反复喘息、气道高反应性及哮喘的发生有关,其发病机制尚不完全明确[2]。目前,批准使用的抗RSV药物包括单克隆抗体帕利珠单抗及广谱抗病毒药物利巴韦林,两种药物都仅限于针对重症感染患者或高危人群的治疗[3],在对儿童病例中使用利巴韦林治疗的有效性和安全性依然受到质疑[4]。
连花清瘟颗粒,由连翘、金银花、炙麻黄、板蓝根、贯众等药物组成,临床常用于预防和治疗呼吸道感染所致的相关疾病,相关研究证实它在抗病毒、抗菌以及提高宿主免疫方面有一定的效果[5-6],在对治疗甲型H1N1流感病毒的随机对照试验中显示了良好的治疗效果[7],一些研究还显示连花清瘟颗粒在抑制肺部炎症反应及提高宿主免疫功能方面有较好的表现[8]。本研究旨在建立呼吸道合胞病毒感染小鼠模型,并初步探讨连花清瘟颗粒动物体内抗RSV病毒作用,现报道如下。
1 材料与方法
1.1药物连花清瘟颗粒干粉由石家庄以岭药业股份有限公司提供,批号:20150612;阳性药物利巴韦林购于广东肇庆星湖生物科技股份有限公司,批号:L071015。
1.2实验动物BALB/c雌性小鼠,SPF级,6~8周龄,购自广东省实验动物中心,许可证号:SCXK(粤)2003-0002,粤监证字2008A023。
1.3病毒株呼吸道合胞病毒(RSV)Long株,购自美国菌种保藏中心(ATCC)。病毒于HEp-2细胞上培养扩增后,于4℃条件下,8 000 r/min超滤浓缩40 min,浓缩后的病毒在细胞上测定其半数细胞感染量(TCID50)为10-7.5/mL。
1.4主要试剂与仪器二甲苯(广州化学试剂厂,批号:20150313);无水乙醇(广州化学试剂厂,批号:20150227);40 g/L多聚甲醛溶液(中国GBCBIO公司,批号:1508GB04);苏木素—伊红染色液(珠海贝索生物技术有限公司,批号:715032);Trizol Reagent(美国 Invitrogen公司);BT124S赛多利斯电子天平(北京赛多利斯仪器系统有限公司);EG1150H分体式石蜡包埋机(德国Leica公司);RM2245电控进样的手动轮转切片机(德国 Leica公司);NanoDrop 2000超微量分光光度计(美国Thermo公司);第一链合成试剂盒(PrimeScript Rt Master mix,日本TaKaRa公司,批号:AK3601);荧光定量PCR试剂盒(Premix Ex Taq,日本TaKaRa公司,批号:AK2403)。
1.5连花清瘟体内抗呼吸道合胞病毒感染试验
1.5.1动物分组将小鼠随机分成5组,每组19只,分别为正常组,病毒对照组(病毒组),利巴韦林组(剂量为45 mg·kg-1·d-1),连花清瘟高剂量组(中药高剂组,剂量为1 300 mg·kg-1·d-1)、低剂量组(中药低剂组,剂量为650 mg·kg-1·d-1)。
1.5.2感染造模及给药除正常对照组外,各组小鼠在乙醚轻度麻醉下,以扩增后的RSV病毒液50 μL滴鼻感染小鼠,正常组采用同法滴入等量DMEM培养基。于感染前2 d开始灌胃给药,2次/d,每次0.2 mL,连续给药5 d,正常组及病毒对照组灌服等量生理盐水。
1.5.3小鼠肺匀浆中细胞因子含量的测定感染后每天称体质量,观察小鼠反应及体质量变化情况并做记录,共观察10 d。感染后第3天,随机选取5只小鼠麻醉后处死,每只小鼠取100 mg鼠肺样本,放入预冷的匀浆器中加入液氮进行快速研磨;然后将粉末装入预冷的管中,每管加入Trizol 1 mL,按照Trizol reagent试剂说明书操作方法提取组织RNA;RNA溶液置于-70℃保存或直接用于后续操作。核酸紫外分光光度计测定经稀释的RNA提取物的值和浓度,判断RNA纯度,计算浓度。定量1 000 μg RNA进行逆转录程序。逆转录反应条件:37℃、15 min;85℃、5 s;4℃Forever。将所得的cDNA与下列物质加入Ep管中混匀,进行Real-Time PCR程序。Real-Time PCR体系(20 μL):Mix 10 μL、上游引物0.2 μL、下游引物0.2 μL、探针 0.2 μL、Rox II 0.2 μL、H2O 7.2 μL、cDNA模板 2 μL。Real-Time PCR扩增条件:95℃、30 s→95℃、5 s→60℃、40 s,共40个循环。以GAPDH为内参,用相对定量法分析结果。采用相对定量2-△△Ct法[9]计算各个样本目的基因的表达变化。小鼠趋化因子(KC)、干扰素β(IFN-β)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α (TNF-α)及内参基因GAPDH引物探针序列见表1。
1.5.4小鼠肺指数,肺病毒滴度测定感染后第4天,随机选取7只小鼠麻醉后处死,解剖观察肺部病变,并称量肺质量,测定其肺指数:p肺指数= mlung/mbody×100%。鼠肺称重后,取右肺于冰上匀浆制成肺匀浆液。于12 000 r/min,4℃离心5 min,收集上清液并于MDCK细胞上测定其病毒滴度。
1.5.5肺组织病理检查上述小鼠称量肺质量后,取左肺,肉眼观察并记录肺组织大体病变情况;在生理盐水中漂洗后吸干,浸泡于40 g/L多聚甲醛中固定24 h;常规病理组织脱水后,包埋切片并进行苏木素—伊红(HE)染色,镜下检查肺病理变化情况。
1.6统计方法采用Graphpad Prism 5.0软件进行统计分析,组间比较采用方差分析、t检验,以P<0.05为差异有统计学意义。

表1 各基因qPCR引物探针序列Table 1 Primer sequence of various genes for qPCR
2 结果
2.1各组小鼠体质量变化图1结果显示:病毒组于感染后第2天出现体质量下降,最低下降幅度为原体质量10%,并于第9天开始体质量回升;连花清瘟高、低剂量组于感染后2、3 d出现体质量下降,并于第5天回升,利巴韦林组小鼠无明显体质量减轻。
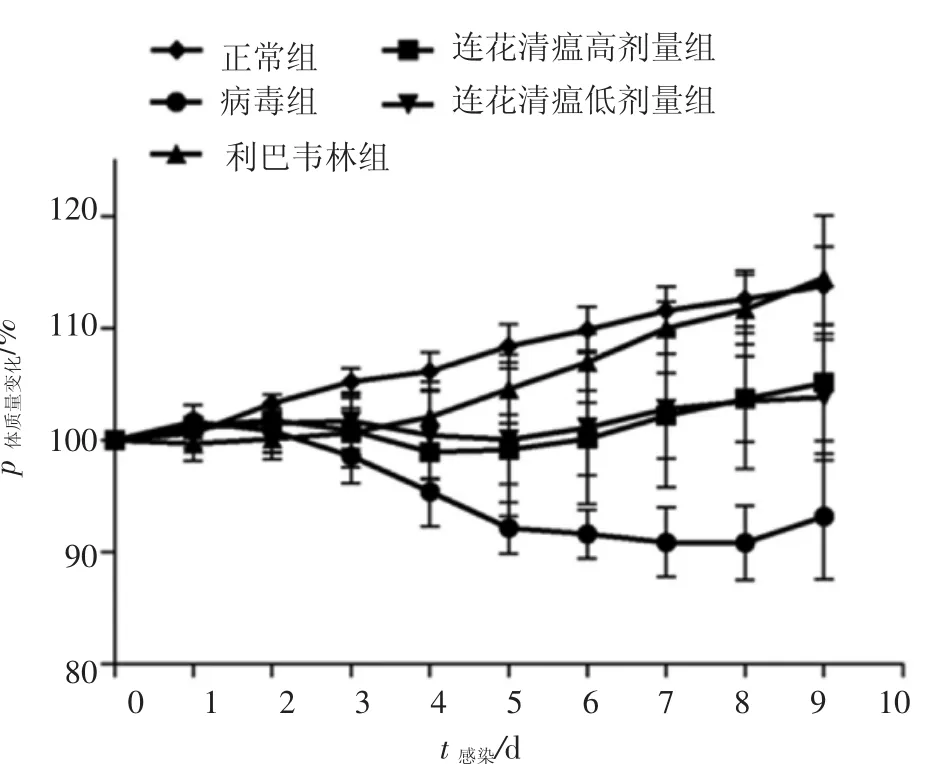
图1 各组小鼠每日体质量变化Figure 1 Changes of daily body mass of mice in various groups (±s,N=3)
2.2各组小鼠肺匀浆中病毒滴度的测定图2结果显示:感染后第4天,测定病毒组小鼠肺匀浆中病毒滴度均值为TCID50=10-4.7,与病毒组比较,连花清瘟高剂量组小鼠肺匀浆中病毒滴度显著降低(P<0.05),低剂量组病毒滴度无显著降低(P>0.05)。

图2 各组小鼠肺病毒滴度Figure 2 Comparison of lung viral titer in mice of various groups (±s,N=5)
2.3各组小鼠肺匀浆中细胞因子mRNA表达量的测定图3结果显示,感染后第3天,与病毒组比较,中药高剂量组IL-1β、IL-6表达量显著下调(P<0.01),中药低剂量组IL-6表达量显著下调(P<0.01)。中药各剂量组TNF-α、KC mRNA表达量与病毒组比较无显著变化(P>0.05)。
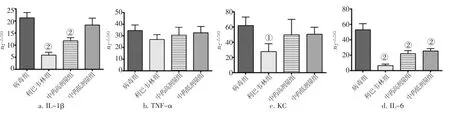
图3 各组小鼠肺组织细胞因子mRNA表达量比较Figure 3 Comparison of cytokine mRNA expression in mouse lung tissues of various groups(±s,N=5)
2.4各组小鼠肺组织形态的改变图 4结果显示:正常组肺泡结构清晰,肺泡、肺泡囊、肺泡管、肺泡隔形态完整,无炎性细胞。病毒组可见肺泡内炎性渗出,肺间质增宽,肺泡壁增厚,细支气管及肺血管壁增厚。利巴韦林组可见肺泡内炎性渗出物明显减少,与正常组相近。中药高剂量组肺泡壁有所增厚,肺泡浸润不明显,较病毒组肺泡浸润面积明显减少。中药低剂量组肺部具有少量肺泡出现病变,较病毒组炎性病变明显减少,部分区域可见浸润及炎性病变。

图4 各组小鼠肺组织病理检查结果(HE染色)Figure 4 Histopathological changes in lung tissue of mice in various groups(by HE staining)
3 讨论
针对RSV的模型研究十分广泛,目前已知可用于实验研究的动物模型包括猩猩、狒狒、雪貂、棉鼠、羊、豚鼠和小鼠等,各模型均有其优势和局限,RSV感染除在猩猩、狒狒等可观察到临床症状外,其他均表现为隐性感染。小鼠模型因其易获得,遗传背景清楚而均一,基因改造技术成熟,且已有多种商品化试剂,仍是目前应用最广泛的实验动物[10]。但小鼠不是RSV自然宿主。本课题组前期实验发现BALB/c鼠感染RSV没有稳定的临床症状,肺内病毒复制水平相对低,病毒清除快,宿主炎症反应不明显,限制了药物治疗效果的观察。因此,增强小鼠RSV易感性才能获得高水平病毒滴度的理想动物模型。
一些研究尝试感染RSV同时联合使用免疫抑制剂,模拟免疫缺陷条件下的病毒感染,可以获得有效的小鼠体内病毒复制[11],但这种模型条件下,无法模拟病毒感染后的正常的宿主免疫调节,RSV感染所致的末梢气管病变亦不明显,故不适于模拟病毒感染所致的疾病发展过程。本研究通过使用浓缩后的高滴度RSV感染,诱发下呼吸道病毒感染。从病理结果中可以发现,感染后第4天,病毒组可出现较明显的炎性渗出,肺间质增宽,细支气管及肺血管壁增厚,与第4天较高的肺内病毒复制相吻合,从而使炎症RSV在小鼠体内有效复制并激发宿主炎症反应。
RSV感染后可以通过多种渠道引发宿主免疫反应,其机制仍不明确。目前公认的机制是RSV感染与宿主固有免疫识别受体(PRRs)有关,这些识别受体能识别和启动病原相关分子模式(PAMPs)的天然免疫应答[12]。宿主通过Toll样受体(TLRs)信号介导的抗病毒免疫机制清除感染的RSV,在这个过程中,从机体急性炎症转变成慢性炎症并导致持续的组织损伤。RSV感染后,TLRs不仅可以识别病毒F蛋白,同时可以识别病毒其他部分,如dsRNA(TLR3)或ssRNA(TLR7/8)等,从而活化TLR表达,进一步促进下游细胞因子如IL-1β、IL-6、TNF-α、KC的表达[13-14]。本研究中病毒感染第3天后,可见相关细胞因子mRNA水平的表达明显升高,而观察连花清瘟组对RSV感染的治疗效果可以发现,中药高剂量组在有效抑制病毒复制的同时,也降低了肺内促炎因子的表达。进一步的肺组织病理检查结果显示:连花清瘟组肺组织病理炎症性改变较病毒对照组有一定程度的减轻,肺泡浸润面积明显减少,细支气管及肺血管壁增厚减轻,表明连花清瘟药物对RSV所致病毒性肺炎具有一定的抑制作用。本研究结果表明连花清瘟颗粒在小鼠体内有一定的抗RSV药效作用。进一步的实验拟在针对病毒感染所致的相关炎症及信号通路及药物干预病毒的具体靶点做更深入的研究,以期阐明连花清瘟抗RSV病毒的药理机理及作用特点。
[1]Schmidt A C,Johnson T R,Openshaw P J,et al.Respiratory syncytial virus andother pneumoviruses: are viewof the international symposium-RSV 2003[J].Virus Res,2004,106 (1):1.
[2]Zhou H,Thompson W W,Viboud C G,et al.Hospitalizations associated with influenza and respiratory syncytial virus in the United States,1993-2008[J].Clin Infect Dis,2012,54(10):1427.
[3]Nokes J D,Cane P A.New strategies for control of respiratory syncytial virus infection[J].Curr Opin Infect Dis,2008,21(6):639.
[4]Douglas J L.In search of a small-molecule inhibitor for respiratory syncytial virus[J].Expert Rev Anti Infect Ther,2004,2(4):625.
[5]莫红缨,柯昌文,郑劲平,等.连花清瘟胶囊体外抗甲型流感病毒的实验研究[J].中药新药与临床药理,2007,18(1):5.
[6]雷洪涛,马淑骅,姜秀新,等.连花清瘟胶囊抗金黄色葡萄球菌生物膜形成的研究[J].中国中医基础医学杂志,2013,19 (10):1133.
[7]刘更新,张艳霞,杨继清,等.连花清瘟胶囊治疗甲型H1N1流感随机对照临床研究[J].疑难病杂志,2010,9(1):14.
[8]DuanZP,JiaZH,ZhangJ,etal.Natural herbal medicine Lianhuaqingwen capsule anti-influenza A(H1N1)trial:a randomized,double blind,positive controlled clinical trial[J]. Chin Med J(Engl),2011,124(18):2925.
[9]Ramírez-Martínez G,Cruz-Lagunas A,Jiménez-Alvarez L,et al.Seasonal andpandemicinfluenzaH1N1viruses induce differential expression of SOCS-1 and RIG-I genes and cytokine/ chemokine production in macrophages[J].Cytokine,2013,62 (1):151.
[10]Suchyta M R,Clemmer T P,Elliott C G,et al.The adult respiratory distress syndrome:a report of survival and modifying factors[J].Chest,1992,101(4):1074.
[11]Kong X,Hellermann G R, Patton G,et al.An immune compromised BALB/c mouse model for respiratory syncytial virus infection[J],Virol J,2005,2(1):3.
[12]Goritzka M,Pereira C,Makris S,et al,T cell responses are elicited against respiratory syncytial virus in the absence of signalling through TLRs,RLRs and IL-1R/IL-18R[J].Sci Rep,2015,5:18533.
[13]Mukherjee S,Lukacs N W.Innate immune responses to respiratory syncytial virus infection[J].Curr Top Microbiol Immunol,2013,372:139.
[14]van Drunen Littel-van den Hurk S,Watkiss E R.Pathogenesis of respiratory syncytial virus[J].Curr Opin Virol,2012,2(3):300.
【责任编辑:黄玲】
Pharmacological Action of Lianhua Qingwen Granules on BALB/c Mice Infected with Respiratory Syncytial Virus
DING Yuewen1,2,ZENG Lijuan1,2,LI Runfeng2,WANG Yutao2,CHEN Qiaoyan3,YANG Zifeng2,ZHANG Fengxue1
(1.Institute of Tropical Medicine,Guangzhou University of Chinese Medicine,Guangzhou 510405 Guangdong,China;2.Guangzhou Institute of Respiratory Disease,State Key Laboratory of Respiratory Diseases,the First Affiliated Hospital,Guangzhou Medical University,Guangzhou 510230 Guangdong,China;3.Guangdong Provincial Hospital of Traditional Chinese Medicine,Guangzhou 510120 Guangdong,China)
ObjectiveTo evaluate the effect of Lianhua Qingwen Granules(LQG)on respiratory syncytial virus(RSV)infection in vivo.Methods BALB/c mouse model of RSV infection was established.The mouse body mass,lung viral titer,mRNA expression of inflammatory cytokines,and pulmonary histopathological changes were observed to study the pharmacological action of LQG.Results Lung viral titers in mice infected with RSV were decreased in high-dose LQG group(P<0.05).Interleukin(IL)-6 and IL-1β mRNA expression levels of mice infected with RSV were also decreased in high-and low-dose LQG groups(P<0.01).The pulmonary histopathological examination results showed that RSV-induced inflammation was relieved in high-and low-dose LQG groups.Conclusion LQG can suppress lung viral titers in mice infected with RSV,and relieve viral pneumonia in mice.
Lianhua Qingwen Granules/pharmacology;respiratory syncytial virus;lung/pathology;gene expression regulation;disease models,animal;mice
R285.5
A
1007-3213(2016)04-0540-05
10.13359/j.cnki.gzxbtcm.2016.04.023
2016-03-08
丁月文(1990-),男,在读硕士研究生;E-mail:dingyw2011@163.com
张奉学(1962-),男,博士研究生,研究员;E-mail:zhangfengxue@gzucm.edu.cn。杨子峰(1977-),男,博士研究生,副教授;E-mail:Jeffyah@163.com
广东省科技计划项目(编号:2013B051000085);广州市科技计划项目(编号:201400000002、2014Y2-00031)
