苓桂术甘汤对鼻超敏大鼠的抗过敏作用及机制研究
2016-09-08徐慧贤阮岩孟瑜陈舒
徐慧贤, 阮岩, 孟瑜, 陈舒
(1.广州中医药大学,广东广州 510405;2.广州中医药大学第一附属医院,广东广州 510405)
苓桂术甘汤对鼻超敏大鼠的抗过敏作用及机制研究
徐慧贤1,阮岩2,孟瑜1,陈舒1
(1.广州中医药大学,广东广州510405;2.广州中医药大学第一附属医院,广东广州510405)
【目的】探讨苓桂术甘汤对过敏性鼻炎的抗过敏作用及机制。【方法】将SD大鼠40只随机分成4组,分别是正常组、模型组、苓桂术甘汤组(剂量为3.24 g·kg-1·d-1)和氯雷他定组(剂量为0.9 mg·kg-1·d-1)。模型组、苓桂术甘汤组和氯雷他定组采用卵清蛋白腹腔注射加滴鼻法进行致敏,正常组用生理盐水代替卵清蛋白。造模成功后苓桂术甘汤组用苓桂术甘汤、氯雷他定组采用氯雷他定溶液、模型组用生理盐水灌胃。用药第5、10天观察动物的症状评分、细胞因子和鼻黏膜细胞学的变化。【结果】模型组、苓桂术甘汤组和氯雷他定组在用药前症状评分较正常组显著升高(P<0.05);给药第10天,苓桂术甘汤组、氯雷他定组与模型组比较,其症状评分、血清细胞因子水平、鼻黏膜细胞计数显著改善,差异均有统计学意义(P<0.05);苓桂术甘汤组与氯雷他定组比较差异无统计学意义(P>0.05)。【结论】苓桂术甘汤可改善过敏性鼻炎的症状,其机制可能与升高白细胞介素-2(IL-2)水平,降低血清IL-4水平,减少组织中嗜酸细胞、肥大细胞释放有关。
苓桂术甘汤;过敏性鼻炎/中药疗法;鼻黏膜/病理学;疾病模型,动物;大鼠
过敏性鼻炎(又称变应性鼻炎)是一种鼻腔黏膜慢性疾病,是以IgE介导的I型变态反应,是耳鼻喉科的常见病、多发病。过敏性鼻炎在中医可参考鼻鼽进行辨证论治[1]。过敏性鼻炎主要证候有鼻痒、喷嚏、流清水样涕、鼻塞、病程长、易反复发作、缠绵难愈等,这些证候与痰饮证[2]的咳嗽、咳痰量多、局部有圆滑肿块等有许多相似之处。苓桂术甘汤是治疗痰饮证的代表方剂,在历代医家治疗过敏性鼻炎的方剂中分别有记载。本研究拟用苓桂术甘汤对过敏性鼻炎的大鼠模型进行干预,从症状评分、细胞因子、活检的角度评价苓桂术甘汤对过敏性鼻炎的抗过敏作用及机制,现报道如下。
1 材料与方法
1.1动物SPF级雄性SD大鼠40只,6~7周龄,体质量180~200 g,由广州中医药大学动物实验中心提供,合格证号:NO44005800000810。SPF级饲养环境,室温22℃~25℃,自由进食与饮水,适应喂养1周之后开始实验。
1.2主要试剂与仪器卵清蛋白(ovalbumin,OVA)购自美国Sigma公司,批号:SLBD2312v;氢氧化铝购自广州化学试剂厂;血清白细胞介素-2(IL-2)、白细胞介素-4(IL-4)酶联免疫吸附反应(ELISA)试剂盒购自美国Ray Bio公司;伊文思蓝由中国医药集团上海化学试剂公司提供;Research plus微量移液器购自德国Eppenderf公司;TS-1脱色摇床购自江苏林贝尔公司;mst2/4数显酶标振荡器、BR-2900漩涡震荡仪购自美国Bio-Rad公司;MultiskanG0酶标仪购自美国Thermo Scientific公司。
1.3药物选择及汤剂制备中药饮片由广州致信药业提供,并经广州中医药大学第一附属医院药剂科中药鉴定专家鉴定,确保药材的质量稳定。参考《伤寒论讲义》[3]中苓桂术甘汤的比例及煎煮方法制备水煎液,具体药量按《方剂学》[4]中苓桂术甘汤组方配伍,即茯苓12 g、桂枝9 g、白术9 g、甘草6 g。加水10倍,将饮片浸泡30 min,再煎30 min,纱布滤液去渣并浓缩,冷藏备用。
1.4造模方法SD大鼠用1 mL的OVA生理盐水[内含0.3 mg OVA、30 mg Al(OH)3]进行腹腔内注射致敏[5],隔日1次,共7次。腹腔注射完毕后次日从大鼠尾端静脉采血,进行被动皮肤过敏反应试验(PCA)[6]。PCA试验阳性后确定卵清蛋白IgE抗体效价升高,用微量移液器将50 g/L卵清蛋白100 μL滴入双侧鼻腔,每侧50 μL,每日1次,共7次,造模完成。正常组用相应体积的生理盐水代替卵清蛋白及氢氧化铝进行腹腔注射和滴鼻攻击,方法同上。
1.5分组与给药按体质量随机分为4组,即正常组、模型组、苓桂术甘汤组、氯雷他定组,每组10只,每5只一笼,分笼饲养。造模阶段完成后,正常组不给药物,模型组给予生理盐水灌胃,量约1.5 mL·d-1·只-1;苓桂术甘汤组、氯雷他定组给予相应溶液灌胃(给药剂量相当于成人常规服用剂量),苓桂术甘汤组的剂量为3.24 g·kg-1·d-1。氯雷他定组剂量为0.9 mg·kg-1·d-1。模型组、氯雷他定组、苓桂术甘汤组给药共10 d。
1.6取材和指标检测
1.6.1动物的一般状态每日记录动物的一般状态包括饮食、大小便、活动情况、毛发等,并在实验前、造模后、实验结束前称体质量、测体温。
1.6.2鼻部症状评分在给药前及给药第5、10天分别对各组大鼠进行鼻激发试验[7],根据鼻部症状评分标准[8-9],对激发后的鼻部症状进行评分并记录。具体激发试验方法为给予50 g/L卵清蛋白生理盐水溶液滴鼻(每侧50 μL),观察30 min内大鼠抓鼻次数、打喷嚏次数及流涕情况。评分标准见表1。

表1 大鼠鼻部症状评分标准Table 1 Scoring criteria of rat nasal symptoms
1.6.3细胞因子检测于末次给药后第2天,从腹主静脉采血,放入离心机内离心10 min,转速3 000 r/min;再用微量加液器取上清液,放置于冰箱-80℃保存。根据ELISA试剂盒说明书操作,检测血清细胞因子IL-2、IL-4水平。
1.6.4鼻腔黏膜组织学检查于末次给药后第2天,将大鼠以10 g/L戊巴比妥钠注射液作腹腔注射麻醉,麻醉致死后,剥除鼻中隔连同双侧黏膜并分别固定于100 g/L甲醛液中,经过石蜡包埋、薄切,制成46 μm的切片,观察嗜酸细胞采用苏木素—伊红染色法(HE染色法);观察肥大细胞采用甲苯胺蓝染色法。在低倍光学显微镜下,计算每个视野的嗜酸细胞、肥大细胞数。
1.7统计方法数据采用 SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,组间比较t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1各组鼻部症状评分情况表2结果显示:鼻腔局部致敏后(给药前),模型组、苓桂术甘汤组、氯雷他定组大鼠均出现不同程度的抓鼻和喷嚏、流涕症状,症状评分显著升高,与正常组比较,差异有统计学意义(P<0.05),表明造模成功。在给药的第5、10天,与模型组比较,苓桂术甘汤组、氯雷他定组症状评分显著降低,差异均有统计学意义(P<0.05)。
表2 各组大鼠症状评分比较Table 2 Comparison of rat symptom scores in various groups (±s,s/分)
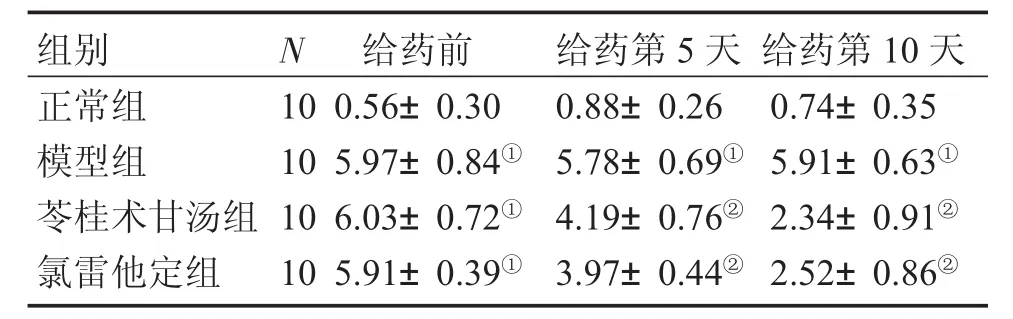
表2 各组大鼠症状评分比较Table 2 Comparison of rat symptom scores in various groups (±s,s/分)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组苓桂术甘汤组氯雷他定组N 10 10 10 10给药前0.56±0.30 5.97±0.84①6.03±0.72①5.91±0.39①给药第5天0.88±0.26 5.78±0.69①4.19±0.76②3.97±0.44②给药第10天0.74±0.35 5.91±0.63①2.34±0.91②2.52±0.86②
2.2各组外周血清IL-2、IL-4水平表3结果显示:与正常组比较,模型组的IL-2水平显著降低,血清IL-4水平显著升高,差异有统计学意义(P<0.05);与模型组比较,苓桂术甘汤组、氯雷他定组血清IL-2水平显著升高,血清IL-4水平显著降低,差异有统计学意义(P<0.05);苓桂术甘汤组IL-2、IL-4水平与氯雷他定组比较,差异均无统计学意义(P>0.05)。
表3 各组大鼠血清IL-2、IL-4水平比较Table 3 Comparison of rat serum IL-2 and IL-4 levels in various groups (±s)
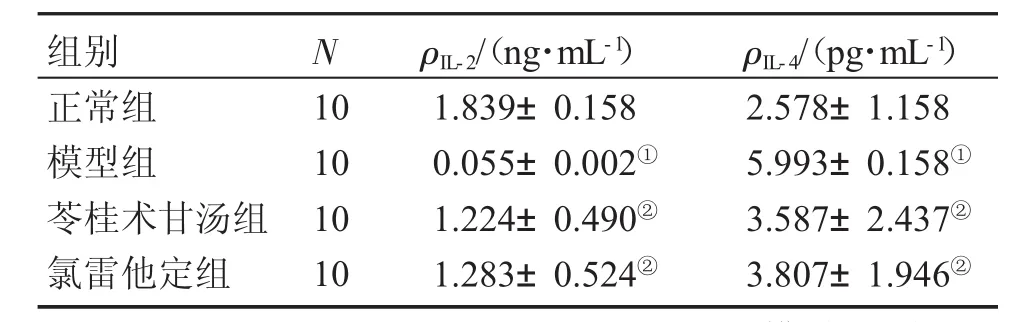
表3 各组大鼠血清IL-2、IL-4水平比较Table 3 Comparison of rat serum IL-2 and IL-4 levels in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组苓桂术甘汤组氯雷他定组N 10 10 10 10 ρIL-2/(ng·mL-1)1.839±0.158 0.055±0.002①1.224±0.490②1.283±0.524②ρIL-4/(pg·mL-1)2.578±1.158 5.993±0.158①3.587±2.437②3.807±1.946②
2.3各组鼻黏膜的细胞计数表4结果显示:与正常组比较,模型组动物的嗜酸细胞、肥大细胞计数显著增多,差异均有统计学意义(P<0.05);与模型组比较,苓桂术甘汤组、氯雷他定组嗜酸细胞、肥大细胞计数显著减少(P<0.05),差异均有统计学意义;苓桂术甘汤组嗜酸细胞、肥大细胞计数与氯雷他定组比较,差异均无统计学意义(P>0.05)。
表4 各组鼻黏膜细胞计数比较Table 4 Comparison of nasal mucosa endothelial cell count in various groups [±s,n/(个·视野-1)]
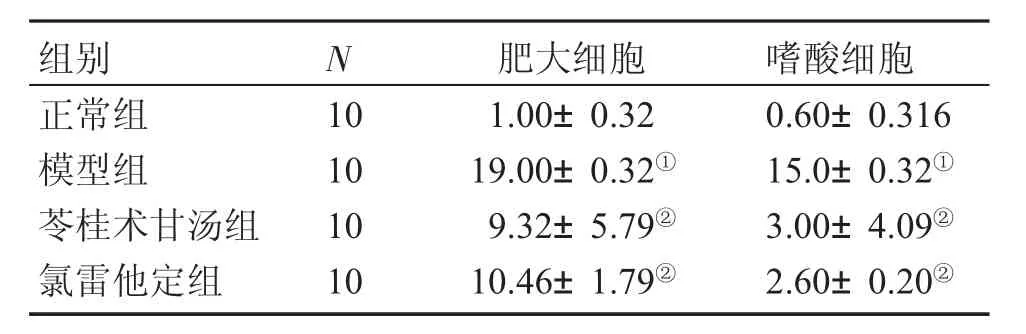
表4 各组鼻黏膜细胞计数比较Table 4 Comparison of nasal mucosa endothelial cell count in various groups [±s,n/(个·视野-1)]
①P<0.05,与正常组比较;②P<0.05,与模型组比较
组别正常组模型组苓桂术甘汤组氯雷他定组N 10 10 10 10肥大细胞1.00±0.32 19.00±0.32①9.32±5.79②10.46±1.79②嗜酸细胞0.60±0.316 15.0±0.32①3.00±4.09②2.60±0.20②
2.4各组大鼠鼻腔黏膜的病理形态比较图1、图2结果显示:正常组大鼠的鼻黏膜纤毛上皮无短缩,黏膜下腺细胞、淋巴细胞无增多,毛细血管无扩张现象,上皮下无浮肿、结缔组织无增生变性;HE染色后未见到橘红色的嗜酸细胞;甲苯胺蓝染色未见到核蓝染的肥大细胞。模型组大鼠鼻黏膜纤毛上皮短缩,黏膜下腺细胞、淋巴细胞增多,毛细血管扩张,上皮下苍白水肿、结缔组织增生变性;HE染色后嗜酸细胞增多,呈橘红色,成堆出现;甲苯胺蓝染色见肥大细胞增多,出现脱颗粒现象。苓桂术甘汤组、氯雷他定组大鼠的鼻黏膜与模型组比较,上皮下结缔组织增生变性减轻,黏膜下腺细胞、淋巴细胞减少,纤毛上皮有所恢复;HE染色后嗜酸细胞较模型组减少;甲苯胺蓝染色的肥大细胞减少,未见肥大细胞脱颗粒现象。
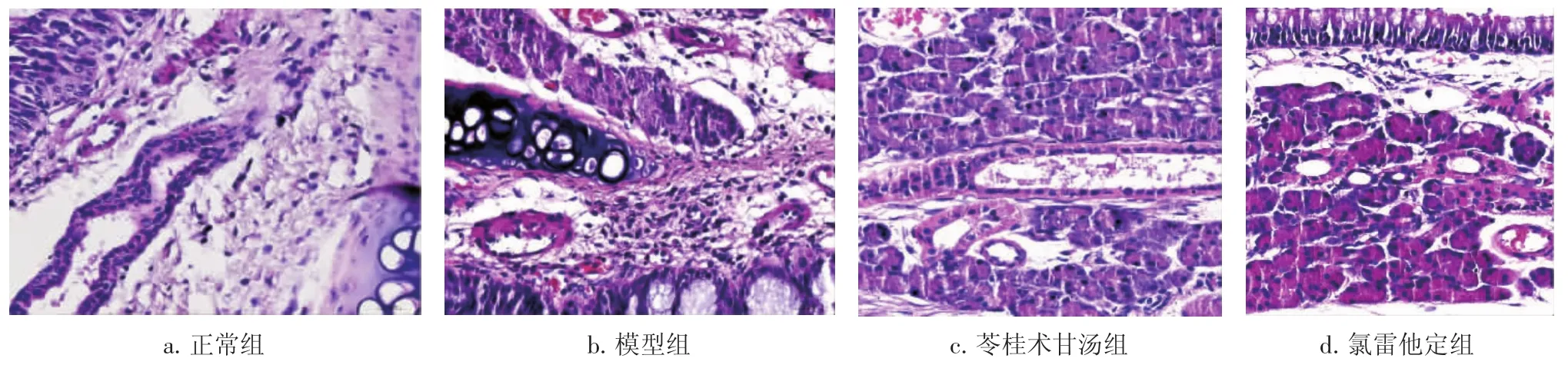
图1 各组大鼠鼻黏膜病理形态比较(HE染色,×400)Figure 1 Comparison of pathological feature of rat nasal mucosa in various groups(by HE staining,×400)
3 讨论
过敏性鼻炎与一般的慢性鼻炎不同,是鼻腔黏膜的超敏反应。过敏性鼻炎发病机制十分复杂。发病时常合并有结膜炎、皮疹、哮喘等[10],该病与哮喘是“同一个气道,两种疾病”。因为环境因素的影响和人们生活方式的改变,过敏性鼻炎发病率有日益增长的趋势,该病越来越受到耳鼻咽喉科、儿科、呼吸科等相关科室的重视。Th1与Th2的失衡是目前大多数研究比较认可的过敏性鼻炎的主要发病原因之一[11],在过敏性鼻炎个体中Th1细胞更容易活化和凋亡,Th2细胞可辅助B细胞分化为抗体分泌细胞,Th2在过敏性鼻炎中占优势,Th1分化产生的细胞因子主要有IL-2、IFN-γ、TNF-β,Th2主要分泌的细胞因子有IL-4、IL-5、IL-13。鼻腔致敏时可出现症状评分的改变[12-14],Th1与Th2的失衡[11],鼻黏膜组织中肥大细胞、嗜酸细胞计数的增多等现象[13、15]。
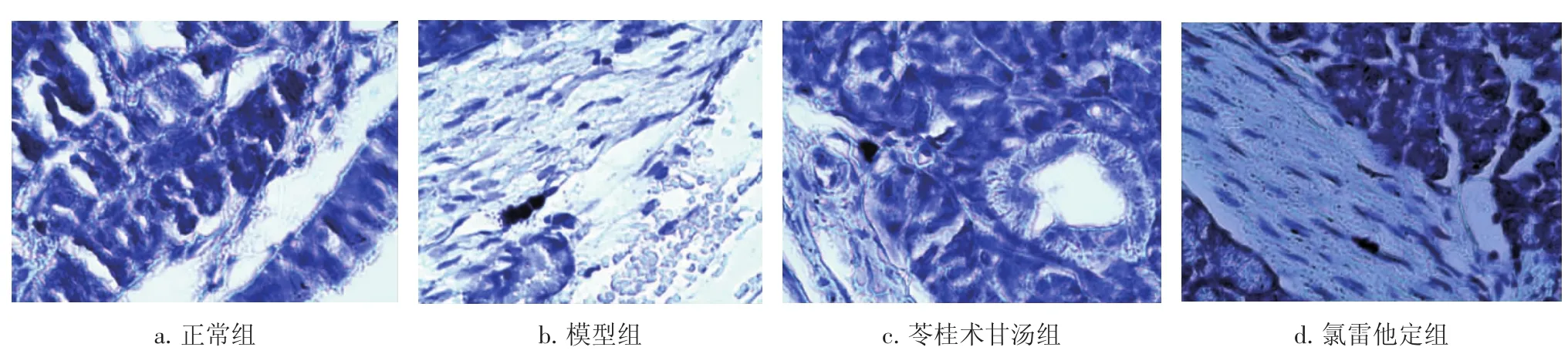
图2 各组大鼠鼻黏膜病理形态比较(甲苯胺蓝染色,×400)Figure 2 Comparison of pathological feature of rat nasal mucosa in various groups(by toluidine blue staining,×400)
本研究结果显示:模型组的症状评分、细胞因子、嗜酸细胞计数、肥大细胞计数与正常组比较有显著差异,如症状评分升高,血清IL-2水平降低,IL-4水平升高,嗜酸细胞、肥大细胞计数增多,PCA试验阳性,提示变应性鼻炎动物造模成功。用苓桂术甘汤治疗10 d后大鼠的症状评分较模型组显著降低,血清IL-2含量增加,IL-4含量降低,嗜酸细胞、肥大细胞计数减少;这些指标与氯雷他定组的比较,差异均无统计学意义。提示苓桂术甘汤对过敏性鼻炎有抗过敏作用,其作用机理可能与提高IL-2水平,降低IL-4水平,减少肥大细胞、嗜酸细胞等致敏细胞释放有关。
中医强调辨证论治,提倡“方证相对”,“有是证用是方“,苓桂术甘汤[16]为《伤寒论》中治疗水湿痰饮证的代表方剂。方中茯苓渗湿益脾,桂枝温通阳气,白术健脾燥湿,甘草甘缓补中,四药共用,具有温阳祛湿、利水化痰的功效。“痰”是人体水液代谢失调所形成的病理产物[17]。痰分为“有形之痰”和“无形之痰”,“无形之痰”是指只见痰征象,不见其形质。依据痰证的诊断标准[18-19],痰证包括咳嗽、咳痰量多、局部有圆滑肿块、胸闷、气促、呕恶,苔腻,脉或弦或滑或濡等。对比过敏性鼻炎的临床表现,其鼻部分泌物多、鼻塞、鼻甲苍白水肿、喷嚏频作、鼻痒、遇寒加重、得温症状减轻等表现都与痰证的特性相类似。究其原因,鼻鼽的发病肺、脾、肾关系最为密切,临床最常见的证型有肺气虚寒、脾气虚弱、肾阳不足、肺经郁热等。而肺、脾、肾是水液代谢的主要器官,肺、脾、肾三脏功能失调都可导致水液代谢失调,形成痰湿。痰湿属阴[20],可停聚于身体各处,易袭阳位,易蒙闭头面部清窍。鼻窍为痰湿所犯时出现鼻塞,鼻甲肿胀、鼻流清涕等现象,可见过敏性鼻炎的发生与痰有一定的关系。过敏性鼻炎具有易反复发作的特点,治疗起来周期长,期间疗效常出现波动,与痰的特点相符,古人云:“百病多由痰作祟”。
要证明“方证对应”“方证相关”[21-22]的一种方法就是“以方测证”,依据方剂的功效推测或反证病证的属性。本研究通过观察用传统方剂——苓桂术甘汤治疗过敏性鼻炎的有效性,证明过敏性鼻炎与苓桂术甘汤证相关,提示过敏性鼻炎可以看作是发生在鼻部的一种痰证,过敏性鼻炎可以从痰证的角度进行论治。该研究同时为过敏性鼻炎的辨证治疗开拓新的思路,也为苓桂术甘汤的方证研究提供一定的实验依据。
[1]阮岩.中医耳鼻咽喉科学(卫生部“十二五”规划教材)[M].北京:人民卫生出版社,2012:33.
[2]姚乃礼.中医证候鉴别诊断学[M].2版.北京:人民卫生出版社,2002:92.
[3]李赛美,李宇航.伤寒论讲义(卫生部“十二五”规划教材)[M].北京:人民卫生出版社,2012:85.
[4]李冀.方剂学(全国中医药行业高等教育“十二五”规划教材)[M].9版.北京:中国中医药出版社,2012:248.
[5]徐慧贤,阮岩,王士贞,等.大鼠肾阳虚变应性鼻炎模型的建立[J].中药新药与临床药理,2005,16(6):427.
[6]吕秋军.新药药理学研究方法[M].北京:化学工业出版社,2007:440.
[7]王朋,赵吉平,冯淬灵.基于文献研究的变应性鼻炎豚鼠模型造模评价方法的研讨[J].中国实验方剂学杂志,2014,8(4):236.
[8]赵秀杰,董震,杨占泉,等.鼻超敏反应实验模型建立[J].中华耳鼻咽喉科杂志,1993,28(l):17.
[9]王宇,严道南.脾气虚与变应性鼻炎模型大鼠相关机理的研究[J].南京中医药大学学报,2011,27(2):140
[10]张罗,韩德民.变应性鼻炎诊疗纲要[J].中国耳鼻咽喉头颈外科,2008,15(9):545.
[11]韩德民.过敏性鼻炎[M].北京:人民卫生出版社,2014:78.
[12]林小平,高军,郑岩,等.标准化屋尘螨变应原疫苗治疗的疗效评价[J].中国耳鼻咽喉头颈外科,2007,14(1):7.
[13]林小平,高军,陈萍,等.抗原特异性免疫治疗对过敏性鼻炎的疗效评价[J].解放军医学杂志,2005,30(2):121.
[14]中国过敏性鼻炎研究协作组.过敏性鼻炎皮下免疫治疗专家共识[J].中国耳鼻咽喉头颈外科,2015,22(8):379.
[15]佘文煜,张罗.鼻腔细胞学研究现状[J].中国耳鼻咽喉头颈外科,2011,18(12):642.
[16]张琦.金匮要略讲义[M].上海:上海科学技术出版社,2008:142.
[17]孙广仁,郑洪新.中医基础理论(全国中医药行业高等教育“十二五”规划教材)[M].北京:中国中医药出版社,2012:221.
[18]中华人民共和国国家标准(GB/T 16751.2-1997):中医临床诊疗术语.证候部分[S].北京:中国标准出版社,1997:8.
[19]谢蓉,彭丹虹,王燕萍.痰证相关辨证标准研究文献的分析[J].广州中医药大学学报,2015,32(2):356.
[20]郁宝生,石晓理,张国山,等.仲景辨治水湿痰饮病的方证探析[J].中医药学报,2013,41(3):5.
[21]刘丽梅,王瑞海,陈琳,等.方证现代研究中的有关概念浅析[J].中国中医基础医学杂志,2012,16(12):1103.
[22]刘燕,陈家旭,邹小娟,等.逍遥散与肝郁脾虚证方证相关研究[J].湖北中医药大学学报,2014,16(5):109.
【责任编辑:黄玲】
Study of Anti-allergic Efficacy and Mechanism of Ling Gui Zhu Gan Decoction on Allergic Rhinitis Rats
XU Huixian1,RUAN Yan2,MENG Yu1,CHEN Shu1
(1.Guangzhou University of Chinese Medicine,Guangzhou 510405 Guangdong,China;2.The First Affiliated Hospital of Guangzhou University of Chinese Medicine,Guangzhou 510405 Guangdong,China)
ObjectiveTo observe the anti-allergic effect and mechanism of Ling Gui Zhu Gan Decoction (LGZGD)in treating allergic rhinitis.Methods Forty SD rats were randomly divided into 4 groups,namely normal group,model group,LGZGD group and Loratadine group.Rats of model group,LGZGD group and Loratadine group were sensitizated with intraperitoneal injection and intranasal dripping of ovalbumin to induce allergic rhinitis,while rats of the normal group were given normal saline instead of ovalbumin.After successful establishment of the model,the model group was treated with normal saline orally,LGZGD group and Loratadine group were given gastric gavage of LGZGD 3.24 g·kg-1·d-1and Loratadine solution 0.9 mg·kg-1·d-1respectively.On the 5th and 10th day of medication,the changes in animals behavioral scores,cytokines and nasal mucosa epithelial cells were observed.Results Before medication,the behavioral scores in the model group,LGZGD group and Loratadine group had significant difference from those in the normal group(P<0.05). On the 10th day of the medication,the behavioral scores,serum interleukin-2(IL-2)and IL-4 levels,and nasal mucosal cell count in LGZGD group and Loratadine group had difference from those in the model group (P<0.05);however,the experimental indexes of LGZGD group had no difference from those of Loratadine group(P>0.05).Conclusion LGZGD has anti-allergic effect on allergic rhinitis through relieving the symptoms,and its therapeutic mechanism is probably related with the increase of IL-2 level,the decrease of IL-4 level and the reduction of release of eosinophils and mast cells from the tissues.
Ling Gui Zhu Gan Decoction;allergic rhinitis/TCD therapy;nasal mucosa/pathology;disease models,animal;rats
R285.5
A
1007-3213(2016)04-0531-05
10.13359/j.cnki.gzxbtcm.2016.04.021
2016-03-08
徐慧贤(1971-),女,在读博士研究生,副主任医师;E-mail:xhxhe@126.com
阮岩(1963-),男,教授,博士研究生导师;E-mail:ruanyan63@163.com
国家自然科学基金资助项目(编号:81373697)
