固载脂肪酶纳米TiO2/PD复合材料合成条件优化及表征
2016-09-07郑述祥陶玉贵朱龙宝堵国成安徽工程大学生物与化学工程学院安徽芜湖241000
郑述祥,陶玉贵,朱龙宝,堵国成(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
固载脂肪酶纳米TiO2/PD复合材料合成条件优化及表征
郑述祥,陶玉贵∗,朱龙宝,堵国成
(安徽工程大学生物与化学工程学院,安徽芜湖241000)
利用多巴胺(PD)对纳米二氧化钛进行修饰,制备固载脂肪酶TiO2/PD复合材料,并通过响应面法对p H值、多巴胺质量浓度、反应时间等合成条件进行了优化,以提高脂肪酶固载率;利用FT-IR、热分析对TiO2/PD复合材料进行表征.结果表明:在p H值为8.79、多巴胺质量浓度为1.98 mg/m L、反应时间为7.42 h条件下合成的TiO2/PD复合材料脂肪酶固载率最高,达到了274.26 mg/g;FT-IR表征中在1 277 cm-1和1 483 cm-1出现的多巴胺特征峰以及热分析表征中多巴胺在300℃左右出现热分解,表明了多巴胺对纳米二氧化钛的修饰.利用多巴胺对纳米TiO2的表面修饰,有效提高了纳米TiO2的脂肪酶固载率.
纳米TiO2;多巴胺;脂肪酶;响应面;表征
脂肪酶又称三酰甘油酯水解酶(EC3.1.1.3),被广泛应用于医药、化工、食品和化妆品等行业,但游离脂肪酶在使用过程中易随环境的变化而变性失活,且不易从反应体系中分离,在一定程度上限制了脂肪酶的应用[1].固定化酶技术因具有重复利用酶催化活性、实现连续自动化生产及降低成本等优点,因而获得广泛研究[2].作为固定化技术的重要组成部分,载体的性能直接影响着酶的性能.纳米TiO2具有化学惰性、无毒无害、生物亲和性好等特点,成为酶固定化的优良载体[3].
目前,纳米TiO2对脂肪酶的固定化主要是通过物理吸附将脂肪酶直接吸附在其表面,其固载率较低[4],因此,需要对TiO2进行修饰以提高固载率.修饰可以分为物理修饰和化学修饰,其中化学修饰由于载体和修饰剂之间发生化学反应,修饰效果良好,被广泛采用[5].目前用于TiO2化学修饰的修饰剂主要包括聚乙烯亚胺、聚苯胺等,存在着生物毒性大、包裹能力差等缺点[6].多巴胺是一种具有仿生粘附特性的物质,具有优良的生物相容性[7].研究发现,利用多巴胺自氧化聚合可在无机纳米材料表面形成聚多巴胺包覆层[8].Lee[9]等成功地在纳米二氧化硅表面修饰一层薄的、具有强黏附性的聚多巴胺层,赋予材料良好的稳定性与相容性.Shi J[10]等制备了CaCO3@PDA微球用于固定化过氧化氢酶,结果表明微球具有较高的固载效率,且过氧化氢酶的稳定性增强.然而,通过多巴胺自聚合于纳米二氧化钛表面固载脂肪酶的相关研究报道较少.
利用多巴胺(PD)对纳米二氧化钛进行修饰,合成TiO2/PD复合材料,并以脂肪酶固载率为指标,利用Plackett-Burman设计对5个因素进行筛选,再用Box-Behnken实验进一步优化,确定最优合成条件,并以此条件合成TiO2/PD复合材料,利用FT-IR、热分析对其进行表征.
1 材料与方法
1.1材料与试剂
钛酸四正丁酯(CP,国药集团化学试剂有限公司);无水乙醇、氨水、乙腈、磷酸钠、脂肪酶(AR,国药集团化学试剂有限公司);盐酸多巴胺(AR,Sigma公司);BCA试剂盒(AR,生工生物工程股份有限公司).
1.2纳米TiO2及TiO2/PD复合材料合成方法
将0.38 g氨水(28%),X(X=0.53,1.06,1.59,2.12,2.64,3.17)g水加入到乙醇和乙腈的混合液(体积比为3∶2)中,快速搅拌;向上述溶液中迅速加入5m L钛酸四正丁酯,室温搅拌6 h,离心,乙醇、水分别洗两次,60℃干燥6 h,制得纳米TiO2.
将纳米TiO2加入到50 m L Tris-HCl缓冲液(p H 8.5,10 m M)中,超声分散15 min,加入125 mg盐酸多巴胺,20℃下搅拌6 h,搅拌速度为500 r/min,离心收集,水洗3次,制得TiO2/PD复合纳米粒子,最后将TiO2/PD复合粒子分散在超纯水中(1 mg/m L).
1.3TiO2/PD复合材料固定化脂肪酶
取0.06 g酶加入到30 m L磷酸钠缓冲液(10 m M,p H 7.0)中;0.1 g TiO2/PD复合粒子加入到50 m L超纯水中.将两种溶液混合,4℃搅拌3 h,离心收集,水洗3次,冷冻干燥(-80℃,12 h).
在MATLAB/Simulink中搭建光储电站的模型,设直流母线电压为400 V,储能电池的容量为3×103 Ah,电动汽车的容量为15 kWh,仿真时间为24 h。为了突出电动汽车对改善光储电站直流母线电压质量的作用,设置以下4种算例进行验证,分别为无电动汽车接入、10辆电动汽车接入、10辆电动汽车接入(光伏功率发生波动)和20辆电动汽车接入。
1.4优化方法
(1)单因素实验.TiO2/PD复合材料的制备过程一般受p H值、多巴胺质量浓度、反应时间、搅拌速度、反应温度等因素的影响.其单因素水平为:①反应时间6 h,多巴胺质量浓度2.0 mg/m L,搅拌速度500 r/min,反应温度20℃,p H值为4.5、5.5、6.5、7.5、8.5、9.5.②p H值8.5,反应时间6 h,搅拌速度500 r/min,反应温度20℃,多巴胺质量浓度为0.5 mg/m L、1.0 mg/m L、1.5 mg/m L、2.0 mg/m L、2.5 mg/m L、3.0 mg/m L.③p H值8.5,多巴胺质量浓度2.0 mg/m L,搅拌速度500 r/min,反应温度20℃,反应时间为2 h、3 h、4 h、6 h、8 h、9 h.④p H值8.5,多巴胺质量浓度2.0 mg/m L,反应时间6 h,反应温度20℃,搅拌速度为300 r/min、400 r/min、500 r/min、600 r/min、700 r/min.⑤p H值8.5,多巴胺质量浓度2.0 mg/m L,反应时间6 h,500 r/min,反应温度为0、10℃、20℃、30℃、40℃.
(2)Plackett-Burman实验.根据单因素实验结果,选取5个影响因素,进行12次实验,并对其重要性进行筛选(自变量、编码和水平因素见表1).

表1 Plackett-Burman实验因素与水平表
(3)Box-Behnken实验.以Plackett-Burman实验筛选得到的显著影响TiO2/PD复合材料合成的因素作为设计因素,根据相应的实验表(见表2)进行实验,并对实验结果进行响应面分析.

表2 Box-Behnken实验因素与水平
1.5固载率的测定方法
脂肪酶固载率的计算.脂肪酶固载率=CV/M,其中,C为样品蛋白浓度(μg/m L);V为体积(m L);M为TiO2/PD复合材料加入的质量(g).
2 结果与讨论
2.1TiO2/PD复合材料合成条件优化
(1)p H值对TiO2/PD复合材料合成过程的影响.p H值对TiO2/PD复合材料的合成起着重要作用,在碱性的环境下多巴胺易发生聚合反应形成聚多巴胺,从而实现对纳米TiO2的修饰.p H值对TiO2/PD复合材料合成过程的影响如图1所示.由图1可以看出,随着p H值的增大,TiO2/PD复合材料对脂肪酶的固载率增大.在酸性条件下,聚多巴胺形成量较少,导致脂肪酶固载率较低;碱性条件下,聚多巴胺大量形成,脂肪酶固载率得到明显提高;p H达到8.5,继续增大p H值,脂肪酶的固载率变化不大.因此,选取p H值8.5为最优的合成条件.
(2)多巴胺质量浓度对TiO2/PD复合材料合成过程的影响.多巴胺质量浓度对TiO2/PD复合材料合成过程的影响如图2所示.由图2可以看出,在多巴胺质量浓度为2.0 mg/m L时,TiO2/PD复合材料的脂肪酶固载率最大,继续增加多巴胺质量浓度,脂肪酶固载率变化不大,甚至出现固载率降低的现象,这可能是由于过量的多巴胺引起复合材料的团聚,不利于对脂肪酶的固载.选取多巴胺质量浓度2.0 mg/m L为最优的合成条件.
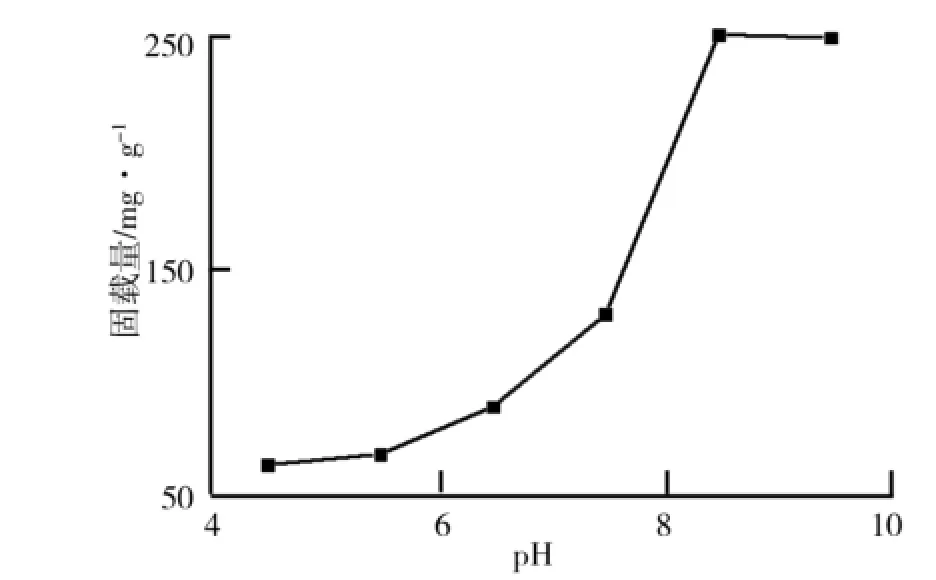
图1 p H值对TiO2/PD复合材料合成过程的影响

图2 多巴胺质量浓度对TiO2/PD复合材料合成过程的影响
(3)反应时间对TiO2/PD复合材料合成过程的影响.反应时间对TiO2/PD复合材料合成的影响如图3所示.由图3可以看出,在反应时间为6 h时,脂肪酶固载率最大,继续延长搅拌时间,脂肪酶固载率变化不大,这是因为搅拌6 h,多巴胺已全部发生反应.因此,选取反应时间6 h为最优合成条件.
(4)搅拌速度对TiO2/PD复合材料合成过程的影响.搅拌速度对TiO2/PD复合材料合成过程的影响程度如图4所示.由图4可以看出,改变搅拌速度,TiO2/PD复合材料对脂肪酶固载率发生了略微变化,变化幅度不大,在500 r/min时出现峰值,且随着搅拌速度的增大,也增大了实验操作的难度.因此,选取搅拌速度500 r/min为最优的合成条件.

图3 反应时间对TiO2/PD复合材料合成过程的影响

图4 搅拌速度对TiO2/PD复合材料合成过程的影响

图5 反应温度对TiO2/PD复合材料合成过程的影响
(5)反应温度对TiO2/PD复合材料合成过程的影响.反应温度对TiO2/PD复合材料合成过程的影响情况如图5所示.由图5可以看出,随着反应温度的逐渐升高,TiO2/PD复合材料对脂肪酶固载率呈现略微增大的趋势,并且在温度为20℃时出现峰值.因此,选取反应温度20℃为最优的合成条件.
(6)Plackett-Burman实验.Plackett-Burman实验结果如表3所示.对表3中TiO2/PD复合材料的合成进行回归分析,得到各影响因素的偏回归系数及其显著性(见表4).实验结果表明,搅拌速度和反应温度对TiO2/PD复合材料的合成并无太大影响.综合考虑,选择反应p H、多巴胺质量浓度、反应时间进行进一步的优化.
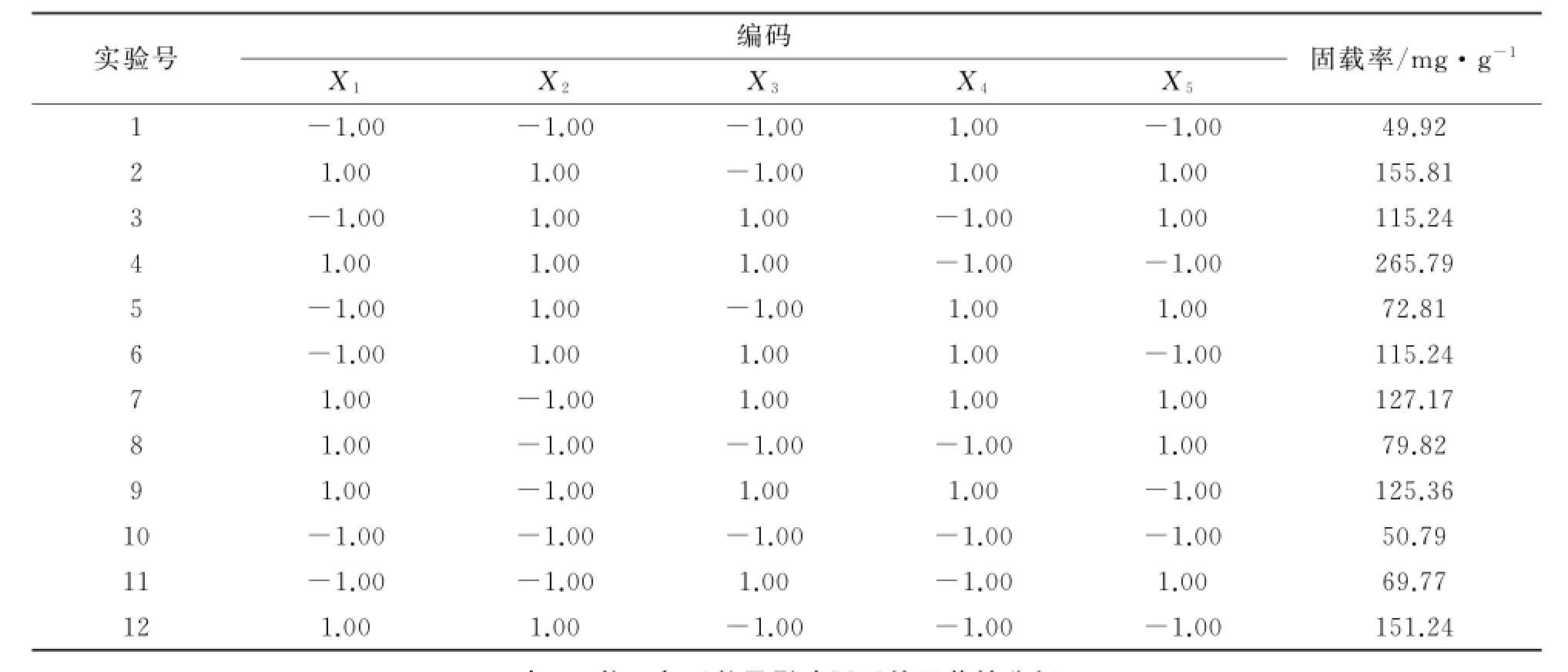
表3 Plackett-Burman实验设计结果

表4 偏回归系数及影响因子的显著性分析
(7)确定最佳合成条件.以p H值、多巴胺质量浓度、反应时间3个重要因素为自变量,Box-Behnken实验设计及结果如表5所示.
利用Design Experts 8.0软件对表5的结果进行多元回归分析,得到二阶回归方程:

式中,R1为固载率;X1为反应p H值;X2为多巴胺质量浓度;X3为反应时间.

表5 Box-Behnken实验设计及结果
对该模型进行回归方差分析与显著性检验,结果如表6所示.分析结果显示,P值<0.000 1,该模型显著,失拟项P值为0.209 0,说明该实验的失拟项不显著.相关系数R2=0.962 7,说明可用该方程代替实验结果进行分析,响应面立体分析图如图6所示.由图6可以看出,在p H值为8.79、多巴胺质量浓度为1.98 mg/m L、反应时间为7.42 h时合成的TiO2/PD复合材料脂肪酶固载率最高,最高值达到280.85 mg/g.
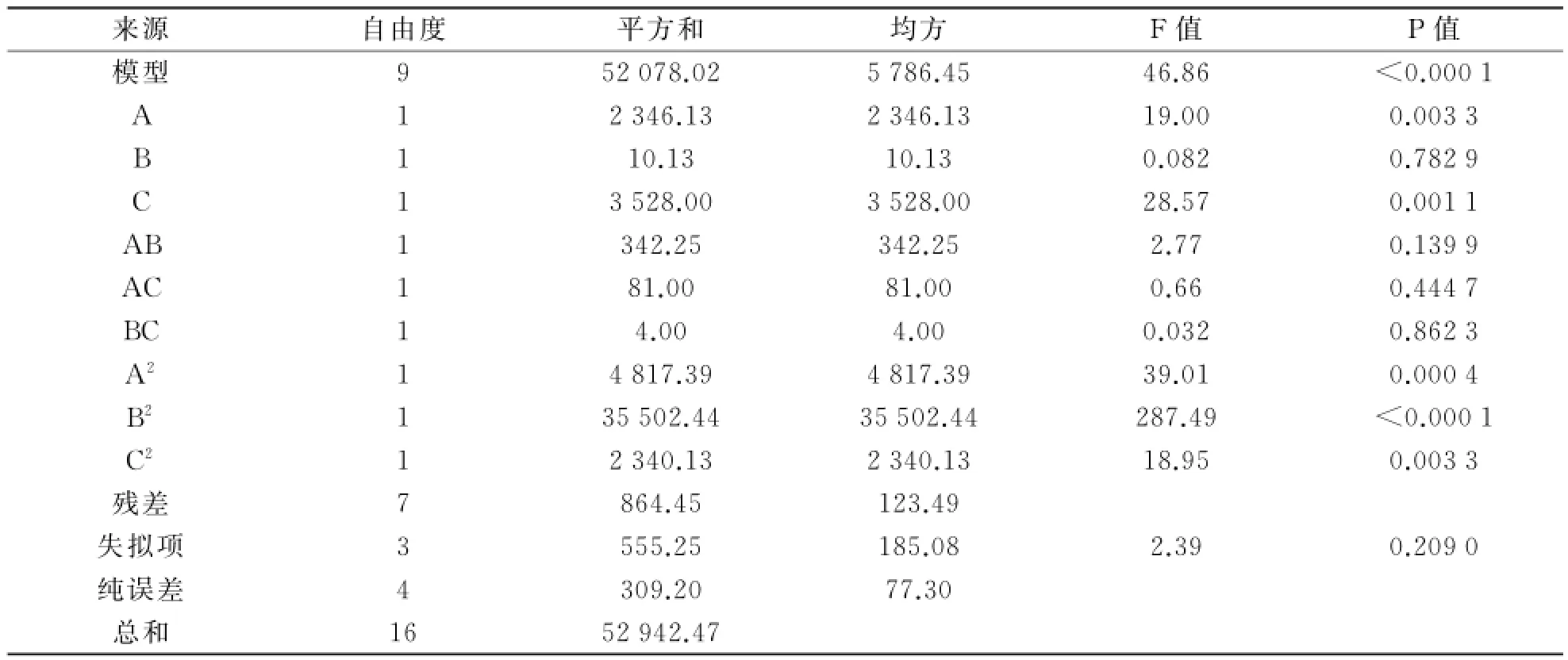
表6 回归方程的方差分析

图6 各因素交互影响固载率的曲面图
(8)验证实验结果.按照响应面实验结果,在p H值为8.79、多巴胺质量浓度为1.98 mg/m L、反应时间为7.42 h的条件下合成TiO2/PD复合材料,以此验证模型的可靠性,3次平行实验测得的TiO2/PD复合材料脂肪酶固载率平均值为274.26 mg/g.
2.2TiO2/PD复合材料表征
(1)FT-IR表征.试验利用FT-IR对TiO2及TiO2/PD复合材料进行了表征,结果如图7所示.图7a曲线为纳米TiO2的红外光谱图,由图7a可以看出,在669 cm-1和3 429 cm-1左右处出现了红外吸收峰,分别为TiO2中钛氧键和羟基的特征峰[11],表明二氧化钛表面存在着羟基;图7b曲线为TiO2/PD复合材料的红外光谱图,由图7b可以看出,曲线中羟基峰的消失,这可能是羟基参与了与多巴胺的反应,从而佐证了多巴胺的修饰,同时在1 277 cm-1和1 483 cm-1处出现了红外吸收峰,分别为苯环上C-O键、C-C键的特征峰[12],而3 410 cm-1处的红外吸收峰为芳香族O-H键特征峰[13],这些吸收峰的出现表明了多巴胺的修饰.

图7 TiO2和TiO2/PD复合材料的FT-IR图
(2)热分析.试验对纳米TiO2和TiO2/PD复合材料分别进行了热分析:DTA/TGA分析和TGA/ DTG分析.为了更直观地看出样品的失重阶段和失重速率,试验对DTG曲线做一阶微分即得TGA/DTG图,样品的热分析图如图8所示.由图8a和图8b可以看出,随着温度升高至800℃,样品存在一个失重过程:在0~100℃时,样品出现了失重过程,这主要是样品中物理吸附水脱附所造成的,且在65℃失重速率达到最大.由图8c和图8d可以看出,随着温度升高至800℃,样品存在两个失重过程:在0~100℃时,由于物理吸附水的脱附,出现了失重过程;在300~500℃时,样品出现了失重过程,且在460℃时失重速率达到最大,主要是多巴胺热分解造成的.对应的样品DTA曲线可以看出,在410℃出现了一个吸热峰,佐证了多巴胺的热分解.

图8 样品的热分析图
3 结论
通过多巴胺(PD)对纳米二氧化钛的修饰,合成了TiO2/PD复合材料,并以材料的脂肪酶固载率为检测指标,研究了p H值、多巴胺质量浓度、反应时间、搅拌速度、反应温度对复合材料合成过程的影响.首先通过Plackett-Burman法对5个单因素进行筛选,确定了p H值、多巴胺质量浓度、反应时间3个主要影响因素,然后利用Box-Behnken实验进一步优化.结果表明,在p H值8.79、多巴胺质量浓度1.98 mg/m L、反应时间7.42 h时,合成的TiO2/PD复合材料脂肪酶固载率最高,达到274.26 mg/g.利用FT-IR、热分析对其进行表征.FT-IR中在1 277 cm-1和1 483 cm-1处出现的特征峰分别为苯环上C-O键、C-C键的特征峰,表明了多巴胺的成功修饰;热分析中300~500℃的失重区间也佐证了多巴胺的成功修饰.试验结果表明多巴胺对纳米TiO2的表面进行了修饰,有效地提高了纳米TiO2的脂肪酶固载率.
[1]朱运平,刘文清,李秀婷,等.葡萄糖氧化酶的固定化及其在快速检测中的应用研究现状[J].食品工业科技,2014,35(4):397-400.
[2]林建城,张雄.复合载体固定化果胶酶澄清枇杷果汁的工艺优化[J].食品科技,2015,40(5):49-54.
[3]H Shi,R Magaye,V Castranova,et al.Titanium Dioxide Nanoparticles:A Review of Current Toxicological Data[J].Part Fibre Toxicol,2013,10(1):1-33.
[4]S Wu,Z Weng,X Liu,et al.Functionalized TiO2Based Nanomaterials for Biomedical Applications[J].Advanced Functional Materials,2014,24(35):5 464-5 481.
[5]梁彦鹏.功能化TiO2微球表面共价固定化酶及催化活性和稳定性研究[D].天津:天津大学,2012.
[6]H Wu,Y Liang,J Shi,et al.Enhanced Stability of Catalase Covalently Immobilized on Functionalized Titania Submicrospheres[J].Materials Science and Engineering:C,2013,33(3):1 438-1 445.
[7]X Liu,J Cao,H Li,et al.Mussel-inspired Polydopamine:A Biocompatible and Ultrastable Coating for Nanoparticles in Vivo[J].ACS nano,2013,7(10):9 384-9 395.
[8]W Wang,R Li,M Tian,et al.Surface Silverized Meta-aramid Fibers Prepared by Bio-inspired Poly(dopamine)Functionalization[J].ACS Applied Materials&Interfaces,2013,5(6):2 062-2 069.
[9]Y Liu,K Ai,L Lu.Polydopamine and Its Derivative Materials:Synthesis and Promising Applications in Energy,Environmental,and Biomedical Fields[J].Chemical Reviews,2014,114(9):5 057-5 115.
[10]J Shi,C Yang,S Zhang,et al.Polydopamine Microcapsules with Different Wall Structures Prepared by a Template-mediated Method for Enzyme Immobilization[J].ACS Applied Materials&Interfaces,2013,5(20):9 991-9 997.
[11]S K Gupta,J Singh,K Anbalagan,et al.Synthesis,Phase to Phase Deposition and Characterization of Rutile Nanocrystalline Titanium Dioxide(TiO2)Thin Films[J].Applied Surface Science,2013,264:737-742.
[12]M Zhao,C Deng,X Zhang.Synthesis of Polydopamine-coated Magnetic Graphene for Cu2+Immobilization and Application to the Enrichment of Low-concentration Peptides for Mass Spectrometry Analysis[J].ACS Applied Materials& Interfaces,2013,5(24):13 104-13 112.
[13]R Zhang,Y Su,X Zhao,et al.A Novel Positively Charged Composite Nanofiltration Membrane Prepared by Bio-inspired Adhesion of Polydopamine and Surface Grafting of Poly(ethylene imine)[J].Journal of Membrane Science,2014,470:9-17.
Characterization and Optimization of Synthesis Conditions of Nano TiO2/PD Composite Materials for Immobilizing Lipase
ZHENG Shu-xiang,TAO Yu-gui∗,ZHU Long-bao,DU Guo-cheng
(College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
The TiO2/PD composite materials for immobilizing lipase were synthesized by using nano TiO2modified by dopamine.The response surface method was used to obtain the optimal synthesis conditions,including p H,dopamine concentration,reaction time and the characteristics of TiO2/PD.The composite materials were determined by FT-IR and thermal analysis.The results showed that the optimal conditions were as follows:p H 8.79;dopamine concentration 1.98 mg/m L;reaction time 7.42 h.On this conditions,the lipaseis immobilization rate of TiO2/PD composite reaches 274.26 mg/g.The surface layer of nano-TiO2was modified by dopamine using FT-IR and Thermal analysis.The results showed the peaks of dopamine were at 1 277 cm-1and 1 483 cm-1and was decomposed about 300℃.The nano TiO2modified by dopamine can improve the lipase immobilization rate effectively.
nano TiO2microspheres;dopamine;lipase;response surface method;characterization
R318.08
A
1672-2477(2016)04-0030-07
2015-12-31
安徽省自然科学基金资助项目(1308085 MC51)
郑述祥(1989-),男,安徽滁州人,硕士研究生.
陶玉贵(1965-),男,安徽无为人,教授,硕导.
