早期肺腺癌EGFREGFR基因突变的相关因素研究△
2016-09-06张丽吴宁李蒙应建明孙巍吕律林冬梅国家癌症中心中国医学科学院北京协和医学院肿瘤医院影像诊断科PETCT中心北京000北京肿瘤医院病理科北京0006
张丽吴宁,#李蒙应建明孙巍吕律林冬梅国家癌症中心/中国医学科学院北京协和医学院肿瘤医院影像诊断科,PET-CT中心,北京000北京肿瘤医院病理科,北京0006
早期肺腺癌EGFREGFR基因突变的相关因素研究△
张丽1吴宁1,2#李蒙1应建明1孙巍3吕律1林冬梅3
国家癌症中心/中国医学科学院北京协和医学院肿瘤医院1影像诊断科,2PET-CT中心,北京100021
3北京肿瘤医院病理科,北京100036
目的探讨早期(cT1N0M0期)肺腺癌EGFR突变的临床、病理及高分辨率CT(HRCT)相关因素,为早期肺腺癌患者术后行EGFR基因检测提供参考。方法回顾性分析行手术切除且术后采用DNA直接测序法完成EGFR基因突变状态检测的82例cT1N0M0期肺腺癌患者的病历资料。采用卡方检验、t检验、秩和检验分析临床、病理学及HRCT特征在EGFR有效突变组与非有效突变组中的差异;相关因素的界值采用ROC曲线确定;采用Logistic回归分析探寻EGFR突变的独立危险因素。结果 82例肺腺癌中发生EGFR基因有效突变53例,非有效突变(包括野生型、无效突变)29例。EGFR有效突变组与非有效突变组在性别(P=0.017),年龄(P=0.005),吸烟与否(P=0.004),是否为乳头为主型(P=0.048),病灶大小(P=0.019)的差异具有统计学意义。患者年龄≥60岁(OR=6.852,95%CI 1.985~23.652,P=0.002)为cT1N0M0期肺腺癌EGFR基因有效突变的独立危险因素。结论cT1N0M0期肺腺癌中女性、年龄≥60岁、无吸烟、病理亚型为乳头为主型和病灶≥1.6 cm者出现EGFR有效突变概率较大。对于具有这些因素的cT1N0M0期肺腺癌患者,可考虑推荐于术后行EGFR基因检测。
肺腺癌;表皮生长因子受体;突变;体层摄影术;X线计算机;病理学
Oncol Prog,2016,14(5)
肺腺癌是一种具有遗传异质性的疾病[1]。遗传学研究发现肺腺癌患者存在一些特异性的基因[2-4],这些突变的基因可以做为相应药物的靶点,从而对该类患者进行个体化内科治疗[5],表皮生长因子受体(epidermal growth factor receptor,EGFR)基因就是其中的一个。EGFR广泛分布于人体多种组织细胞膜上,是一种受体酪氨酸激酶(receptor tyrosine kinase,RTK),在肿瘤的发生、进展中起着重要作用[6-7]。具有靶向治疗意义的EGFR突变,目前已查明主要有三种形式:外显子18、19和21突变,其中外显子19、21突变约占80%[8-9],外显子18突变发生率很低。外显子20突变与耐药有关,不作为指导EGFR-TKI治疗的有效突变。
2013年9月美国病理学会(CAP)、国际肺癌研究学会(IASLC)和美国分子病理学学会(AMP)三大权威学术机构发布了一项肺癌分子学检测指南[10],该指南指出EGFR检测最佳时机为适合治疗的晚期肺癌患者确诊时或者早期肺癌患者疾病复发或进展时。对于早期肺腺癌在初诊时是否行EGFR状态检测,指南并未明确规定,但是认为应该鼓励患者进行检测。本研究旨在通过分析cT1N0M0期肺腺癌EGFR有效突变的临床、病理及高分辨率CT(HRCT)相关因素,筛选发生EGFR有效突变的高危人群,为早期肺腺癌患者术后行EGFR基因检测提供参考。
1 资料与方法
1.1一般资料
选取2005年1月至2012年12月在中国医学科学院肿瘤医院经手术切除的cT1N0M0期肺腺癌患者82例,男性42例(51.2%),女性40例(48.8%);年龄35~78岁,平均年龄(58.04±10.49)岁。患者入组标准:PACS内存有完整的术前HRCT扫描图像(包括连续薄层重建图像);CT图像病灶肺窗轴位最大层面直径≤3 cm,影像学检查无淋巴结转移及远处转移的证据;CT检查前未行穿刺活检或任何抗肿瘤治疗;手术病理证实为腺癌,并于术后行EGFR基因检测;病理切片保存完整,能够复阅,临床资料保存完整。入组患者的临床、病理资料详见表1。
1.2 HRCT扫描方法
82例患者均行HRCT扫描,采用GE 64层螺旋CT扫描38例,GE 16层螺旋CT扫描23例,Toshiba 64层螺旋CT扫描21例;进行增强扫描48例。扫描参数为矩阵512×512,层厚/层间距5 mm容积扫描,重建层厚1.0 mm或1.25 mm,重建层间距0.8 mm或1.0 mm。扫描图像常规传送到PACS系统进行储存。行增强扫描者以2.5~3.0 ml/s的流率用压力注射器经肘静脉注入非离子型碘对比剂(300 mg/ml)95 ml,静脉注射30 s后开始扫描。
1.3组织病理学特征分析及基因检测
对石蜡包埋、HE染色的病理切片进行复阅。按2011年国际肺癌研究协会(IASLC)/美国胸科学会(ATS)/欧洲呼吸学会(ERS)肺腺癌分类标准,由1名具有肺癌研究专长的病理医师(8年以上工作经验)逐张复阅病理切片。对于分型、分级困难的病例由肿瘤病理专家(30年工作经验,具有肺癌专长)会诊后决定。重新分类的病理亚型有原位腺癌、微浸润腺癌、附壁成分为主型浸润腺癌,乳头成分为主型浸润腺癌,微乳头成分为主型浸润腺癌,实体成分为主型浸润腺癌,浸润性腺癌变异型。对腺癌中的浸润成分(附壁、腺泡、乳头、微乳头和实体)以5%增加方式进行半定量记录。根据镜下肿瘤细胞与正常细胞的接近程度,分为高分化、中分化和低分化。

表1 8282例患者的基本临床和病理特征
使用DNA直接测序法对EGFR基因18、19、20、21号外显子突变情况进行检测。根据突变情况分为有效突变和非有效突变。有效突变包括18、19、21号外显子突变,非有效突变包括20号外显子突变和野生型。
1.4 HRCT图像特征分析
HRCT图像的形态学征象包括病灶直径、密度类型、病灶位置、边缘、坏死情况,病灶内是否有含气成分。病灶直径指在横轴位肺窗(窗位:-600 HU,窗宽:1600 HU)上测量的最大直径,单位为厘米(cm);位置根据肿瘤中心距肋胸膜的垂直距离是否≥3 cm分为中央病变和外周病变[11];按密度类型将病灶分为纯磨玻璃密度结节,部分实性结节和实性结节[12];边缘分为光滑、分叶和毛刺;坏死情况根据在实性成分中是否出现明显低密度区域来判断;病灶中含气成分根据肺窗(窗位:-600 HU,窗宽:1600 HU)上是否存在明显透亮区域判断。定量分析指标包括实性成分比例、磨玻璃成分比例(测量方法见既往文章[13])。复阅HRCT前告知两位影像医师所阅病例为经手术切除的肺腺癌,但未告知具体的组织学亚型、病理分期及EGFR检测状态。
1.5统计学方法
所有检验均应用SPSS 17.0统计软件分析,计数数据(性别、吸烟状况、病理亚型、是否有附壁成分,是否为腺泡为主型,是否为乳头为主型,是否为附壁为主型,分化程度、病变类型、病变位置、坏死情况、是否有含气成分)的差异采用卡方检验;计量数据(年龄、附壁成分比例、磨玻璃成分比例、实性成分比例)的差异采用t检验或秩和检验;按年龄、病灶直径区分EGFR有效突变与非有效突变的界值采用ROC曲线分析确定;相关因素与EGFR有效突变的独立危险度分析采用Logistic回归分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 EGFR有效突变的相关因素
2.1.1临床和病理相关因素EGFR有效突变在不同性别、年龄、吸烟与否的cT1N0M0肺腺癌患者中的差异均有统计学意义(P=0.017,0.028,0.004)。根据ROC曲线分析结果,年龄的界值为60岁(图1)。以60岁为界,将病例分为<60岁组和≥60岁组,EGFR有效突变在两组中的差异有统计学意义(P=0.005)。EGFR有效突变在不同分化程度组、是否含有附壁成分组之间的差异均无统计学意义(P=0.288,0.069)。由于重新进行组织学分型后部分亚型组病例数过少,因此本研究并没有对EGFR有效突变在不同组织学亚型的腺癌中差异做统计学检验。82例病例中腺泡为主型肺腺癌为最主要的亚型(52/82,63.4%),但该亚型腺癌与其他亚型腺癌的EGFR有效突变差异无统计学意义(P= 0.252)。通过分析发现,82例cT1N0M0肺腺癌患者中,发生EGFR有效突变率最高的组织学亚型为乳头为主型浸润性腺癌(突变率为100%),其次为附壁为主型浸润性腺癌(突变率为87.5%)。将这两种亚型腺癌组分别与其他亚型腺癌组的突变率进行比较,乳头为主型浸润性腺癌组与其他亚型组间的差异有统计学意义(P=0.041),附壁为主型浸润性腺癌组与其他亚型组间的差异无统计学意义(P=0.154)。(表2)
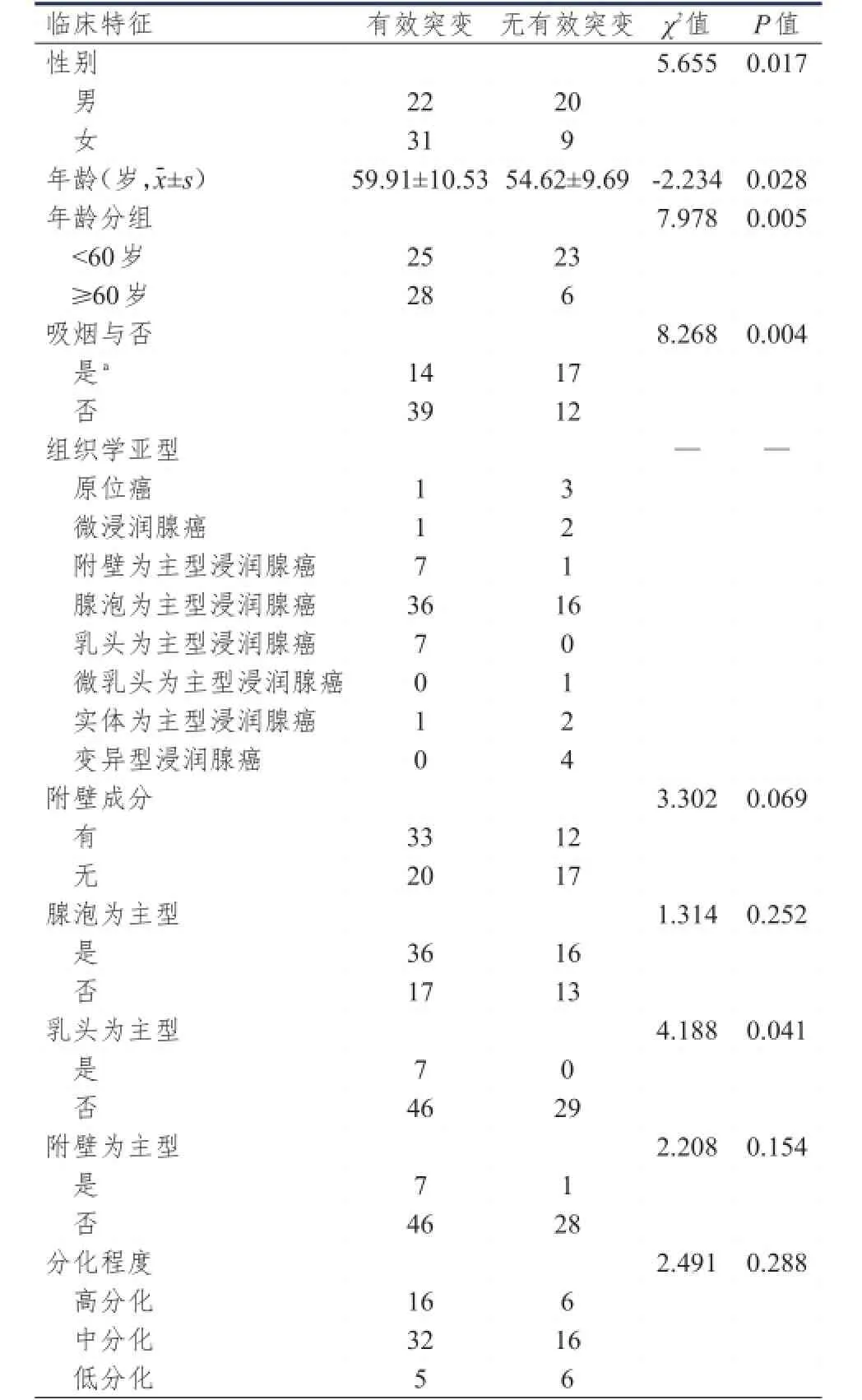
表2 EGFREGFR基因有效突变与相关临床特征的关系
2.1.2影像学相关因素cT1N0M0肺腺癌的病灶直径在EGFR有效突变组和非有效突变组中的差异有统计学意义(P=0.04)。根据ROC曲线分析结果,病灶直径的界值为1.6 cm(图1)。以病灶直径1.6 cm为界,将病例分为<1.6 cm组和≥1.6 cm组,EGFR有效突变在两组中的差异有统计学意义(P= 0.019)。EGFR有效突变在不同密度类型,磨玻璃成分比例,实性成分比例,病灶位置,病灶边缘,肿瘤内坏死,肿瘤内是否有含气成分的差异均无统计学意义(P>0.05)。(表3)

图1 确定EGFREGFR有效突变的发病年龄和病灶直径界值的ROCROC曲线
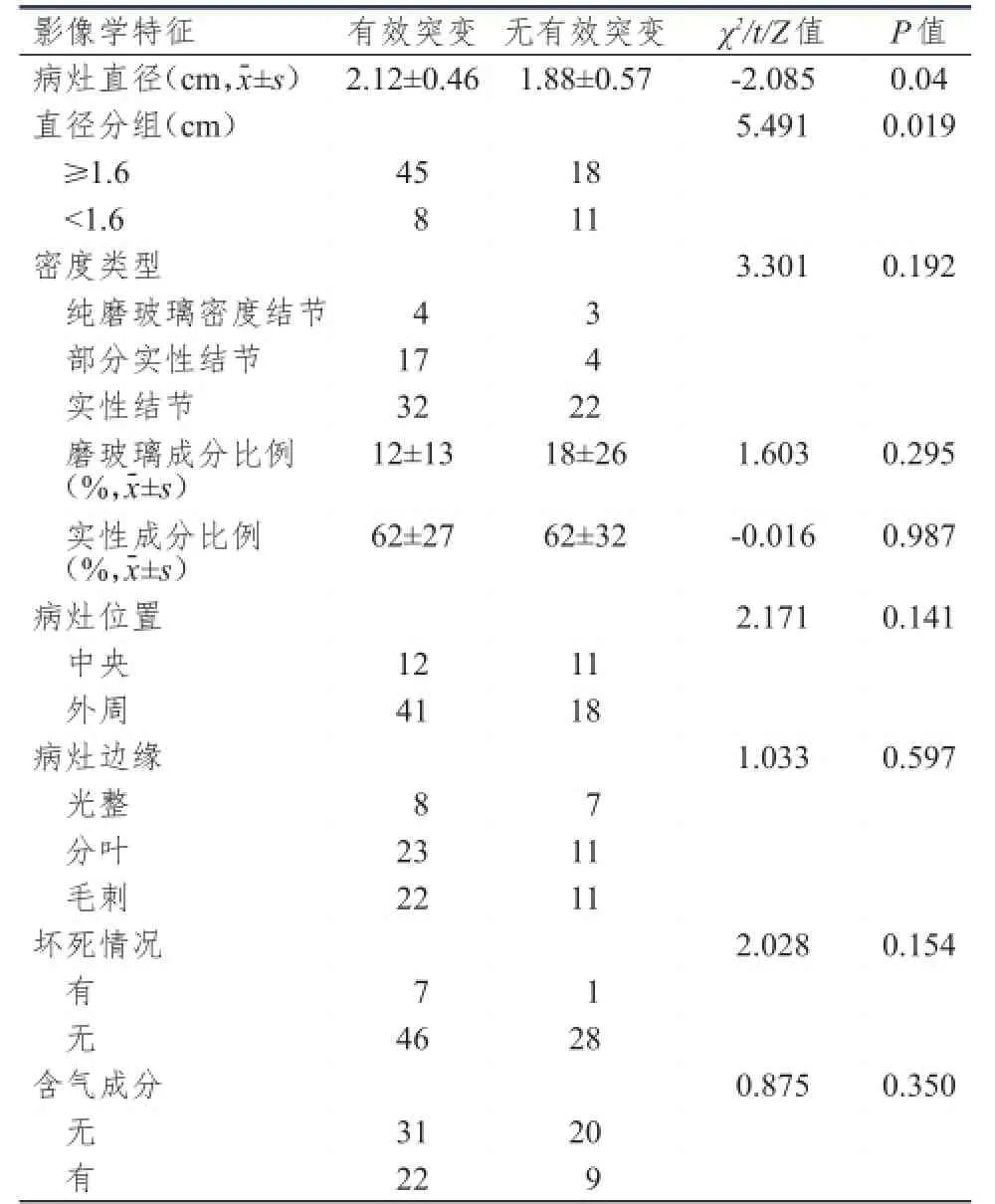
表3 EGFREGFR基因有效突变与影像学特征的关系
2.2 EGFR有效突变相关因素的多因素分析
多因素Logistic回归分析显示年龄≥60岁(OR 6.852;95%CI 1.985~23.652;P=0.002)为EGFR基因有效突变的独立危险因素,其他单因素分析中的有意义因素包括病灶直径大于1.6 cm、女性、不吸烟、乳头为主型浸润腺癌在多因素分析中均无统计学意义(P>0.05)。
3 讨论
研究显示针对EGFR靶点的TKI在EGFR突变型非小细胞肺癌患者中具有较高的敏感性和治疗反应率。EGFR突变检测是筛选应用TKI能够临床获益患者的有效方法[14-15]。最新的肺癌分子学检测指南对于早期肺腺癌在确诊时是否行EGFR状态检测并没有明确的规定,但认为初诊时肺腺癌分期较早但未接受基因检测的患者在疾病复发或进展时应行EGFR状态检测[10]。这可能因为早期肺腺癌预后良好[16],而该指南充分考虑到了检测成本与临床获益的比例。但是研究表明仍有27%的ⅠA期和42%的ⅠB期非小细胞肺癌患者出现疾病复发及因肿瘤原因导致死亡[17]。由于EGFR状态检测对样本量及样本处理的要求[18],这部分患者一旦出现疾病复发或进展而既往未接受基因检测极有可能需要再次进行有创性取材。本研究通过对cT1N0M0期肺腺癌患者EGFR有效突变相关危险因素的分析,试图寻找早期肺腺癌EGFR有效突变的高危人群,从而为早期肺腺癌患者术后行EGFR基因检测提供依据。
与既往研究不同,本研究提出EGFR有效突变的概念(指具有靶向治疗意义的EGFR突变,包括外显子18、19和21突变),使研究结果能更有效地指导高危人群的选择。既往临床研究发现,亚裔、不吸烟、女性肺腺癌患者是EGFR-TKI治疗的优势人群[3,19]。本研究入组患者均为腺癌,总的EGFR有效突变率为64.6%(53/82),高于既往报道的亚裔腺癌患者EGFR突变率(30.8%~42.4%)[20-22],这可能与本组病例直径均≤3 cm(T1)有关,Yano等[23]研究亦发现直径≤3 cm的肿瘤EGFR突变率更高。本研究中EGFR在女性、不吸烟患者中突变率更高,与既往文献报道一致。其他与cT1N0M0期肺腺癌患者EGFR有效突变相关的临床因素还包括患者年龄,经过多因素分析后发现年龄≥60岁是一个独立的危险因素,以往并未见类似的报道,最终结论需要更大样本研究支持。
影像相关因素与EGFR有效突变关系的分析发现,肿瘤直径≥1.6 cm的cT1N0M0期肺腺癌患者EGFR有效突变率更高,但是多因素分析后显示肿瘤直径≥1.6 cm并不是一个独立的危险因素。关于肿瘤直径与EGFR有效突变的相关性研究比较少,Yano等[23]对80例外周型腺癌的研究发现直径≤3 cm的肿瘤EGFR突变率更高,但是他们并未对≤3 cm的腺癌做进一步深入的分析。一项对214例Ⅰ期非小细胞肺癌EGFR蛋白表达状况的研究发现,直径>2.43 cm的肿瘤出现EGFR蛋白过度表达的比例更高[24]。刘红雨等[25]研究发现,在早期腺癌患者中,EGFR 19号外显子和21号外显子的突变与EGFR拷贝数增加具有一致性,即大部分有19号外显子和21号外显子突变的患者EGFR拷贝数增加,而无19号外显子和21号外显子突变的患者EGFR拷贝数不增加。另一项对132例肺腺癌EGFR拷贝数增加情况的研究(其中Ⅰ期肺腺癌占67.4%,89/132)亦发现直径>1.55 cm的肿瘤出现EGFR拷贝数增加的比例更高[26],这也间接的证实了本研究的结论。
本研究中,最主要的肺腺癌亚型为腺泡为主型浸润腺癌(63.4%),但该亚型的EGFR有效突变率与其他亚型的差异无统计学意义;乳头为主型浸润性腺癌EGFR有效突变率最高(100%,7/7),其次为附壁为主型浸润性腺癌(87.5%,7/8)。既往研究[27-29]发现乳头型腺癌、含细支气管肺泡癌(bronchioalveolar carcinoma,BAC)为2004年WHO肺腺癌分类中的亚型,现已弃用,该亚型与2012年新分类中含附壁成分的肺腺癌有很大一部分重叠成分的腺癌EGFR突变率更高,而黏液性BAC则较少发生EGFR突变,与本研究结果一致。目前,基于2011年肺腺癌组织学亚型新分类的研究得到的相对一致性的结果,认为含附壁成分或附壁为主型浸润腺癌的EGFR突变率更高;但也有研究认为乳头为主浸润腺癌,腺泡为主浸润腺癌或微乳头为主型浸润腺癌的EGFR突变率较其他亚型高[30-34]。本研究中乳头为主型浸润腺癌的EGFR有效突变率显著高于其他亚型的肺腺癌,但附壁为主型浸润腺癌与其他亚型肺腺癌的EGFR有效突变率差异无统计学意义。本研究亦对含附壁成分的腺癌与不含附壁成分的腺癌EGFR有效突变率进行了比较,含附壁成分的突变率(73.3%,33/45)高于不含附壁成分者(54.1%,20/37),但也无统计学意义。这可能是因为在本组病例中,腺泡为主型浸润性腺癌占了绝大多数,而其他亚型都相对较少;同时也有可能组织学亚型本身与肺腺癌EGFR有效突变的相关性并不明显有关。因此认为肺腺癌组织学亚型与EGFR有效突变的相关性有待进一步研究。
综上所述,女性、年龄≥60岁、无吸烟、病灶≥1.6 cm及病理亚型为乳头为主型的早期肺腺癌患者的EGFR有效突变率较高,术后可考虑推荐行EGFR基因检测。
[1]Kerr KM.Pulmonary adenocarcinomas:classification and reporting[J].Histopathology,2009,54(1):12-27.
[2]Naoki K,Chen TH,Richards WG,et al.Missense mutations of the BRAF gene in human lung adenocarcinoma[J]. Cancer Res,2002,62(23):7001-7003.
[3]Paez JG,Janne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[4]Soda M,Choi YL,Enomoto M,et al.Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer[J].Nature,2007,448(7153):561-566.
[5]Herbst RS,Lippman SM.Molecular signatures of lung cancer-toward personalized therapy[J].N Engl J Med,2007,356(1):76-78.
[6]Pao W,Miller VA.Epidermal growth factor receptor mutations,small-molecule kinase inhibitors,and non-small-cell lung cancer:current knowledge and future directions[J].J Clin Oncol,2005,23(11):2556-2568.
[7]Stahel RA.Adenocarcinoma,a molecular perspective[J]. Ann Oncol,2007,18(Suppl 9):147-149.
[8]Sholl LM,Yeap BY,Iafrate AJ,et al.Lung adenocarcinoma with EGFR amplification has distinct clinicopathologic and molecular features in never-smokers[J].Cancer Res,2009,69(21):8341-8348.
[9]Reck M,van Zandwijk N,Gridelli C,et al.Erlotinib in advanced non-small cell lung cancer:efficacy and safety findings of the global phase IV Tarceva Lung Cancer Survival Treatment study[J].J Thorac Oncol,2010,5(10):1616-1622.
[10]Lindeman NI,Cagle PT,Beasley MB,et al.Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors:guideline from the College of American Pathologists,International Association for the Study of Lung Cancer,and Association for Molecular Pathology[J].J Mol Diagn,2013,15(4):415-453.
[11]Onn A,Choe DH,Herbst RS,et al.Tumor cavitation in stage I non-small cell lung cancer:epidermal growth factor receptor expression and prediction of poor outcome[J]. Radiology,2005,237(1):342-347.
[12]Hansell DM,Bankier AA,MacMahon H,et al.Fleischner Society:glossary of terms for thoracic imaging[J].Radiology,2008,246(3):697-722.
[13]张丽,李蒙,吴宁,等.临床I期浸润肺腺癌不同组织学亚型的三维CT值定量分析[J].中华放射学杂志,2015,49 (4):268-272.
[14]Chou TY,Chiu CH,Li LH,et al.Mutation in the tyrosine kinasedomainofepidermalgrowthfactorreceptorisapredictive and prognostic factor for gefitinib treatment in patients with non-small cell lung cancer[J].Clin Cancer Res,2005,11(10):3750-3757.
[15]Rosell R,Ichinose Y,Taron M,et al.Mutations in the tyrosine kinase domain of the EGFR gene associated with gefitinib response in non-small-cell lung cancer[J].Lung Cancer,2005,50(1):25-33.
[16]Yoshizawa A,Motoi N,Riely GJ,et al.Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma:prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases [J].Mod Pathol,2011,24(5):653-664.
[17]Goldstraw P,Crowley J,Chansky K,et al.The IASLC Lung Cancer Staging Project:proposals for the revision of the TNM stage groupings in the forthcoming(seventh)edition of the TNM Classification of malignant tumours[J].J Thorac Oncol,2007,2(8):706-714.
[18]PirkerR,HerthFJ,KerrKM,etal.ConsensusforEGFRmutation testing in non-small cell lung cancer:results from a European workshop[J].J Thorac Oncol,2010,5(10):1706-1713.
[19]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004,350(21):2129-2139.
[20]Sugio K,Uramoto H,Ono K,et al.Mutations within the tyrosine kinase domain of EGFR gene specifically occur in lung adenocarcinoma patients with a low exposure of tobacco smoking[J].Br J Cancer,2006,94(6):896-903.
[21]Bae NC,Chae MH,Lee MH,et al.EGFR,ERBB2,and KRAS mutations in Korean non-small cell lung cancer patients[J].Cancer Genet Cytogenet,2007,173(2):107-113.
[22]Lee SY,Kim MJ,Jin G,et al.Somatic mutations in epidermal growth factor receptor signaling pathway genes in non-small cell lung cancers[J].J Thorac Oncol,2010,5 (11):1734-1740.
[23]Yano M,Sasaki H,Kobayashi Y,et al.Epidermal growth factor receptor gene mutation and computed tomographic findings in peripheral pulmonary adenocarcinoma[J].J Thorac Oncol,2006,1(5):413-416.
[24]Lee Y,Lee HJ,Kim YT,et al.Imaging characteristics of stage I non-small cell lung cancer on CT and FDG-PET:relationship with epidermal growth factor receptor protein expression status and survival[J].Korean J Radiol,2013,14(2):375-383.
[25]刘红雨,李颖,陈钢,等.187例非小细胞肺癌中EGFR基因突变和扩增的检测及其临床意义[J].中国肺癌杂志,2009,12(12):1219-1228.
[26]Park EA,Lee HJ,Kim YT,et al.EGFR gene copy number in adenocarcinoma of the lung by FISH analysis:investigation of significantly related factors on CT,FDG-PET,and histopathology[J].Lung Cancer,2009,64(2):179-186.
[27]Motoi N,Szoke J,Riely GJ,et al.Lung adenocarcinoma:modification of the 2004 WHO mixed subtype to include the major histologic subtype suggests correlations between papillary and micropapillary adenocarcinoma subtypes,EGFR mutations and gene expression analysis[J]. Am J Surg Pathol,2008,32(6):810-827.
[28]Finberg KE,Sequist LV,Joshi VA,et al.Mucinous differentiation correlates with absence of EGFR mutation and presence of KRAS mutation in lung adenocarcinomas with bronchioloalveolar features[J].J Mol Diagn,2007,9 (3):320-326.
[29]Haneda H,Sasaki H,Lindeman N,et al.A correlation between EGFR gene mutation status and bronchioloalveolar carcinoma features in Japanese patients with adenocarcinoma[J].Jpn J Clin Oncol,2006,36(2):69-75.
[30]Villa C,Cagle PT,Johnson M,et al.Correlation of EGFR mutation status with predominant histologic subtype of adenocarcinoma according to the new lung adenocarcinoma classification of the International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society[J].Arch Pathol Lab Med,2014,10 (138):1353-1357.
[31]Yoshizawa A,Sumiyoshi S,Sonobe M,et al.Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations:analysis of 440 Japanese patients[J].J Thorac Oncol,2013,8(1):52-61.
[32]Song Z,Zhu H,Guo Z,et al.Correlation of EGFR mutation and predominant histologic subtype according to the new lung adenocarcinoma classification in Chinese patients[J].Med Oncol,2013,30(3):645.
[33]Shim HS,Lee da H,Park EJ,et al.Histopathologic characteristics of lung adenocarcinomas with epidermal growth factor receptor mutations in the International Association for the Study of Lung Cancer/American Thoracic Society/ European Respiratory Society lung adenocarcinoma classification[J].Arch Pathol Lab Med,2011,135(10):1329-1334.
[34]Russell PA,Barnett SA,Walkiewicz M,et al.Correlation of mutation status and survival with predominant histologic subtype according to the new IASLC/ATS/ERS lung adenocarcinoma classification in stage III(N2)patients[J].J Thorac Oncol,2013,8(4):461-468.
The effective mutation of epidermal growth factor receptor in early lung adeno-carcinomas::study of clinical,radiographic,and pathological factors△
ZHANG Li1WU Ning1,2#LI Meng1YING Jian-ming1SUN Wei3LV Lv1LIN Dong-mei3
1Department of Diagnostic Radiology,2PET-CT Center,National Cancer Center/Cancer Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China
3Department of Pathology,Beijing Cancer Hospital,Beijing 100036,China0
ObjectivectiveTo investigate the clinical,pathological and HRCT(high resolution CT)features associated with the effective mutation of epidermal growth factor receptor(EGFR)in early stage(cT1N0M0)lung adenocarcinomas,and to determine the target population of EGFR mutations tests.MethodethodIn 82 cases of surgically resected cT1N0M0lung adenocarcinomas,EGFR mutation was determined by direct DNA sequencing.Distribution of effective and non-effective EGFR mutation in regard of clinical factors,pathological factors and HRCT features were evaluated by Chi-square test,Student t test and Rank-sum test;ROC analysis was applied to calculate the critical values of the related factors in predicting EGFR effective mutation;independent risk factors for effective EGFR mutation were determined by multiple Logistic regression analysis.ResultesultAmong 82 cases of cT1N0M0lung adenocarcinomas,effective EGFR mutation was detected in 53 patients and non-effective EGFR mutation(including EGFR wild type and ineffective mutation)in 29 patients.Significant differences in sex(P=0.017),age(P=0.005),smoking status(P=0.004),predominant papillary invasive adenocarcinoma(P=0.048)and tumor size(P=0.019)between effective and non-effective EGFR mutation were observed.Age≥60 (OR=6.852,95%CI:1.985~23.652,P=0.002)was an independent risk factor of effective EGFR mutation in cT1N0M0lung adenocarcinomas.ConclusionusionIn cT1N0M0lung adenocarcinoma,effective EGFR mutation is associated with female,age≥60,non-smoking,predominant invasive papillary adenocarcinoma and tumor diameter≥1.6 cm.Patients with cT1N0M0lung adenocarcinomas and these risk factors may be encouraged to have postoperative EGFR molecular test.
rdslung adenocarcinoma;epidermal growth factor receptor;mutation;tomography;X-ray computed;pathology
R734. 2
A
10.11877/j.issn.1672-1535.2016.14.05.09
国家高技术研究发展计划(863计划)项目(2014AA020602);国家科技支撑计划项目(2014BAⅠ09B01)
(corresponding author),邮箱:cjr.wuning@vip.163.com
2016-05-07)
