MnOx/SAPO-11催化剂的制备、表征及其低温NH3-SCR活性
2016-09-06刘小青李时卉孙梦婷喻成龙黄碧纯
刘小青 李时卉 孙梦婷 喻成龙 黄碧纯,2,*
(1华南理工大学环境与能源学院,广州510006;2华南理工大学工业聚集区污染控制与生态修复教育部重点实验室,广州510006)
MnOx/SAPO-11催化剂的制备、表征及其低温NH3-SCR活性
刘小青1李时卉1孙梦婷1喻成龙1黄碧纯1,2,*
(1华南理工大学环境与能源学院,广州510006;2华南理工大学工业聚集区污染控制与生态修复教育部重点实验室,广州510006)
分别采用浸渍法、柠檬酸络合法以及沉淀法在SAPO-11分子筛上负载MnOx,制备了一系列MnOx/ SAPO-11催化剂。考察了催化剂的低温NH3选择性催化还原(SCR)(NH3-SCR)NOx的性能。结果表明,沉淀法制备的负载量为20%(w)的MnOx/SAPO-11催化剂表现出最优异的低温NH3-SCR性能及N2选择性。通过X射线衍射(XRD)、扫描电镜(SEM)、能量散射谱(EDS)、原子吸收光谱(AAS)、N2吸附-脱附、X射线光电子能谱(XPS)、H2程序升温还原(H2-TPR)、NH3程序升温脱附(NH3-TPD)以及NO/O2程序升温脱附-质谱(NO/O2-TPD-MS)等多种表征手段对催化剂的结构及表面性质进行分析。表征结果显示,采用不同方法制备催化剂时,其表面MnOx的存在形式和晶相结构不同。沉淀法制备的催化剂表面存在无定型态MnOx以及MnO2晶型,具有较大的介孔及外表面积、更多比例的Mn4+和化学吸附氧,同时表面存在对反应有利的中强酸以及强酸。因此,催化剂在低温SCR反应阶段能够生成重要中间产物NO2,从而表现出最佳低温活性。同时,三种制备方法均能使MnOx相对均匀分散在SAPO-11表面。SAPO-11对催化剂表面MnOx物种的形成具有一定的影响,从而影响催化剂的酸性,拓宽了MnOx的活性温度窗口,提高了催化剂的N2选择性。
选择性催化还原;氮氧化物;SAPO-11分子筛;沉淀法;锰氧化物
O643
1 引言
大部分人为源氮氧化物(NOx)来自固定源的排放,它们会引发光化学烟雾、酸雨以及臭氧空洞等环境问题1。目前,氨选择性催化还原(NH3-SCR)是去除固定源NOx最有效的方法之一1,2,其中商业应用最广泛的是V2O5/TiO2系催化剂。该催化剂体系的活性温度窗口是300-400°C,SCR装置置于除尘与脱硫之前。而未经脱硫与除尘的烟气中含有大量的飞灰、As、SO2等,易使催化剂中毒而失活。因此,为了减少催化剂中毒失活从而延长催化剂的使用寿命,需将SCR装置置于除尘以及脱硫之后,此时烟气温度小于250°C3,4。另一方面,该催化剂中含有重金属V,会产生二次污染,所以,开发环境友好型且具有优异的低温SCR活性(特别是在200°C以下)的催化剂具有十分重要的意义5。
近年来,许多过渡金属氧化物(如V、Cr、Mn、Fe、Co、Ni、Cu)都被应用在低温SCR反应研究中,其中Mn系催化剂(MnOx-CeO2、Cr-MnOx、Mn/TiO2、MnOx/Ce0.5Zr0.5O2、Mn-Ce/ZSM-5)表现出优异的低温催化活性4,6。由于MnOx不仅含有多价态的Mn,还具有多种不同结构和形态,且MnOx中的氧通常有多种存在形式,使MnOx能够在SCR反应中实现很好的氧化还原反应循环5,7-9。然而由于非负载型MnOx存在比表面积小、稳定性易受影响、抗水抗硫性能不佳、用量大、污染环境等问题,通常以MnOx为活性组分,负载在具有特殊孔结构和较大比表面积的载体上,以提高催化剂的实用性。SAPO-11是磷酸硅铝系列分子筛中的一种,具有AEL型拓扑结构和椭圆形的一维10元环孔道结构,平均孔径0.39 nm×0.63 nm,属于微孔型分子筛10,11。近年来,由于SAPO-11分子筛具有适宜的表面酸性以及其规整的孔道结构,作为载体时能够使活性组分较好地分散在其表面,其在催化领域具有广泛的应用12-16。部分学者也研究了SAPO-11分子筛在SCR中的应用,Mathisen等17通过水热离子交换法制备的Cu:SAPO-11催化剂在propene-SCR中表现出优异的活性,Worch等18考察了通过浸渍法制备的CuOx/SAPO-11及CeOx/SAPO-11催化剂在HC-SCR反应中的催化活性。所以,将SAPO-11分子筛应用于NH3-SCR中,作为催化剂的载体,其酸性以及结构特征对低温SCR反应的影响具有广阔的研究前景。
在此前的研究中,绝大部分应用于低温SCR的锰系催化剂都是通过浸渍法、溶胶凝胶法以及沉淀法制备而成19,而对不同的反应体系而言,不同方法制备的催化剂具有不同的反应活性。Jiang19、Ning20、Guo21等采用浸渍法、柠檬酸络合法以及共沉淀法制备催化剂,其中,通过溶胶-凝胶法制备的催化剂具有最优的SCR活性。而Wan等5通过共沉淀法制备的Ni-Mn双金属氧化物催化剂也具有优异的低温SCR活性。不同制备方法会使催化剂呈现不同的形貌,具有不同的物理化学性能以及不同的元素赋存状态,以上差异均会对催化剂的SCR性能产生影响。本文分别采用浸渍法、柠檬酸络合法和沉淀法制备了三种MnOx/SAPO-11催化剂,研究其在低温SCR反应中的性能,以筛选出最佳制备方法。得到具有良好低温SCR活性的MnOx/SAPO-11催化剂,并通过X射线衍射(XRD)、N2吸附-脱附分析、原子吸收光谱(AAS)、扫描电镜(SEM)、X射线光电子能谱(XPS)、H2程序升温还原(H2-TPR)、NH3程序升温脱附(NH3-TPD)以及NO/O2程序升温脱附-质谱(NO/O2-TPDMS)等一系列表征手段探究其具有良好SCR性能的原因。
2 实验部分
2.1催化剂的制备
2.1.1浸渍法(简称i)
采用过量浸渍法制备MnOx/SAPO-11(i)催化剂,即将2 g SAPO-11(南开催化剂厂)粉末加入至完全溶解的乙酸锰(阿拉丁试剂有限公司,分析纯)溶液中,待搅拌均匀并超声40 min后浸渍2 h。将浸渍后的溶液直接置于110°C烘箱中蒸干,将干粉饼研磨后置于马弗炉中焙烧,以2°C∙min-1速率升至400°C,保持5 h。
2.1.2柠檬酸络合法(简称c)
本实验参照毛东森等22的研究,采用改进的柠檬酸络合法进行制备,即使用乙醇(天津市富宇精细化工有限公司,分析纯)作为溶剂,代替传统柠檬酸络合法中的去离子水。称取2 g SAPO-11粉末加入一定浓度的乙酸锰溶液中,待搅拌均匀后超声分散40 min。边搅拌边滴加柠檬酸(阿拉丁试剂有限公司,ACS)的乙醇溶液,其中n[C6H8O7]: n[Mn(CH3COO)2]=1.2:1。将搅拌均匀的混合物移至水浴锅中,80°C下加热搅拌直至呈现溶胶状,此时继续搅拌直至溶胶蒸干转变成干凝胶。将干凝胶置于110°C下干燥,然后在400°C马弗炉中焙烧5 h,得到一系列MnOx/SAPO-11(c)催化剂。
2.1.3沉淀法(简称p)
采用沉淀法制备MnOx/SAPO-11(p)催化剂,称取一定量的乙酸锰溶解于30 mL去离子水中,再加入2 g SAPO-11粉末,搅拌15 min后超声分散50 min。然后边搅拌边缓慢滴加碳酸铵(上海泰坦科技有限公司,分析纯)溶液,其中n[(NH4)2CO3]: n[Mn(CH3COO)2]=1:1。搅拌1 h之后用真空泵进行抽滤,洗涤至中性,将过滤后得到的粉饼置于110°C鼓风干燥箱中干燥,然后在马弗炉中焙烧,以2°C∙min-1速率升温至400°C后保持5 h。同时,以相同方法制备不含SAPO-11的纯MnOx催化剂。用三种不同方法制备的催化剂记作x%(w)MnOx/ SAPO-11(y),其中,x表示Mn的理论负载量,y表示不同制备方法的英文缩写,如5%(w)MnOx/SAPO-11(p)。将所得催化剂粉末压片、研磨,然后过40-60目筛,待用。
2.2催化剂的活性测试
催化剂的SCR活性测试在内径为12 mm的石英玻璃连续流动固定床反应器中进行,催化剂的用量为500 mg,填充高度为6 mm,反应空速为45000 h-1。实验室模拟反应烟气组成(体积分数φ)为:φ(NO)0.06%,φ(NH3)0.06%,φ(O2)5%,平衡气为Ar气。反应前后气体中NO、NO2经过42i-HL型化学发光NO-NO2-NOx分析仪(美国Thermo公司)在线分析,反应产物N2使用气相色谱仪检测(5A分子筛填充柱,GC9560,上海华爱色谱),活性评价的温度范围为60-300°C。NO转化率(η)及N2选择性(S)分别按以下公式计算:

2.3催化剂的表征
XRD采用德国Bruker公司D8 Advance X射线衍射仪(Cu Kα射线,λ=0.15406 nm)测定,操作电压为40 kV,操作电流为40 mA,扫描范围(2θ)为5°-90°。
N2吸附-脱附测试采用美国Micromeritics公司的ASAP 2460 M全自动比表面积及微孔孔隙分析仪测定催化剂的比表面积和孔结构参数。测试时取0.2 g样品,在100°C下脱气1 h,然后在350°C下脱气4h,脱气完毕后,以N2为吸附质,于-196°C下进行测定。用BET方法计算样品的比表面积,tplot法计算微孔孔容。
SEM和EDS在德国ZEISS Merlin高分辨率热场发射扫描电镜上进行,以观察催化剂的微观结构。主要参数为:分辨率0.6 nm,放大倍率为12×-2000000×,加速电压为0.05-30 kV。
Mn元素含量分析在美国PerkinElmer公司的PinAAcle 900T型原子吸收光谱上测试。
XPS测试仪器为Thermofisher Scientific公司的Escalab250Xi型X射线光电子能谱仪,测试条件为:真空度3.33×10-6Pa,Al Kα射线(hν=1253.6 eV),C 1s校准结合能为284.8 eV。
H2-TPR测试在美国Micromeritics AutoChem II 2920全自动化学吸附仪上进行。取50 mg样品用Ar在400°C下吹扫60 min,然后冷却至100°C,再通入30 mL∙min-1的10%H2/Ar,以10°C∙min-1的升温速率至750°C进行程序升温还原。
NH3-TPD分析在天津先权TL5090多用吸附仪上进行表征,载气为He,流量为50 mL∙min-1,取100 mg样品,先用He气在400°C下吹扫60 min,自然降温至60°C,然后切换至5%NH3/He吸附60 min。再用载气吹扫60 min,调平衡后,从60°C升至700°C进行脱附。

图1 MnOx/SAPO-11催化剂的SCR活性测试结果Fig.1 Results of SCR activity over MnOx/SAPO-11 catalysts(a)The variation of the catalytic activity with different Mn loadings at 140°C.reaction conditions:0.06%(volume fractio,φ)NO,0.06%(φ) NH3,3%(φ)O2,Ar balance,gas hourly space velocity(GHSV)=45000 h-1;catalyst:500 mg;(b)the NO conversion(η)of 20%(w)MnOx/ SAPO-11 catalysts prepared by different methods at 60-300°C;(c) The N2selectivity(S)of catalysts prepared by different method.x%(w) MnOx/SAPO-11(y),x:Mn loading;w:mass fraction;y:preparation method including i(impregnation method),c(citric acid method),and p(precipitation method)
O2-TPD测试在美国Micromeritics AutoChem II 2920全自动化学吸附仪上进行。取100 mg样品用He在400°C下吹扫60 min,然后冷却至100°C,再通入30 mL∙min-110%O2/He吸附60 min,再用载气吹扫30 min,以10°C∙min-1的升温速率至700°C进行程序升温脱附。NO/O2-TPD测试与上述实验条件一致,在通入O2/He吸附之前先通入10%NO/He吸附60 min,全过程的尾气连接英国Hiden公司的HPR-20 QIC R&D在线气体分析仪分析尾气中的NO以及NO2。
3 结果与讨论
3.1MnOx/SAPO-11催化剂的SCR活性评价结果
通过三种不同方法制备的MnOx/SAPO-11催化剂的活性评价结果如图1(a)所示,图中表示各不同负载量(5%-25%(w))的催化剂在140°C时的NO转化率。NO转化率均随着Mn负载量的增加而升高,沉淀法以及柠檬酸络合法制备的催化剂均在负载量为20%(w)时,NO转化率达到最大;而浸渍法制备的催化剂则在负载量为15%(w)时NO转化率达到最佳。三种负载方法均采用Mn负载量为20%(w)时进行对比(下文中样品名省略20%(w)),从图1(b)中可以看出,MnOx/SAPO-11(p)具有明显的低温NH3-SCR活性。该催化剂可在120-280°C范围内保持90%以上的NO转化率,且在160-220°C内转化率接近100%。MnOx/SAPO-11(c)也表现出了良好的低温NH3-SCR活性,在160-300°C的转化率达90%。MnOx/SAPO-11(i)的低温SCR活性较差,在300°C时NO转化率达到90%。同样通过沉淀法制备的纯MnOx(p)具有优异的低温SCR性能,但其活性温窗较窄,在140°C达到最佳活性后呈现下降趋势,且其NO转化率略低于MnOx/SAPO-11(p)。负载型MnOx/SAPO-11(p)相较于纯MnOx(p)而言,在NO转化率相近的基础上,其经济性与环保性更佳。
图1(c)是三种方法制备的催化剂在SCR反应中对N2的选择性结果,该结果是评价催化剂环保性的重要指标。纯MnOx选择性随着反应温度的升高呈现急剧下降趋势,而MnOx/SAPO-11(p)的N2选择性能够保持在80%以上,且在160-220°C之间接近100%。MnOx/SAPO-11(c)的N2选择性低于MnOx/ SAPO-11(p),高于MnOx/SAPO-11(c),基本保持在60%以上。SAPO-11作为载体,与MnOx之间的相互作用使得催化剂的N2选择性明显提高。同时,三种方法中沉淀法展示出最优的N2选择性。
3.2X射线衍射分析
图2是通过不同方法制备的MnOx/SAPO-11催化剂的XRD图,负载后经过焙烧,SAPO-11分子筛的结构并没有被破坏。其中,8.1°、9.8°、12.8°、16.1°、20.0°、21.9°、22.3°、23.5°、24.3°、25.8°、27.7°、29.7°、32.7°归属于具有AEL拓扑结构(PDF#47-0614)的SAPO-11分子筛的衍射峰。图中18.1°、28.9°、32.5°、36.2°、44.6°、51.0°、56.0°、60.0°、64.7°的衍射峰归属于Mn3O4(PDF#02-1062),58.4°的衍射峰归属于Mn3O4(PDF #16-0154)。浸渍法和柠檬酸络合法制备的催化剂中MnOx晶型均以Mn3O4为主。MnOx/SAPO-11(c)上Mn3O4晶型的衍射峰较MnOx/SAPO-11(i)上衍射峰少,且峰趋于弱化宽化,说明柠檬酸络合法负载的MnOx更分散,存在无定型态锰氧化物。沉淀法制备的MnOx/SAPO-11(p)催化剂在25.9°、37.4°和56.0°出现了衍射峰,归属于MnO2(PDF#02-0567、PDF#04-0591)。通过沉淀法制备的纯MnOx在28.8°以及37.1°的衍射峰归属于MnO2(PDF#44-0141、PDF#14-0644),在23.2°、33.0°、55.3°以及65.7°的衍射峰归属于Mn2O3(PDF#02-0902),主要以MnO2和Mn2O3的晶型为主。对比这两种催化剂的XRD图,负载型催化剂上MnOx晶型种类更少,且MnO2晶型的衍射峰更弱,说明MnOx/SAPO-11 (p)上MnOx更分散,存在更多无定型态MnOx,即SAPO-11能够使MnOx很好地分散在其表面,对SCR反应有利。对比(b)-(d),MnOx/SAPO-11(p)以MnO2晶型和高度分散的无定型态MnOx为主,MnOx/SAPO-11(c)以Mn3O4晶型和无定型态MnOx为主,而MnOx/SAPO-11(i)则以Mn3O4晶型为主。SCR的反应各种形态MnOx的低温NH3-SCR活性顺序23:MnO2>Mn2O3>Mn3O4,且无定型态MnOx更加有利于该反应的进行,与前文中NH3-SCR活性测试结果一致。
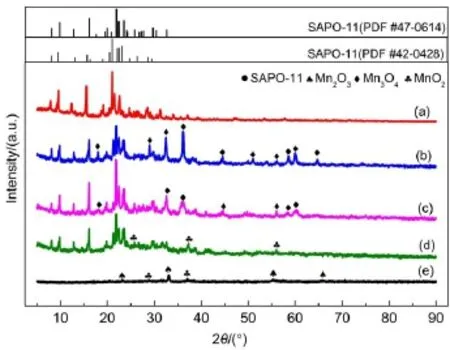
图2 各催化剂的XRD谱图Fig.2 XRD patterns of all catalysts(a)SAPO-11;(b)MnOx/SAPO-11(i);(c)MnOx/SAPO-11(c); (d)MnOx/SAPO-11(p);(e)MnOx(p)
3.3扫描电镜、能量散射谱及原子吸收光谱分析
各催化剂的SEM图如图3所示,(a)为南开催化剂厂提供的SAPO-11分子筛原粉的形貌图,从图中可以看出,该SAPO-11是长方体结构,含有少量片状结构,表面较光滑,尺寸在200 nm-1 μm之间,与文献24-26报道一致。通过三种不同负载方法制备的MnOx/SAPO-11催化剂,表面均包覆了较均匀的颗粒物,且在扫描电镜可观测范围内并无明显区别。说明SAPO-11对MnOx的负载分散度较好,与文献中金属氧化物在其表面能够高度分散结果一致14-16,27。通过AAS测试分析催化剂体相中实际Mn含量,并通过EDS能谱分析催化剂表面Mn实际负载量,结果如表1所示。AAS分析结果表明通过三种方法制备的催化剂Mn实际含量均在15% (w)左右,且EDS结果表明其表面Mn含量也基本一致,在10%(w)左右。两结果均与SEM结果一致,表明三种方法均能使MnOx较好地分散在SAPO-11表面。
通过对比图3(d-1)与(e-1),样品均通过沉淀法制备而成,纯MnOx颗粒在1 μm左右,负载在SAPO-11表面的MnOx颗粒较小,在40 nm左右。此结果进一步说明,SAPO-11能够使MnOx在其表面均匀分散,且结合XRD结果可知沉淀法负载后MnOx晶相发生改变,高度分散且存在较多无定型态MnOx,有利于SCR的反应。
3.4N2吸附-脱附分析

图3 不同方法制备的MnOx/SAPO-11催化剂的SEM图和EDS谱图Fig.3 SEM images and EDS spectra of catalysts with different methods(a)SAPO-11(30000×);(b)MnOx(p)(8000×);(c)MnOx/SAPO-11(i)(40000×);(d)MnOx/SAPO-11(c)(40000×);(e)MnOx/SAPO-11(p)(40000×)
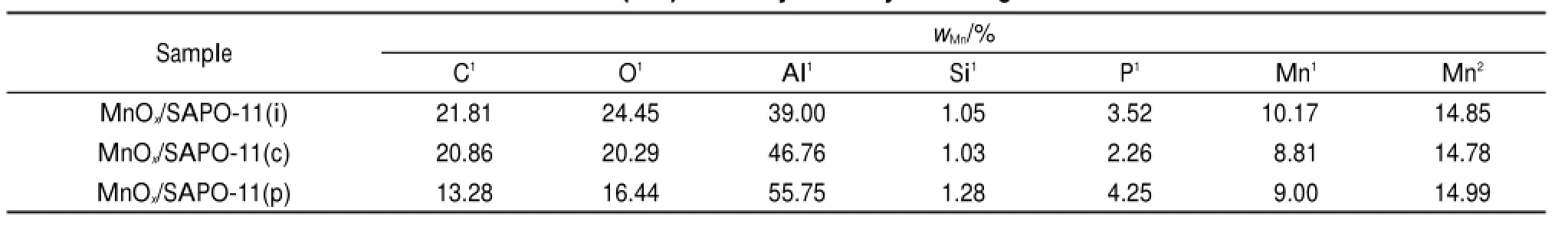
表1 用EDS及AAS方法分析催化剂中Mn含量(wMn)Table 1 Mn content(wMn)in catalysts analyzed using EDS andAAS

表2 不同催化剂的BET比表面积、孔容、孔径Table 2 BET surface areas,pore volumes,and pore diameters of different catalysts
表2所示为纯SAPO-11、纯MnOx以及通过浸渍法、柠檬酸络合法以及沉淀法负载的MnOx/ SAPO-11催化剂的比表面积、孔容、孔径。从表中可看出,柠檬酸络合法以及沉淀法制备的催化剂比表面积均大于浸渍法制备的催化剂,且外表面积越大、活性越好。通过对比三种催化剂的总孔容和微孔孔容可以发现,总孔容及介孔孔容越大,催化剂的NH3-SCR低温活性越好。根据SEM结果可知,三种方法制备的催化剂表面颗粒物大小均匀情况无明显差异,因此三种催化剂的平均孔径基本一致。由于SAPO-11表面负载的MnOx为介孔材料,孔径较大(纯MnOx平均孔径为7.8nm),使负载后催化剂的平均孔径大于纯SAPO-11分子筛的平均孔径。可以推测:介孔孔容越大,介孔表面及外表面的面积越大,使得MnOx活性位点暴露越多,越有利于NH3-SCR反应的进行,即反应主要发生在催化剂的介孔表面及外表面。纯MnOx(p)以介孔为主,其外表面面积略小于MnOx/ SAPO-11(p),总孔容(0.09893 cm3∙g-1)也略小于MnOx/SAPO-11(p)的介孔孔容(0.10537 cm3∙g-1),平均孔径远大于MnOx/SAPO-11(p)。纯MnOx(p)在含量上占优势,暴露出较多活性位点,低温阶段有利于吸附反应的进行,活性明显优于MnOx/SAPO-11(p)。120°C之后,MnOx表面弱吸附态物质减少,催化作用占主要地位,活性却略低于MnOx/ SAPO-11(p),这与上述因果关系的分析以及XRD 中MnOx晶型分析结果一致。
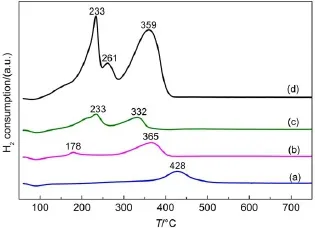
图4 不同催化剂的H2-TPR图Fig.4 H2-TPR profiles for catalysts(a)MnOx/SAPO-11(i);(b)MnOx/SAPO-11(c); (c)MnOx/SAPO-11(p);(d)MnOx(p)
3.5程序升温还原分析
催化剂在SCR反应中以完成氧化还原循环的形式参与5,因此其氧化还原能力尤为重要。图4是催化剂的H2-TPR结果,各还原峰的位置及峰的强度对应的是活性位点的氧化还原性能及活性位点数量9。图中(a)代表MnOx/SAPO-11(i),只出现一个428°C的还原峰,可归属于晶态Mn3O4向MnO的还原,还原能力较弱。(b)代表MnOx/ SAPO-11(c),在178和365°C均出现了还原峰,可分别归属于少量非晶态MnO2向Mn3O4的还原以及Mn3O4向MnO的还原28。相比于浸渍法制备的催化剂,柠檬酸络合法制备的催化剂表面的Mn3O4更加分散,晶型弱,非晶态多,原能力增强,还原峰明显向低温方向偏移。(c)代表MnOx/SAPO-11(p),表面主要以MnO2的晶态和非晶态MnOx为主,因此在233°C出现一个较大的MnO2向Mn3O4转化的还原峰,且在332°C也出现了Mn3O4向MnO转化的还原峰。相较于MnOx/SAPO-11(c),其低温还原峰明显增强(耗氢量由0.26到1.08 mmol∙g-1),活性位点数量增多,高温还原峰向低温方向偏移,还原能力增强,均有利于SCR反应。三种催化剂的氧化还原能力均能与XRD结果较好匹配,同时与催化剂的SCR活性顺序一致。(d)是纯MnOx(p)对比样品的H2-TPR曲线,在233°、261°及359°存在三个还原峰,可分别归属于MnO2至Mn3O4、Mn2O3至Mn3O4以及Mn3O4至MnO的还原峰28。其较大耗氢量与其Mn含量相关,其还原峰的位置相比于MnOx/SAPO-11(p),向高温略有偏移,氧化还原能力稍弱,这可能是其活性在130°C之后略低于MnOx/SAPO-11(p)的原因。
3.6X射线光电子能谱分析
为分析三种由不同制备方法制备成的催化剂中Mn的价态组成以及表面氧种类的情况,进行了Mn 2p3/2和O 1s XPS的分析,结果如图5和表3所示。催化剂的Mn 2p3/2XPS谱图拟合结果见图5 (A),将图中位于640.2-640.8 eV、641.8-642.0 eV、643.2-644.5 eV的峰分别归属于Mn2+、Mn3+和Mn4+1,28,29。目前,许多研究表明(Mn3++Mn4+)/ (Mn2++Mn3++Mn4+)的比值越大,锰氧化物能够更好地实现氧化还原反应的循环,且其中Mn4+是公认对SCR反应最为活跃的物种9。三种催化剂均以Mn3+和Mn4+为主,其中Mn4+的比例越大,催化剂的活性越好。三种不同方法制备的催化剂中Mn4+的比例也是造成其活性差异的主要原因。催化剂的O 1s XPS谱图拟合结果见图5(B),将529.2-530.0 eV以及531.3-532.2 eV处的峰分别归属于Oβ晶格氧(O2-)和Oα表面吸附氧(包括、―OH)1,9。三种催化剂中氧多以表面吸附氧形式存在,晶格氧含量较少,化学吸附氧为主要活性物种,晶格氧并不是影响催化剂SCR活性的关键。由于XPS是在距离催化剂表面5-10 nm处进行打点测试,表面原子组成属于半定量,不能完全反映催化剂中真实比例,只能反映化学氛围。从表面Mn原子含量可以看出,MnOx/SAPO-11(c)在此深度处MnOx含量较多,因而造成表面氧中晶格氧的比例较大。对比MnOx/SAPO-11(i)与MnOx/SAPO-11(p)样品中氧的组成可知,化学吸附氧含量的增加有利于SCR反应的进行。由XPS分析可推出:Mn4+的比例较大以及化学吸附氧占优是柠檬酸络合法优于浸渍法、沉淀法优于柠檬酸络合法的原因之一。
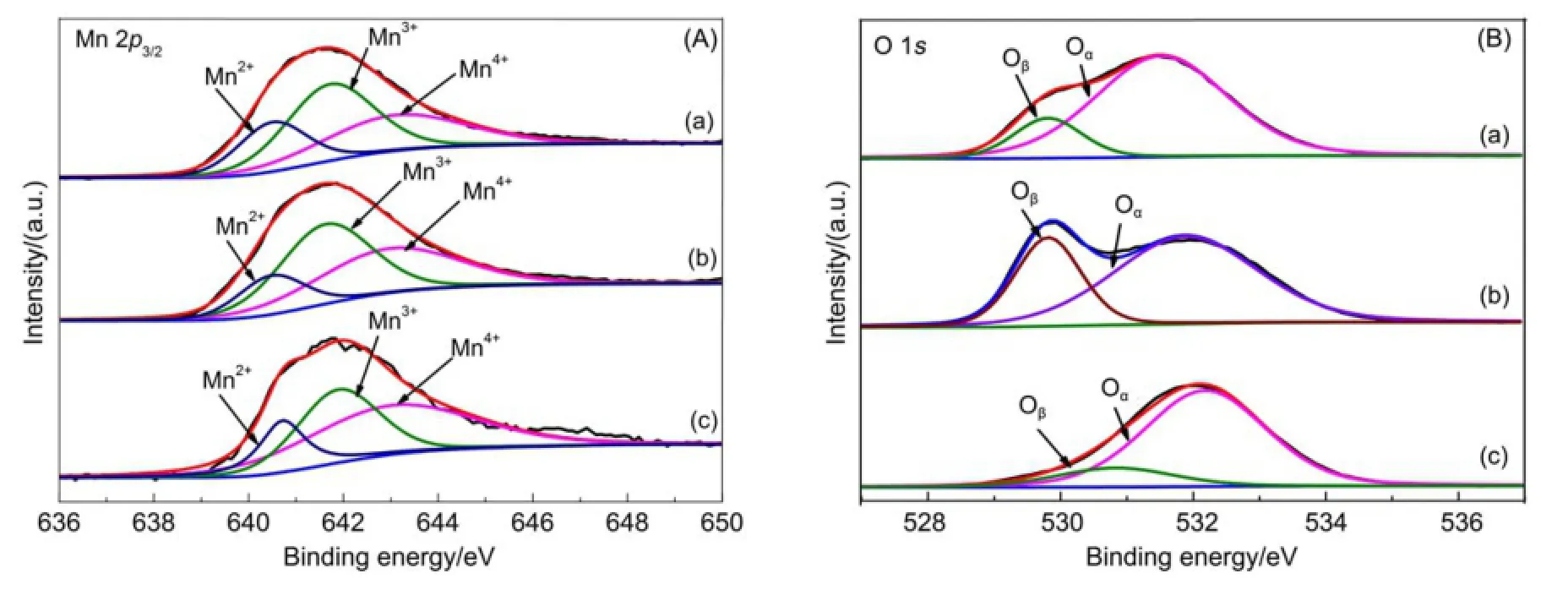
图5 MnOx/SAPO-11催化剂的Mn 2p3/2和O 1s XPS谱图Fig.5 Mn 2p3/2and O 1s XPS spectra of MnOx/SAPO-11 catalysts(A)Mn 2p3/2;(B)O 1s.(a)MnOx/SAPO-11(i);(b)MnOx/SAPO-11(c);(c)MnOx/SAPO-11(p)

表3 不同方法制备的MnOx/SAPO-11催化剂表面原子分数Table 3 Surface atomic concentration of catalysts MnOx/SAPO-11 with different methods
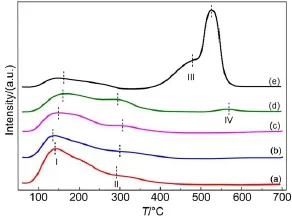
图6 各催化剂的NH3-TPD谱图Fig.6 NH3-TPD profiles of catalysts(a)SAPO-11;(b)MnOx/SAPO-11(i);(c)MnOx/SAPO-11(c); (d)MnOx/SAPO-11(p);(e)MnOx(p)
3.7NH3的程序升温脱附分析
在SCR反应中,NH3在催化剂上的吸附是第一步。存在两种反应机制,一是NH3吸附在催化剂的B酸位,形成NH4+,再参与后续反应;二是NH3吸附在催化剂的L酸位,形成配位态的NH3,再参与后续反应1,28。这两种反应一般是同时存在的,所以催化剂的NH3脱附位置及脱附量所表征的催化剂的酸性强度和酸量对SCR反应尤为重要。图6是各催化剂的NH3-TPD曲线,图中在I (140-170°C)、II(300°C左右)、III(475°C)及IV (500-600°C)四个位置出现了NH3脱附峰。可将I处的峰归属于弱酸脱附峰,将II处的峰归属于中强酸脱附峰,将III及IV处的峰归属于强酸脱附峰5,15,30。I和II位置的酸可归属于SAPO-11表面存在的结构弱酸以及中强酸。具有AEL拓扑结构的纯SAPO-11暴露出较多弱酸酸位,低温阶段可吸附大量NH3,有利于后续反应的进行。锰氧化物可产生相应I、II、III和IV位置的弱酸、中强酸以及强酸,文献5,31中也有相关报道。锰氧化物产生的弱酸及中强酸会对SAPO-11表面由于被包覆而引起的结构酸量减少进行补充,负载后三种催化剂表面中强酸的酸量均增加,且增加趋势与催化剂的活性规律一致(MnOx/SAPO-11(p)>MnOx/SAPO-11 (c)>MnOx/SAPO-11(i))(见表4)。纯MnOx(p)主要以强酸为主,强酸位点是其主要活性位点。MnOx/ SAPO-11(p)催化剂表面也出现了强酸位的NH3脱附峰,增加的强酸位点使其SCR性能更优。因此,SAPO-11的分散作用使MnOx在其表面产生了较多对SCR反应至关重要的中强酸酸位,沉淀法制备出的MnOx表面存在对反应有利的强酸酸位。SAPO-11的结构弱酸位与锰氧化物的中强酸位及强酸位相结合,使得MnOx/SAPO-11(p)表现出最优的低温NH3-SCR性能。
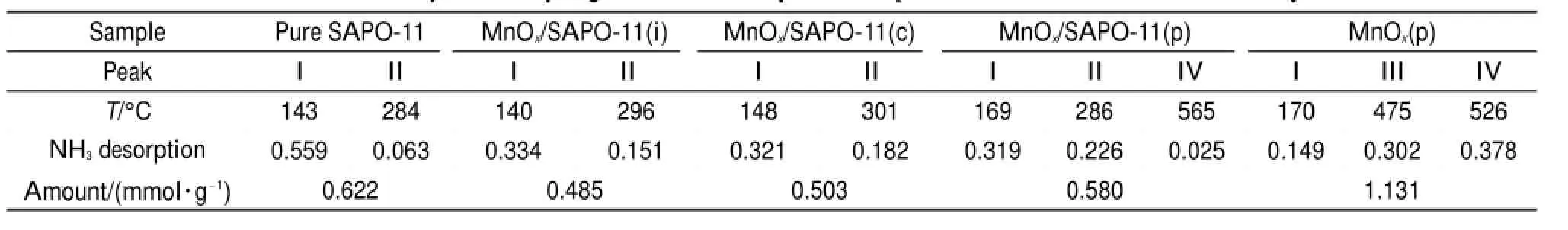
表4 各催化剂的NH3程序升温脱附温度和脱附量Table 4 NH3temperature-programmed desorption temperature and amount of all catalysts
3.8NO/O2的程序升温脱附-质谱分析
图7是各催化剂的O2-TPD曲线,可对应催化剂表面锰物种。500°C左右的O2脱附峰可归属于MnO2转化为Mn2O3的晶格氧峰,700°C左右的峰可归属于Mn2O3转化为Mn3O4的晶格氧峰32,33。从图中可知,MnOx/SAPO-11(i)与MnOx/SAPO-11(c)催化剂表面不存在MnO2与Mn2O3晶型,MnOx/SAPO-11(p)催化剂表面存在MnO2晶型无Mn2O3晶型,而MnOx(p)表面两种晶型均存在。此结果与XRD衍射峰结果一致。在SCR反应温度(300°C)内,并未出现晶格氧的脱附峰,说明晶格氧并不是低温阶段锰氧化物实现氧化还原循环的关键因素,与O 1s XPS分析结果一致。

图7 各催化剂的O2-TPD曲线Fig.7 O2-TPD profiles of all catalysts(a)SAPO-11;(b)MnOx/SAPO-11(i);(c)MnOx/SAPO-11(c); (d)MnOx/SAPO-11(p);(e)MnOx(p)
在SCR反应中,当反应温度低于200°C时,部分锰基催化剂表面同时存在两种反应机理:一是Eley-Rideal(E-R)反应机理,主要活性物种为弱吸附态的N2O4、NO2以及气态NO2;二是Langmuir-Hinshelwood(L-H)反应机理,主要活性物种为N2O4以及NO的各种吸附态物质23,29。因此,NO2是低温SCR反应的重要中间产物。为了探究NO2是否为影响浸渍法、柠檬酸络合法以及沉淀法制备的催化剂表现出不同的NH3-SCR性能的关键中间产物,将催化剂在100°C时先后进行NO和O2吸附饱和后再升温脱附,尾气连接MS检测脱附出的NO以及NO2,得到脱附谱图如图8所示。纯SAPO-11自身可吸附极少量NO,且吸附能力较强,在O2作用下产生少量中强吸附态的NO2。图8 中(b)、(c)、(d)分别表示浸渍法、柠檬酸络合法以及沉淀法制备的催化剂的脱附曲线,MnOx的负载覆盖了SAPO-11表面吸附位点,形成了新的吸附位点。NO与NO2的脱附情况与其SCR活性顺序完全对应。MnOx/SAPO-11(i)的谱图中并未出现NO2脱附峰,MnOx/SAPO-11(c)在低温区域(170°C左右)出现了一个微弱的NO2脱附峰,而MnOx/SAPO-11(p)则在低温(160°C左右)和高温(500°C左右)均出现了NO2的脱附峰,且与(e)中纯MnOx(p)的NO2脱附位置一致。说明MnOx/SAPO-11(p)表面的吸附态NO2比MnOx/SAPO-11(c)生成的吸附态NO2的吸附能力强,且吸附量更大。同时,NH3-TPD分析得催化剂表面中强酸位及强酸位吸附的NH3为主要活性物种,且MnOx/SAPO-11(p)表面存在较多中强酸与强酸,则与该酸位结合的NH3更多,更加有利于SCR反应。在低温阶段(200°C以下),MnOx/ SAPO-11(c)表面NO2以气态及吸附态形式存在,MnOx/SAPO-11(p)表面NO2以气态及较强吸附态形式存在。与吸附态NH3发生反应,说明同时存在ER与L-H机制,气态与吸附态NO2均为主要活性物种。因此沉淀法制备的催化剂低温SCR活性最优,柠檬酸络合法次之。浸渍法制备的催化剂在低温阶段基本未生成吸附态NO2,且表面中强酸及强酸量少,则其低温未显现SCR活性。因此,三种催化剂在低温阶段,E-R及L-H反应机制共存,NO2是影响低温SCR活性的重要中间产物。
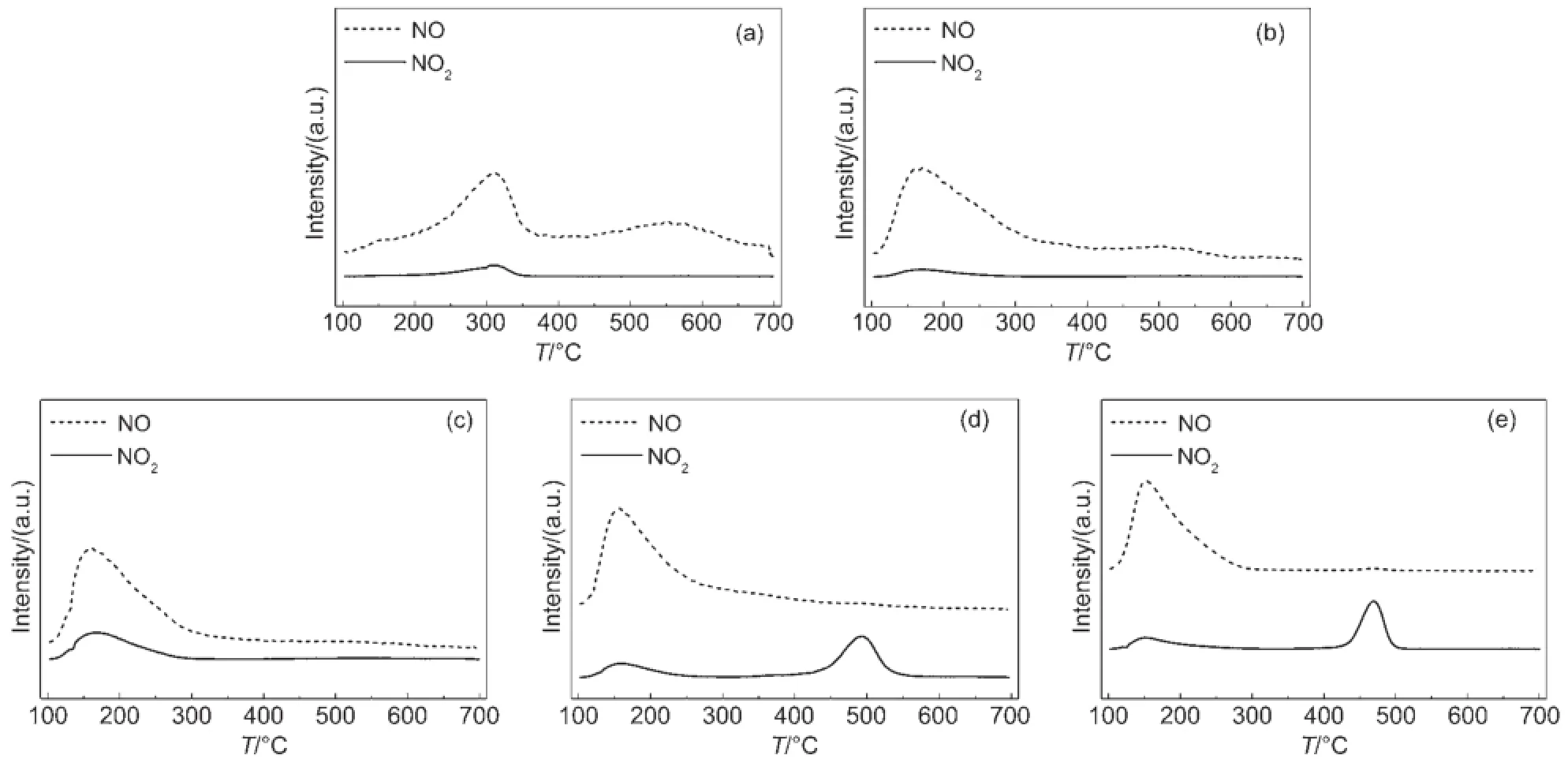
图8 各催化剂的NO/O2-TPD-MS谱图Fig.8 NO/O2-TPD-MS profiles of all catalysts(a)SAPO-11(1×);(b)MnOx/SAPO-11(i)(1×);(c)MnOx/SAPO-11(c)(1/2.3×);(d)MnOx/SAPO-11(p)(1/4.3×);(e)MnOx(p)(1/12×)
4 结论
通过浸渍法、柠檬酸络合法和沉淀法制备了三种不同的MnOx/SAPO-11催化剂,其中,沉淀法表现出最优的低温NH3-SCR活性和N2选择性。20%(w)MnOx/SAPO-11(p)在120-280°C保持90%以上的NO转化率,且在180-200°C的NO转化率达100%。柠檬酸络合法仅次于沉淀法,也可制备出具有较好低温SCR活性的催化剂。以SAPO-11为载体,能够使MnOx高度分散在其表面,存在对SCR有利的无定型态MnOx。沉淀法制备的催化剂以MnO2晶型为主,Mn4+含量与化学吸附氧含量最高。SAPO-11具有较大的比表面积和弱酸量,通过沉淀法使MnOx在其表面形成了更多有利于反应进行的介孔及外表面,形成了较多的中强酸与强酸,能够提供更多的反应位点。通过NO/O2-TPDMS分析结果,确定了晶格氧并不是影响活性的关键因素,同时证明NO2是影响催化剂低温SCR活性的重要中间产物。所以,沉淀法是最适于此体系的制备方法,将MnOx与SAPO-11载体优势相结合。基于以上原因,展示出最优异的低温NH3-SCR性能和N2选择性。
References
(1)Yang,C.;Liu,X.Q.;Huang,B.C.;Wu,Y.M.Acta Phys.-Chim.Sin.2014,30,1895.[杨超,刘小青,黄碧纯,吴友明.物理化学学报,2014,30,1895.]doi:10.3866/PKU. WHXB201407162
(2)Yao,X.J.;Gong,Y.T.;Li,H.L.;Yang,F.M.Acta Phys.-Chim.Sin.2015,31,817.[姚小江,贡营涛,李红丽,杨复沫,物理化学学报,2015,31,817.]doi:10.3866/PKU. WHXB201503253
(3)Chen,J.H.;Cao,F.F.;Qu,R.Y.;Gao,X.;Cen,K.F. J.Colloid Interface Sci.2015,456,66.doi:10.1016/j. jcis.2015.06.001
(4)Lian,Z.H.;Liu,F.D.;He,H.;Shi,X.Y.;Mo,J.S.;Wu,Z.B. Chem.Eng.J.2014,250,390.doi:10.1016/j.cej.2014.03.065
(5)Wan,Y.P.;Zhao,W.R.;Tang,Y.;Li,L.;Wang,H.J.;Cui,Y. L.;Gu,J.L.;Li,Y.S.;Shi,J.L.Appl.Catal.B-Environ.2014, 148,114.doi:10.1016/j.apcatb.2013:10.049
(6)Andreoli,S.;Deorsola,F.A.;Galletti,C.;Pirone,R.Chem. Eng.J.2015,278,174.doi:10.1016/j.cej.2014.11.023
(7)Dai,Y.;Li,J.H.;Peng,Y.;Tang,X.F.Acta Phys.-Chim.Sin. 2012,28,1771.[戴韵,李俊华,彭悦,唐幸福,物理化学学报,2012,28,1771.]doi:10.3866/PKU.WHXB201205113
(8)Huang,P.;Pan,S.W.;Huang,B.C.;Cheng,H.;Ye,D.Q.;Wu, J.L.;Fu,M.L.;Lu,S.L.Acta Phys.-Chim.Sin.2013,29, 176.[黄萍,盘思伟,黄碧纯,程华,叶代启,吴军良,付名利,卢圣良.物理化学学报,2013,29,176.]doi:10.3866/PKU. WHXB201210094
(9)Jiao,J.Z.;Li,S.H.;Huang,B.C.Acta Phys.-Chim.Sin.2015, 31,1383.[焦金珍,李时卉,黄碧纯.物理化学学报,2015,31, 1383.]doi:10.3866/PKU.WHXB201504292
(10)Venkatathri,N.;Srivastava,R.Stud.Surf.Sci.Catal.2004, 154,978.doi:10.1016/S0167-2991(04)80913-3
(11)Meriaudeau,P.;Tuan,V.A.;Nghiem,V.T.;Lai,S.Y.;Hung,L.N.;Naccache,C.J.Catal.1997,169,55.doi:10.1006/ jcat.1997.1647
(12)Yang,X.M.;Xu,Z.S.;Tian,Z.J.;Ma,H.J.;Xu,Y.P.;Qu, W.;Lin,L.W.Catal.Lett.2006,109,139.doi:10.1007/ s10562-006-0070-6
(13)Wang,Z.M.;Tian,Z.J.;Teng,F.;Wen,G.D.;Xu,Y.P.;Xu, Z.S.;Lin,L.W.Catal.Lett.2005,103,109.doi:10.1007/ s10562-005-6510-x
(14)Wang,Z.M.;Tian,Z.J.;Teng,F.;Xu,Y.P.;Hu,S.;Tan,M. W.;Xu,Z.S.;Lin,L.W.Chin.J.Catal.2005,26,819.[汪哲明,田志坚,滕飞,徐云鹏,胡胜,谭明伟,徐竹生,林励吾.催化学报,2005,26,819.]
(15)Campelo,J.M.;Lafont,F.;Marinas,J.M.Appl.Catal.A-Gen. 1998,170,139.doi:10.1016/S0926-860X(98)00036-2
(16)Tian,S.S.;Chen,J.X.Fuel Process.Technol.2014,122,120. doi:10.1016/j.fuproc.2014.01.031
(17)Mathisen,K.;Stockenhuber,M.;Nicholson,D.G.Phys. Chem.Chem.Phys.2009,11,5476.doi:10.1039/b902491c
(18)Worch,D.;Suprun,W.;Glaeser,R.Catal.Today 2011,176, 309.doi:10.1016/j.cattod.2010.12.008
(19)Jiang,B.Q.;Liu,Y.;Wu,Z.B.J.Hazard.Mater.2009,162, 1249.doi:10.1016/j.jhazmat.2008.06.013
(20)Ning,P.;Song,Z.X.;Li,H.;Zhang,Q.L.;Liu,X.;Zhang,J. H.;Tang,X.S.;Huang,Z.Z.Appl.Surf.Sci.2015,332,130.
(21)Guo,R.T.;Zhen,W.L.;Pan,W.G.;Hong,J.N.;Jin,Q.;Ding, C.G.;Guo,S.Y.Environ.Technol.2014,35,1766.doi: 10.1080/09593330.2014.881424
(22)Mao,D.S.;Tao,L.H.;Guo,Y.L.;Lu,G.Z.Industrial Catalysis 2008,16,21.[毛东森,陶丽华,郭杨龙,卢冠忠.工业催化,2008,16,21.]
(23)Wang,L.S.Low-temperature Selective Catalytic Reduction of MxOy/MWCNTs Catalysts and Reaction Mechanism Study. Master Dissertation,South China University of Technology, Guangzhou,2012.[王丽珊.MxOy/MWCNTs催化剂的低温SCR性能与反应机理研究.广州华南理工大学,2012.]
(24)Myeong-Heon,U.;Kang,M.J.Ind.Eng.Chem.2005,11,540. (25)Xu,X.T.;Zhai,J.P.;Li,I.L.;Ruan,S.C.Appl.Mech.Mate. 2013,275-277,1737.doi:10.4028/www.scientific.net/ AMM.275-277.1737
(26)Zhang,Y.W.;Shen,M.Q.;Wu,X.D.;Weng,D.;Zhang,Z. H.;Tian,R.;Chi,K.B.Acta Phys.-Chim.Sin.2006,22,1495.[张钺伟,沈美庆,吴晓东,翁端,张志华,田然,迟克彬.物理化学学报,2006,22,1495.]doi:10.1016/S1872-1508(06) 60077-6
(27)Liu,Q.Y.;Zuo,H.L.;Wang,T.J.;Ma,L.L.;Zhang,Q.Appl. Catal.A-Gen.2013,468,68.doi:10.1016/j.apcata.2013.08.009 (28)Wang,L.;Huang,B.;Su,Y.;Zhou,G.;Wang,K.;Luo,H.;Ye, D.Chem.Eng.J.2012,192,232.doi:10.1016/j. cej.2012.04.012
(29)Yu,C.L.;Wang,L.S.;Huang,B.C.Aerosol Air Qual.Res. 2015,15,1017.doi:10.4209/acqr.2014.08.0162
(30)Wang,D.;Jangjou,Y.;Liu,Y.;Sharma,M.K.;Luo,J.;Li,J.; Kamasamudram,K.;Epling,W.S.Appl.Catal.B-Environ. 2015,165,438.doi:10.1016/j.apcatb.2014.10.020
(31)Greenhalgh,B.;Fee,M.;Dobri,A.;Moir,J.;Burich,R.; Charland,J.P.;Stanciulescu,M.J.Mol.Catal.A-Chem.2010, 333,121.doi:10.1016/j.molcata.2010.10.008
(32)Stobbe,E.R.;Boer,B.A.;Geus,J.W.Catal.Today 1999,47, 161.doi:10.1016/S0920-5861(98)00296-X
(33)Trawczyński,J.;Bielak,B.;Miśta,W.Appl.Catal.B-Environ. 2005,55,277.doi:10.1016/j.apcatb.2004.09.005
Preparation,Characterization and Low-Temperature NH3-SCR Activity of MnOx/SAPO-11 Catalysts
LIU Xiao-Qing1LI Shi-Hui1SUN Meng-Ting1YU Cheng-Long1HUANG Bi-Chun1,2,*
(1College of Environment and Energy,South China University of Technology,Guangzhou 510006,P.R.China;2Key Laboratory of the Ministry of Education for Pollution Control and Ecosystem Restoration in Industry Clusters, South China University of Technology,Guangzhou 510006,P.R.China)
MnOx/SAPO-11 catalysts were prepared by impregnation,citric acid,and precipitation methods for low-temperature selective catalytic reduction(SCR)of NO with NH3.The results indicated that the MnOx/SAPO-11 catalyst with 20%(w)Mn loading prepared by the precipitation method showed the best SCR activity and N2selectivity.X-ray powder diffraction(XRD),scanning electron microscopy(SEM),energy-dispersive spectrometry (EDS),atomic absorption spectrometry(AAS),N2adsorption-desorption,X-ray photoelectron spectroscopy (XPS),H2temperature-programmed reduction(H2-TPR),NH3temperature-programmed desorption(NH3-TPD), NO/O2temperature-programmed desorption,and mass spectrometry(NO/O2-TPD-MS)were used to analyze the structural properties and catalytic performance of the catalysts.The results indicated that different manganese oxides were formed on the surface of SAPO-11 by the three different preparation methods.MnOxloaded via the precipitation method existed as MnO2phase and amorphous MnOx.The advantages of the catalyst prepared via this method were a large mesoporous and external surface area,the highest content of chemisorbed oxygen and Mn4+as well as more favorable medium and strong acid sites.Thus,more NO2was produced on the catalyst during low-temperature SCR,which was a primary goal.MnOxprepared by all three methods could be well-dispersed on the surface of SAPO-11.The dispersive action of SAPO-11 could affect the formation of MnOx,which could affect the acidity of the catalysts.Thus,the temperature window was widened and N2selectivity was improved compared with pure MnOx,with SAPO-11 acting as an excellent carrier.
November 23,2015;Revised:February 22,2016;Published on Web:February 25,2016.
Selective catalytic reduction;Nitrogen oxide;SAPO-11 molecular sieve; Precipitation method;Manganese oxide
*Corresponding author.Email:cebhuang@scut.edu.cn;Tel:+86-20-39380519.
The project was supported by the National Natural Science Foundation of China(51478191)and Guangdong Provincial Science and Technology Project,China(2014A020216003).
国家自然科学基金(51478191)和广东省省级科技计划项目(2014A020216003)资助
10.1016/j.apsusc.2015.01.118
