蒽贝素对胶原诱导性关节炎大鼠IL-6和IL-17A的影响
2016-09-06余纳蔡小燕林小军唐莼叶静华李伟念
余纳 蔡小燕 林小军 唐莼 叶静华 李伟念
·基础研究论著·
蒽贝素对胶原诱导性关节炎大鼠IL-6和IL-17A的影响
余纳蔡小燕林小军唐莼叶静华李伟念
目的探讨蒽贝素治疗类风湿关节炎(RA)的可能作用机制。方法选取Lewis雌性大鼠建立胶原诱导性关节炎(CIA)模型,将造模成功的大鼠随机分为CIA模型组、甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组 4组,另设正常对照组,每组各8只大鼠。其中甲氨蝶呤组予甲氨蝶呤0.5 mg/kg、每周2次,蒽贝素20 mg/kg组和40 mg/kg组分别予每日1次相应剂量蒽贝素灌胃,正常对照组及CIA模型组灌服等体积溶媒。共给药21 d,期间每周评估大鼠足趾肿胀程度,实验结束时行腹主动脉取血,ELISA法测血清IL-6和IL-17A含量,比较各组间的差异。结果治疗第14日, CIA大鼠双侧足趾均较正常对照组大鼠肿胀(P均<0.01);随着治疗时间的延长,甲氨蝶呤组与蒽贝素20 mg/kg组和40 mg/kg组大鼠的鼠爪肿胀较CIA模型组明显好转(P均<0.01),甲氨蝶呤组与蒽贝素20 mg/kg组和40 mg/kg组间比较差异均无统计学意义(P均>0.05)。影像学观察,CIA模型组出现骨质疏松、关节间隙模糊、狭窄,甲氨蝶呤组与蒽贝素20 mg/kg组和40 mg/kg组存在轻度骨质疏松,足趾小关节间隙清楚,尚未变窄。治疗后,甲氨蝶呤组与蒽贝素20 mg/kg组和40 mg/kg组血清IL-6和IL-17A水平均低于CIA模型组(P均<0.01),其中甲氨蝶呤组与蒽贝素20 mg/kg组和40 mg/kg组血清IL-6水平比较差异均无统计学意义(P均>0.05),蒽贝素组20 mg/kg组和40 mg/kg组的血清IL-17A水平均低于甲氨蝶呤组(P均<0.05),但甲氨蝶呤组与蒽贝素20 mg/kg组和40 mg/kg组血清IL-6和IL-17A水平与正常对照组比较差异仍有统计学意义(P均<0.05)。结论蒽贝素可能通过抑制Th17细胞分化信号通路中相关靶点,降低血清IL-6和IL-17A,缓解关节炎症状。
蒽贝素;胶原诱导性关节炎;甲氨蝶呤;白介素-6;白介素-17A
类风湿关节炎(RA)是一种病因不明的自身免疫性疾病,其病理表现为关节滑膜的慢性炎症、血管翳的形成及关节软骨、骨组织破坏,最终导致关节畸形和功能障碍,是患者丧失劳动力和致残的主要原因之一[1]。1980年以来,甲氨蝶呤作为抗RA的基础药物在临床广泛应用,但也有报道其疗效欠佳及患者不耐受的情况[2]。随着分子免疫学的发展,对T细胞的研究越来越深入,众学者指出CD4+T细胞应分为辅助性T细胞1(Th1)、Th2、调节性T细胞(Treg)和Th17细胞4大亚群,其中Th17/Treg细胞亚群失衡在RA发病中具有重要的作用,且以Th17细胞占优势[3]。以Th17细胞作为靶点的药物研究已成为近年抗RA药物研究领域的一个热点。有文献报道,蒽贝素具有抑制炎症因子表达、促进凋亡及抗肿瘤等药理作用[4-6]。最新研究指出,蒽贝素可抑制Th17细胞分化信号通路中相关靶点[7-8]。目前,笔者尚未见蒽贝素应用于RA治疗的相关报道。故本研究以胶原诱导性关节炎(CIA) 大鼠为模型,观察蒽贝素对CIA大鼠关节炎症及血清中IL-6、IL-17的影响,初步探讨蒽贝素治疗RA的可能作用机制。
材料与方法
一、材料
1. 实验动物
50只SPF级Lewis雌性大鼠,购于北京维通利华公司,许可证号:SCXK(京)2012-0001,体质量170~190 g,饲养于中山大学生命科学学院中药与海洋药物实验室;SPF级动物房温度控制在(23±2)℃,12 h昼夜循环。本实验方案通过该实验单位的动物伦理委员会审查,遵守实验动物福利伦理原则。
2. 主要试剂与仪器
主要试剂:蒽贝素(纯度>98%),广西壮族自治区中医药研究院提供;甲氨蝶呤(每片2.5 mg),上海信谊药厂有限公司生产,批号036150603;牛Ⅱ型胶原(CⅡ),完全弗氏佐剂(CFA) 和不完全弗氏佐剂(IFA),购自美国Chondrex公司;IL-6和IL-17A ELISA 试剂盒购自上海欣博盛生物科技有限公司。主要仪器:济南益延科技发展有限公司YLS-7C足趾容积测量仪,奥地利CliniBio 128C-340全自动酶标仪,日本Mikasa HF100HA高频全自动动物X光机。
二、实验方法
1. 动物模型的制备
所有大鼠适应性饲养1周,随机分为正常对照组(8只)和CIA模型组(42只)。将4 g/L的CⅡ与等量CFA或IFA混合,用组织匀浆器乳化,制备好的乳剂(CⅡ终浓度为2 g/L)置4℃保存备用。初次免疫(第1日)取CⅡ及CFA,CIA模型组每只大鼠分3点皮内注射,即背部(靠近尾部)左右2点分别注射0.2 ml,尾根部注射0.1 ml;第7日采用同样的方法,取CⅡ及IFA皮下注射0.1 ml加强免疫1次,注射部位为尾部基底3 cm处。正常对照组大鼠同时在相同部位注射等体积的生理盐水。
2. 动物分组及给药
初次免疫后第14日,挑选成模大鼠32只[炎症评分>2分,评分依据大鼠每爪临床症状评分:正常为0分、轻微的红肿(单趾)为1分、红肿(大于1趾)为2分、关节红肿为3分、关节和全爪红肿且关节不能弯曲为4分,每侧关节最高4分,每只大鼠炎症评分最高为16分],随机分为CIA模型组、甲氨蝶呤组、蒽贝素低剂量组和高剂量组,每组8只大鼠。依据蒽贝素的急性毒性实验及抗RA药效的预实验确定本研究中蒽贝素的给药剂量分别为20、40 mg/kg[9]。由于蒽贝素为对苯醌类物质,不溶于水,本研究将其混悬于0.5%羧甲基纤维素钠(CMC-Na)进行灌胃给药,每日1次;甲氨蝶呤组的给药剂量参考文献[10]设为0.5 mg/kg,每周2次。正常对照组和CIA模型组每日给予0.5%CMC-Na 0.1 ml/kg。治疗从初次免疫后第14日开始,连续治疗3周,于第36日处死大鼠。
3. 检测指标及方法
足趾容积测量:沿大鼠踝关节处画线,于第1、7、14、21、28、35日用YLS-7C足趾容积测量仪测定大鼠足趾体积,每侧测量3次,结果取平均值。测量值及初次免疫前足趾容积均为左、右足趾之和。以免疫前足趾容积为基础,每周观察鼠爪肿胀情况,记录容积增加的百分比。足趾容积变化情况=(测量值-初次免疫前足趾容积)/初次免疫前足趾容积×100%。
影像学检查:初次免疫后第36日,对实验大鼠进行影像学检查,应用高频全自动动物X光机拍片,在CR数字成像系统下观察大鼠踝关节病变情况。
血清IL-6和IL-17A水平的检测:采用ELISA法,于实验第36日,将全部大鼠用10%水合氯醛麻醉,固定后腹主动脉取血,3 000 r/min离心15 min,取上清液置于-20℃保存,依照ELISA试剂盒说明书操作步骤检测IL-6和IL-17A,反应终止后应用酶标仪检测吸光度,依据样品标准曲线计算IL-6和IL-17A水平。
三、统计学处理
结 果
一、各组大鼠一般情况比较
CIA组大鼠在2次免疫后于第10日开始陆续出现后肢红肿,逐渐蔓延至前肢,症状进行性加重,于第19~21日达到高峰,严重者不能负重,关节炎病变十分明显,且有精神萎靡、进食量减少、轻微脱毛等现象;甲氨蝶呤组大鼠在治疗后第6日、蒽贝素20 mg/kg组大鼠在治疗后第2日各死亡1只。治疗结束后,各组大鼠后足趾肿胀程度如图1所示。
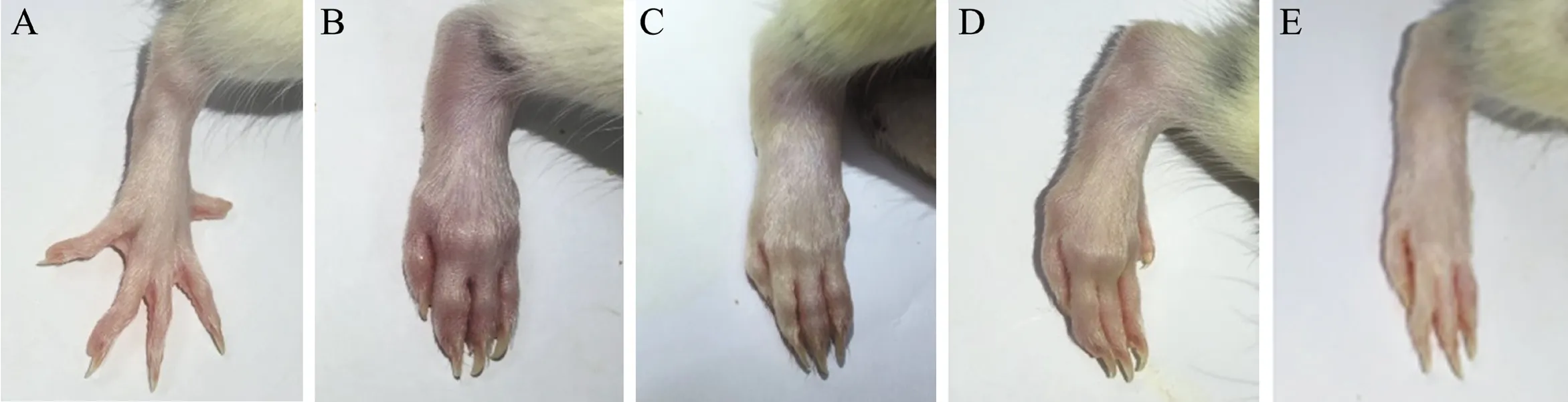
图1 各组大鼠右后足趾肿胀程度比较
A:正常对照组;B:CIA模型组;C:甲氨蝶呤组;D:蒽贝素20 mg/kg组;E:蒽贝素40 mg/kg组
二、各组大鼠足趾容积变化
治疗前(第14日),各组CIA大鼠双侧足趾容积均较正常对照组大鼠增加(F=22.593,P<0.001;正常对照组 vs. CIA模型组、甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为8.355、10.665、7.917、10.999,P均<0.001);第14日初始治疗时,各组CIA大鼠足趾容积比较差异无统计学意义(F=0.106,P=0.956),随着治疗周期的延长,各药物治疗组(甲氨蝶呤组、蒽贝素20 mg/kg组及蒽贝素40 mg/kg组)大鼠较CIA模型组的鼠爪肿胀明显好转(第21日F=6.062、P=0.003,CIA模型组 vs. 甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为2.942、3.721、3.308,P均<0.05;第28日F=10.794、P<0.001,CIA模型组 vs. 甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为4.714、4.964、6.316,P均<0.01;第35日F=6.520、P=0.002,CIA模型组 vs. 甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为3.665、3.754、5.340,P均<0.01),但3个治疗组组间比较差异均无统计学意义(第21~35日,甲氨蝶呤组 vs.蒽贝素20 mg/kg组t分别为0.678、0.559、0.201,P均>0.05;甲氨蝶呤组 vs.蒽贝素40 mg/kg组t分别为0.267、0.709、0.782,P均>0.05;蒽贝素组20 mg/kg vs. 蒽贝素40 mg/kg组t分别为0.420、0.126、0.554,P均>0.05)。
与CIA模型组比较,*P<0.05,**P<0.01
三、各组大鼠影像学检查情况
正常对照组大鼠踝关节X线片显示软组织无肿胀,关节结构完整,骨质无破坏,足趾小关节间隙清楚;CIA模型组大鼠足及踝关节周围软组织肿胀,关节间隙模糊、狭窄,骨关节边缘模糊不清骨质破坏等;甲氨蝶呤及蒽贝素20 mg/kg组和40 mg/kg组虽存在轻度骨质疏松,但足趾小关节间隙清楚,尚未变窄。
四、各组大鼠的血清IL-6和IL-17A水平比较
各组大鼠血清IL-6(F=35.595,P<0.001)和IL-17A(F=53.876,P<0.001)水平比较差异均有统计学意义。甲氨蝶呤及蒽贝素20 mg/kg组和40 mg/kg组血清中IL-6和IL-17A均低于CIA模型组(IL-6:CIA模型组vs.甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为7.176、6.726、8.536、P均<0.001;IL-17: CIA模型组 vs.甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为6.079、7.877、8.442,P均<0.001),但仍高于正常对照组(IL-6:正常对照组 vs. CIA模型组、甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为11.002、-3.961、-4.065、-2.553, P均<0.05;IL-17:正常对照组 vs. CIA模型组、甲氨蝶呤组、蒽贝素20 mg/kg组、蒽贝素40 mg/kg组t分别为-14.184、-8.389、-6.048、-5.943,P均<0.001),见图4。血清IL-6水平方面,甲氨蝶呤组与蒽贝素20 mg/kg组及蒽贝素40 mg/kg组间比较差异均无统计学意义(甲氨蝶呤组 vs. 蒽贝素20 mg/kg组、蒽贝素40 mg/kg组的t分别为-0.229、1.408,P均>0.05)。血清IL-17A水平组间比较,蒽贝素20 mg/kg组、蒽贝素40 mg/kg组均低于甲氨蝶呤组(甲氨蝶呤组 vs. 蒽贝素20 mg/kg组、蒽贝素40 mg/kg组的t分别为2.056、2.446,P均<0.05)。蒽贝素20 mg/kg和40 mg/kg组血清IL-6和IL-17A水平比较差异均无统计学意义(IL-6:t=1.589;IL-17A,t=0.307,P均>0.05)。
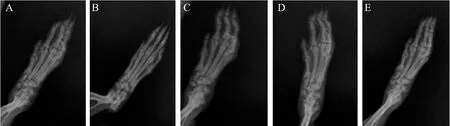
图3 各组大鼠影像学检查情况
A:正常对照组;B:CIA模型组;C:甲氨蝶呤组;D:蒽贝素20 mg/kg组;E:蒽贝素40 mg/kg组
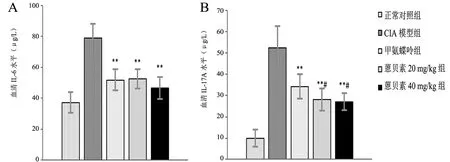
图4 各组大鼠血清IL-6和IL-17A水平比较
与CIA模型组比较,**P<0.01;与甲氨蝶呤组比较,# P<0.05
讨 论
RA是一种复杂的难治性自身免疫性疾病,具体发病机制尚未完全清楚。20世纪80年代以来,甲氨蝶呤作为抗RA的基础药物在临床广泛应用,但也有报道其疗效欠佳及患者不耐受的情况[2]。随着分子免疫学的发展,对T细胞的研究越来越深入,众学者指出CD4+T细胞应分为Th1、Th2、Treg和Th17细胞四大亚群,Th17/Treg细胞亚群失衡在RA发病中具有更为重要的作用,且以Th17细胞占优势[3]。新近研究更加细致明确地阐述了Th17细胞参与RA病程的可能机制:①Th17细胞效应因子IL-17刺激滑膜细胞和巨噬细胞分泌炎症介质,引起RA炎症反应[11]。②诱导滑膜细胞基质金属蛋白酶(MMP)的表达,抑制软骨细胞合成,促进软骨降解[12]。③Th17细胞膜上高表达的核因子-κB受体活化因子配体(RANKL)可与破骨细胞前体RANK结合,从而导致破骨细胞前体分化为破骨细胞(RA骨侵蚀的重要因素)[13]。④诱导成骨细胞及滑膜细胞表达RANKL,增强破骨细胞活性,从而促进了破骨细胞的发育,引起骨质破坏[14]。
Th17细胞在RA的发生、发展中起关键作用,而且高水平的Th17细胞表达可能影响生物制剂的疗效。誉秀华等[15]在临床缓解期对RA患者行外周血Th17检测,指出RA患者外周血中Th17比例明显增高,血清中IL-17和IL-6的水平也有明显提高。传统的改善病情抗风湿药物疗效有限,需要联合用药才能降低Th17细胞[16]。所以将Th17细胞作为靶点的药物研究已成为近年来抗RA药物研究领域的一个热点。IL-17是诱导Th17产生的最重要细胞因子,也是一种强有力的炎症细胞因子,可以诱导多种促炎因子的产生,比如IL-6、TNF-α、IL-1β等。TNF-α、IL-1β等炎症因子笔者已在前期研究中分析过,本研究着重IL-17与IL-6的含量变化,探讨蒽贝素抗RA的可能药理作用机制。
姜姝姝等[17]提出Th17-信号传导与转录激活子3(STAT3)构成了RA促炎症反应的正反馈通路。他们认为,STAT3信号通路在Th17细胞的分化、致炎过程中扮演着重要的角色。在Th17细胞分化过程中,致炎因子IL-6能够诱导STAT3的活化从而激活STAT3通路,IL-6与TNF-α共同促使初始T细胞向Th17细胞的分化,活化中的STAT3信号通路能够激活维甲酸相关孤核受体γt(RORγt)的表达,从而诱导Th17细胞分泌IL-6、IL-17等细胞因子。由Th17细胞分泌的IL-6、IL-17继续参与上述过程,反馈性调节JAK/STAT通路,使得整个RA的炎症级联反应不断放大[14]。针对STAT3作用靶点,刘畅等[18]应用关节腔注射siRNA干扰沉默STAT3,使胶原诱导大鼠滑膜组织中STAT3 mRNA和蛋白表达水平降低,可明显改善CIA大鼠关节的组织病理学表现。
蒽贝素初始作为X连锁凋亡抑制蛋白(XIAP)的有效抑制剂,常被用于抗肿瘤的药物研究中[19]。随着肿瘤免疫微环境概念的提出,Marsh等[20]学者发现蒽贝素可降低肿瘤相关性炎症因子,如IL-1、IL-6、TNF-α。蒽贝素的药理作用广泛,Zhou等[21]将蒽贝素应用于脓毒症模型大鼠,可有效降低促炎性细胞因子,包括TNF-α、IL-1、IL-6,减轻全身炎症反应,改善器官损伤。在Th17介导的免疫炎症方面,Dai等[22]建立结肠炎相关癌症(CAC)模型,发现蒽贝素可抑制结肠IL-6的表达和分泌及STAT3的活化,降低CAC小鼠的发病率及缩小肿瘤体积;通过体外试验证实,在结肠癌细胞中蒽贝素可通过刺激Src同源结构域2蛋白酪氨酸磷酸酶(SHP2)活性减少两者组成和IL-6诱导的STAT3活化。
本研究表明,蒽贝素可有效缓解CIA大鼠的足趾肿胀程度,灌胃治疗21 d后,影像学观察虽存在轻度骨质疏松,但足趾小关节间隙清晰;血清中IL-6和IL-17A明显低于CIA模型组,且蒽贝素组血清IL-17A含量低于甲氨蝶呤组;蒽贝素40 mg/kg组血清IL-6和IL-17A含量较蒽贝素20 mg/kg组均有降低,但比较差异无统计学意义,可能与剂量间隔较小、未动态连续监测血液相关指标或炎症因子反应存在多条反馈通路有关。研究结果提示,蒽贝素可能通过Th17-STAT3通路,降低异常分泌增多的炎症因子,缓解关节炎症状。研究结果表明,蒽贝素具有一定的抗炎作用,对治疗RA有一定疗效,但其具体作用机制仍待进一步研究。
[1]中华医学会风湿病学分会.类风湿关节炎诊治指南.现代实用医学,2004,16(3):184-188.
[2]邓展涛,赵云龙.Stat3基因和SirT1基因参与类风湿关节炎发病机制的研究进展.医学研究生学报,2015,28(9):1001-1003.
[3]Kurebayashi Y, Nagai S, Ikejiri A, Koyasu S. Recent advances in understanding the molecular mechanisms of the development and function of Th17 cells.Genes Cells,2013,18(4):247-265.
[4]Kocak C, Kocak FE, Akcilar R, Isiklar OO, Kocak H, Bayat Z, Simsek H, Taser F, Altuntas I.Molecular and biochemical evidence on the protective effects of embelin and carnosic acid in isoproterenol-induced acute myocardial injury in rats.Life Sci,2016,147:15-23.
[5]Moreno-Martínez D, Nomdedeu M, Lara-Castillo MC, Etxabe A, Pratcorona M, Tesi N, Díaz-Beyá M, Rozman M, Montserrat E, Urbano-Ispizua A, Esteve J,Risueo RM.XIAP inhibitors induce differentiation and impair clonogenic capacity of acute myeloid leukemia stemcells. Oncotarget, 2014,5(12):4337-4346.
[6]Sahu BD, Anubolu H, Koneru M, Kumar JM, Kuncha M, Rachamalla SS, Sistla R.Cardioprotective effect of embelin on isoproterenol-induced myocardial injury in rats: possibleinvolvement of mitochondrial dysfunction and apoptosis.Life Sci,2014,107(1-2):59-67.
[7]Peng M, Huang B, Zhang Q, Fu S, Wang D, Cheng X, Wu X, Xue Z, Zhang L, Zhang D, Da Y, Dai Y, Yang Q, Yao Z, Qiao L, Zhang R.Embelin inhibits pancreatic cancer progression by directly inducing cancer cell apoptosis and indirectlyrestricting IL-6 associated inflammatory and immune suppressive cells. Cancer Lett,2014,354(2):407-416.
[8]Zhao ZG, Tang ZZ, Zhang WK, Li JG.Protective effects of embelin on myocardial ischemia-reperfusion injury following cardiac arrest in a rabbitmodel.Inflammation,2015,38(2): 527-533.
[9]曾宪彪,莫杰明,韦宝伟,韦桂宁,邓津胤.弱碱性蒽贝素氨水溶液小鼠尾静脉注射急性毒性实验研究. 中国药物警戒,2015,12(1):5-10.
[10]Song SS, Huang B, Wang QT, Wu YJ, Fu JJ, Zhang YF, Chang Y, Chen JY, Wu HX, Wang D, Zhang LL, Wei W.BF02, a recombinant TNFR2 fusion protein, alleviates adjuvant arthritis by regulating T lymphocytes inrats.Acta Pharmacol Sin,2013,34(3):414-423.
[11]Mateen S, Zafar A, Moin S, Khan AQ, Zubair S.Understanding the role of cytokines in the pathogenesis of rheumatoid arthritis.Clin Chim Acta,2016,455:161-171.
[12]van Hamburg JP, Asmawidjaja PS, Davelaar N, Mus AM, Colin EM, Hazes JM, Dolhain RJ, Lubberts E.Th17 cells, but not Th1 cells, from patients with early rheumatoid arthritis are potent inducers of matrix metalloproteinases and proinflammatory cytokines upon synovial fibroblast interaction, including autocrine interleukin-17A production.Arthritis Rheum,2011, 63(1):73-83.
[13]范璐,陈海燕,韩捷,周洁如.类风湿关节炎患者Th17细胞膜上RANKL的表达及意义.同济大学学报(医学版),2011,32(2):58-61.
[14]Kikuta J, Wada Y, Kowada T, Wang T, Sun-Wada GH, Nishiyama I, Mizukami S, Maiya N, Yasuda H, Kumanogoh A, Kikuchi K, Germain RN, Ishii M. Dynamic visualization of RANKL and Th17- mediated osteoclast function. J Clin Invest, 2013,123(2):866-873.
[15]誉秀华,周桂桃.临床缓解期类风湿关节炎患者行外周血Th17检测的意义分析.中国医学工程,2015,23(11):35-37.
[16]王丽芳.CIA动物模型中不同治疗方案对Th17/Treg细胞及IL-17表达影响的实验研究.桂林:桂林医学院.
[17]姜姝姝,高梓珊,甘君学,傅淑平,郭江燕.Th17-stat3正反馈通路在类风湿性关节炎促炎机制中的研究进展.辽宁中医杂志,2015,42(4):897-901.
[18]刘畅,高薇,冯欣. RNA干扰沉默STAT3对胶原诱导大鼠类风湿性关节炎的治疗作用.吉林大学学报(医学版) , 2015,41(1):77-82.
[19]Poojari R.Embelin-a drug of antiquity: shifting the paradigm towards modern medicine.Expert Opin Investig Drugs,2014,23(3):427-444.
[20]Marsh JL, Jackman CP, Tang SN, Shankar S, Srivastava RK. Embelin suppresses pancreatic cancer growth by modulating tumor immune microenvironment.Front Biosci (Landmark Ed),2014,19:113-125.
[21]Zhou XL, Huang L, Cao J.Embelin reduces systemic inflammation and ameliorates organ injuries in septic rats through downregulating STAT3 and NF-κB pathways. Inflammation,2015,38(4):1556-1562.
[22]Dai Y, Jiao H, Teng G, Wang W, Zhang R, Wang Y, Hebbard L, George J, Qiao L.Embelin reduces colitis-associated tumorigenesis through limiting IL-6/STAT3 signaling.Mol Cancer Ther,2014,13(5):1206-1216.
(本文编辑:林燕薇)
Effect of embelin on the expression of IL-6 and IL-17A in collagen-induced arthritis rat models
Yu Na, Cai Xiaoyan, Lin Xiaojun, Tang Chun, Ye Jinghua, Li Weinian.
Department of Rheumatology & Immunology, Guangzhou First People’s Hospital, Guangzhou 510180, China
ObjectiveTo evaluate the effect and potential mechanism of embelin in the treatment of rheumatoid arthritis (RA). MethodsLewis female rats were selected to establish collagen-induced arthritis (CIA) models. Then, the rat models were randomly divided into the CIA model, methotrexate, 20 mg/kg and 40 mg/kg embelin groups (n=8 for each group). Another 8 normal rats was as control group. In the methotrexate group, the rats were administered with 0.5 mg/kg methotrexate twice a week. In the embelin groups, intragastric gavage of 20 and 40 mg/kg of embelin was delivered. In the control and CIA model groups, an equivalent quantity of solvent was given. The medicine was administered for 21 d. The degree of toe swelling was evaluated every week. After corresponding medicine administration, blood sample was collected via the abdominal aorta and prepared for measurement of serum levels of IL-6 and IL-17A. The data were statistically compared among different groups. ResultsAfter 14-d treatment, bilateral toe swelling in the CIA model group was significantly more severe compared with that in the control group (all P<0.01). Along with the course of treatment, the symptoms of toe swelling in the methotrexate, 20 and 40 mg/kg embelin groups were evidently alleviated compared with those in the CIA model group (all P<0.01), whereas no statistical significance was noted among methotrexate, 20 and 40 mg/kg embelin groups (all P>0.05). Imaging examination revealed the signs of osteoporosis, indistinct joint space, stenosis in the methotrexate group, and slight osteoporosis, clear joint space but no stenosis was noted in methotrexate, 20 and 40 mg/kg groups. After treatment, the mean serum levels of IL-6 and IL-17A in the methotrexate, 20 and 40 mg/kg embelin groups were significantly down-regulated compared with those in the CIA model group (all P<0.01), whereas no statistical significance was observed in IL-6 levels among the methotrexate, 20 and 40 mg/kg embelin groups (all P>0.05). The mean serum levels of IL-17A in the 20 and 40 mg/kg embelin groups were considerably lower than that in the methotrexate group (both P<0.05).The serum levels of IL-6 and IL-17A in the methotrexate, 20 and 40 mg/kg embelin groups significantly differed from that in the control group (all P<0.05). ConclusionEmbelin can mitigate the symptoms of joint inflammation probably via suppressing the targets in the signaling pathway of Th17 cell differentiation and down-regulating the serum levels of IL-6 and IL-17A.
Embelin; collagen-induced arthritis; Methotrexate; Interleukin-6; Interleukin-17A
10.3969/j.issn.0253-9802.2016.08.004
广东省中医药局科研课题(20151015)
510180 广州,广州市第一人民医院风湿免疫科
2016-05-07)
