一个水稻类受体蛋白激酶OsRPK2的过量表达分析
2016-09-06曹振华李莹莹刘晨曦栾维江
曹振华,宋 婷,李莹莹,熊 炜,刘晨曦,栾维江
(天津师范大学 a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
一个水稻类受体蛋白激酶OsRPK2的过量表达分析
曹振华,宋 婷,李莹莹,熊 炜,刘晨曦,栾维江
(天津师范大学 a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
为了解类受体蛋白激酶OsRPK2在水稻发育中的作用,采用反向遗传学方法构建了该蛋白激酶基因的过表达载体,将其导入野生型水稻中获得转基因植株后,观察植株的表型变化以及该基因在水稻植株不同部位的表达情况.结果发现,OsRPK2的转基因植株产生白化现象,qRT-PCR分析表明白化植株中OsRPK2的表达量明显增加,说明水稻转基因植株的白化表型是由OsRPK2基因的过表达造成的.OsRPK2的组织特异性表达结果表明,OsRPK2在水稻的不同组织器官中均有表达,但在水稻幼嫩的分生组织和幼龄叶片中表达量较高,反映了OsRPK2在水稻植株发育及建成中具有重要作用.
水稻;类受体蛋白激酶OsRPK2;过表达;白化
蛋白激酶(protein kinase)是一类催化蛋白质磷酸化反应的酶,能将三磷酸腺苷(ATP)上的γ磷酸转移到蛋白质分子的氨基酸残基上,大多数情况发生在丝/ 苏/酪氨酸残基上[1].蛋白激酶在细胞信号通路中起化学修饰作用,参与多种生物学功能,如细胞的生长、分裂、分化、细胞间的相互作用等[2].目前预测在水稻基因组中的蛋白激酶编码基因超过1 500个,主要参与植物的叶片衰老及逆境应答反应等过程[3].植物类受体蛋白激酶(receptor-like protein kinase,RLK)是一类包含胞外结构域、单次跨膜域和胞内激酶域的蛋白分子,它们通过胞外结构域与胞外信号分子的特异结合来激活胞内激酶域的自磷酸化和互磷酸化活性,完成跨膜传递信号的功能[4],从而调控植物的生长发育和激素信号转导过程.如在拟南芥中,类受体蛋白激酶HAESA具有丝氨酸/苏氨酸蛋白激酶活性,在萼片、花瓣、叶柄和花梗基部均有表达,该激酶表达量的降低会导致花器官延迟脱落[5];BRI1激酶在分生组织、根、芽和种子的下胚轴均有表达,亚细胞定位结果显示该激酶在细胞膜上感应BR(Brassinosteroids)信号,并通过细胞内的蛋白激酶区传递该信号[6];BAK1也具有丝氨酸/苏氨酸蛋白激酶活性,能够与BRI1发生磷酸化作用从而参与BR的信号转导[7].RLK在植株抗病中也具有重要作用.如Song等[8]研究发现,水稻中与抗白叶枯病相关的Xa21蛋白激酶可以激活细胞内的防御反应,识别病原体配体;胡丹丹等[9]在水稻中发现了1个蔗糖非酵解型蛋白激酶(又称胁迫相关蛋白激酶)OsSAPK2,该激酶可能通过调控抗病相关基因OsLRR1、OsHIR1以及感病相关基因OsMAPK5的表达来调控水稻对白叶病的抗病反应.
动植物响应外界胁迫时会普遍产生以H2O2为中心的活性氧(ROS),质膜NADPH氧化酶(NOX)在胁迫条件下细胞ROS的产生和积累过程中起主要作用.用生物信息学方法在水稻NOX数据库中发现水稻中至少有11个基因的产物具有NOX活性,为了研究其中1个基因OsNox2在抗旱调控方面的作用,王刚锋[10]利用基因芯片技术对osnox2干旱材料中的相关基因进行表达分析,发现了2个有类受体蛋白激酶活性的基因在osnox2缺失突变体中明显下调,分别命名为OsRPK1 (LOC_Os09g19380)和OsRPK2(LOC_Os06g16300).这2个基因在水稻遭受到高温、低温或者盐胁迫时,表达量都会上升.本研究利用反向遗传学方法构建了OsRPK2基因的过表达载体,将其导入野生型水稻植株中,对比分析转基因植株和野生型水稻植株的表型差异,以此探讨类受体蛋白激酶OsRPK2在水稻生长发育中的功能和作用机理.
1 材料与方法
1.1 材料
粳稻品种日本晴(Oryzasativa L.ssp.Japonica Nipponbare)及其转基因植株.
1.2 主要仪器与试剂
PCR仪(9002,美国Applied Biosystems公司);凝胶成像分析仪(美国BIO-RAD公司);琼脂糖水平电泳仪(美国Baygene公司);超速离心机和分光光度计(美国Eppendorf公司).
M-MLV反转录酶、DNA限制性内切酶、T4 DNA连接酶、DNA Marker 2000、DNA Marker 15000(美国Takara公司);Trizol试剂(美国Invitrogen公司);质粒小量提取试剂盒(美国OMEGA Bio-Tek公司);普通PCR试剂(北京鼎国生物有限公司);DNA凝胶回收试剂盒、PCR产物纯化试剂盒(北京康为世纪生物有限公司).引物合成及DNA测序由金唯智生物科技有限公司完成.
1.3 实验方法
1.3.1 过表达载体的构建
采用RT-PCR方法获得目的基因OsRPK2的全长开放阅读框架(open reading framework,ORF).从生长30 d的水稻叶片中提取总RNA,用M-MLV反转录酶反转录合成cDNA,以其为模板,用基因特异性引物ORPK2F(5′-TCGCGGTACCAGCTACCTTCATCAGCAAT-3′)和ORPK2R(5′-GCTGTCGACACAGACGGAACAGTAAAATC-3′)进行PCR扩增,获得OsRPK2的全长开放阅读框架.获得的目的片段纯化回收后连入过表达空载体pCAMBIA2300中,酶切检测及测序正确后导入农杆菌EHA105中,用介导遗传转化方法将载体导入日本晴中获得转基因植株.PCR扩增条件:98℃下1 min;运行35次循环的98℃30s、60℃15s、72℃45s;之后72℃延伸7 min.
1.3.2 转基因植株的分子检测
采用CTAB法从水稻叶片中提取基因组DNA,然后用载体中的NPTⅡ抗性基因进行分子检测.引物为NPTⅡF(5′-TTGTCACTGAAGCGGGAAGGG-3′)和NPTⅡR(5′-GCGATACCGTAAAGCACGAGGAA-3′).PCR扩增条件:94℃下4 min;运行32次循环的94℃30 s、56℃30 s、72℃30 s;之后72℃延伸5 min.PCR反应结束后用琼脂糖凝胶电泳进行检测.
1.3.3 目的基因的表达分析
采用逆转录定量PCR技术(qRT-PCR)对目的基因的表达进行分析.从生长50d的转基因水稻叶片中提取总RNA,用于分析转基因植株中OsRPK2的表达;分别从野生型植株的根、茎、叶和各个时期的幼穗等材料中提取总RNA,用于分析目的基因组织特异性的表达;从生长70 d的野生型水稻最上部叶片、倒2叶、倒3叶及倒4叶中提取总RNA,用于分析不同叶龄叶片中目的基因的表达.用去基因组的反转录试剂盒对500 ng的总RNA进行反转录获得cDNA,以其为模板进行RT-PCR反应.所用引物:RPK2-F(5′-ACCTGTCGCACCTTGTTTTC-3′)和RPK2-R(5′-GGCGTTCTCCATTTGCTCTT-3′).PCR扩增条件:94℃下4 min;运行32次循环的94℃30 s、54℃30 s、72℃30 s;之后72℃延伸7 min.
以水稻OsActin1为内参进行相对定量分析,内参基因所用引物为:ActinF(5′-GACTCTGGTGATGGTGTCAGC-3′)和ActinR(5′-GGCTGGAAGAGGACCTCAGG-3′).PCR反应程序为:95℃下1 min;运行24个循环的94℃30 s、56℃30 s、72℃30 s;之后72℃延伸5 min.每个反应重复3次.
2 结果及分析
2.1 过表达载体的构建
本研究构建的OsRPK2基因的过表达载体结构如图1(a)所示.通过RT-PCR方法获得了OsRPK2基因的完整ORF,目的片段经检测符合预期设计,如图1(b)所示.纯化回收后用相应的限制性内切酶KpnⅠ和SalⅠ对目的片段和空载体pCAMBIA2300进行酶切,纯化回收后用T4 DNA连接酶进行连接,获得重组质粒.之后对重组质粒进行酶切检测,发现切出了预期的目的片段,如图1(c)所示,表明目的片段已成功连入空载体中.对获得的重组质粒进行测序,得到的测序结果与NCBI(美国国立生物技术信息中心)中OsRPK2基因的cDNA序列进行比对,确定分析序列正确后,将过表达载体质粒转化到农杆菌EHA105中,用于后续的转基因实验.

图1 OsRPK2基因的过表达载体构建Fig.1 Construction of ectopic vector OsRPK2
2.2 转基因植株的PCR检测、表达及表型分析
将重组载体pCAMBIA2300-OsRPK2导入野生型水稻中,最终获得20个T0代独立株系,T0代植株共102株.为了检测T0代植株的基因组中是否含有重组载体,利用载体标记基因NPTⅡ的特异性引物对转基因植株进行PCR扩增,结果显示102株中的96株含有标记基因,阳性率为94.1%,部分植株的检测结果如图2(a)所示.随机选取5个T0代株系产生T1代转基因植株,结果发现有2个株系在苗期出现白化现象,如图2(b)所示.为了验证白化现象是否由OsRPK2基因的过量表达造成,利用qRT-PCR方法对转基因植株OsRPK2的表达进行分析,结果如图2(c)所示.与野生型相比,白化植株的目的基因OsRPK2的表达量明显提高,表明水稻的白化表型确实与OsRPK2的过表达有关.
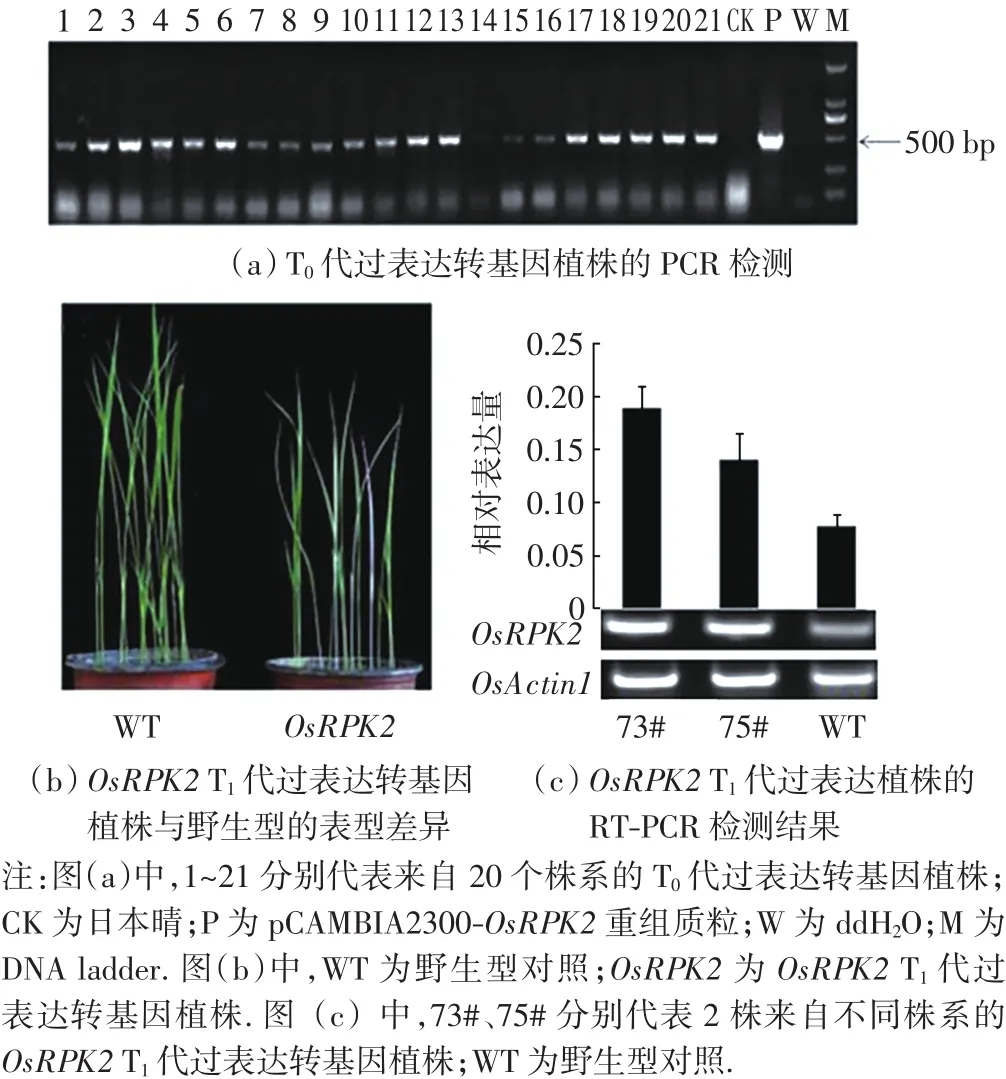
图2 OsRPK2 T1代转基因植株的PCR检测、表达及表型分析Fig.2 PCR detection,expression and phenotype in OsRPK2 transgenic plants of T1generation
2.3 OsRPK2基因在水稻中的表达分析
考察OsRPK2基因在水稻不同器官组织和不同叶龄叶片中的表达情况,结果如图3所示.

图3 OsRPK2基因的组织特异性表达Fig.3 Tissue-specific expression of OsRPK2
分别提取日本晴的总RNA,研究OsRPK2基因在水稻不同组织器官中的表达,结果如图3(a)所示.图3 (a)所示为野生型水稻植株幼嫩的茎顶端分生组织(SAM)、幼根、成熟叶、成熟叶鞘、茎、不同时期穗中OsRPK2的表达情况.由此可知,OsRPK2基因在水稻的不同组织器官中均有表达,但在幼嫩的茎顶端分生组织中表达量最高,在其他组织中表达量较低.分析OsRPK2在水稻不同叶龄叶片中的表达,结果如图3 (b)所示,OsRPK2基因在叶龄较小的最上部叶片、倒二叶、倒三叶中表达量较高,但在衰老的倒四叶中的表达量较低.这与其在不同组织器官中的表达结果吻合,暗示了OsRPK2在整个水稻植株的发育及衰老中具有重要作用.
3 结论
本研究利用反向遗传学技术构建水稻类受体蛋白激酶基因OsRPK2的过表达载体,导入野生型水稻中产生转基因植株,以此探讨该基因在水稻中除了与胁迫反应相关之外的其他功能.结果发现,该基因在水稻的茎顶端分生组织和幼龄叶片中表达量较高,在其他部位相对较低.茎顶端分生组织中有长期保持分生能力的原始细胞及刚衍生的细胞,为植物的器官和组织不断合成新细胞[11].OsRPK2基因在水稻茎顶端分生组织和幼龄叶片中高表达表明该基因可能与水稻发育密切相关.另一方面,OsRPK2的过量表达也会造成水稻幼苗出现白化现象,白化苗最典型的特征就是叶绿体不能正常发育[12],这说明OsRPK2基因与水稻叶片叶绿体的合成有关,过量表达会抑制叶绿体的正常合成.
本课题组今后还将构建OsRPK2的RNAi载体,进一步揭示OsRPK2基因在干扰情况下的功能.从而全面揭示该基因与叶绿素合成及叶绿体发育途径相关基因之间的相互作用和调控关系,精确阐明OsRPK2在水稻生长发育中的功能.
[1]张春宝,赵丽梅,赵洪琨,等.植物蛋白激酶研究进展[J].生物技术通报,2011(10):17-23.ZAHNG C B,ZHAO L M,ZHAO H K,et al.Advances in plant protein kinase[J].Biotechnology Bulletin,2011(10):17-23(inChinese).
[2]杨新平,夏家辉.蛋白激酶研究进展Ⅰ结构和分类[J].生命科学研究,1998,2(4):235-242.YANG X P,XIA J H.Progress on protein kinasesⅠ structure and classification[J].Life Science Research,1998,2(4):235-242(in Chinese).
[3]CHEN X H,TAO Y,LIU G Z,et al.A recombination based strategy for assembling open-reading frames[J].Plant Molecular Biology Reporter,2005,23(4):1-7.
[4]石翠翠,高雷更,惠颖,等.植物类受体蛋白激酶的研究进展[J].河北师范大学学报:自然科学版,2010,34(2):216-219.SHI C C,GAO L G,HUI Y,et al.Progress of study on receptor-like protein kinases in plant[J].Journal of Hebei Normal University:Natural Science Edition,2010,34(2):216-219(in Chinese).
[5] JINN T L,STONE J M,WALKER J C.HAESA,an Arabidopsis leucine-rich repeat receptor kinase,controls floral organ abscission[J].Genes Devel,2000,14(1):108-117.
[6]FRIEDRICHSEN D M,JOAZEIRO C A P,LIJM,et al.Brassinosteroidinsensitive-1 is a ubiquitously expressed leucine-rich repeat receptor serine/threonine kinase[J].Plant Physiology,2000,123(4):1247-1256.
[7]LI J,WEN J Q,LEASE K A,et al.BAK1,an Arabidopsis LRR receptor-like protein kinase,interacts with BRI1 and modulates brassinosteroid signaling[J].Cell,2002,110(2):213-222.
[8]SONG W Y,WANG G L,CHEN L L,et al.A receptor kinase-like protein encoded by the rice disease resistance gene,Xa21[J].Science,1995,270(5243):1804-1806.
[9]胡丹丹,张帆,黄立钰,等.胁迫相关蛋白激酶基因OsSAPK2调控水稻抗白叶枯病反应[J].作物学报,2015,41(8):1191-1200.HU D D,ZHANG F,HUANG L Y,et al.Stress-activated protein kinase OsSAPK2 involved in regulating resistant response to Xanthomonas oryzae pv.oryzaeinrice[J].Acta Agronomica Sinica,2015,41(8):1191-1200(in Chinese).
[10]王刚锋.水稻两个ROS调控相关RPK基因的克隆及其功能研究[D].榆林:西北农林科技大学,2014.WANG G F.Clonging and Functional Studies of Two ROS Regulation Related RPK Genes in Rice[D].Yulin:North West Agriculture and Forestry University,2014(in Chinese).
[11]姜研,祖伟,吴存祥.茎顶端分生组织在植物生长发育过程中的保持转变和逆转[J].细胞生物学杂志,2008,30(2):147-152.JIANG Y,ZU W,WU C X.Maintenace,transition and reversion of the shoot apical meristem during plant development[J].Chinese Journal of Cell Biology,2008,30(2):147-152(in English).
[12]朱明库,胡宗利,周爽,等.植物叶色白化研究进展[J].生命科学,2013,24(3):255-261.ZHU M K,HU Z L,ZHOU S,et al.Research progress of plant leaf albino[J].Chinese Bulletin of Life Sciences,2013,24(3):255-261(in Chinese).
(责任编校 纪翠荣)
Overexpression analysis of OsRPK2,a receptor-like protein kinase in rice
CAO Zhenhua,SONG Ting,LI Yingying,XIONG Wei,LIU Chenxi,LUAN Weijiang
(a.College of Life Sciences,b.Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin Normal University,Tianjin 300387,China)
To investigate the function of OsRPK2,a receptor-like protein kinase in rice,the overexpression vector of Os-RPK2 was constructed and introduced into the wild type of rice to produce transgenetic plants.Phenotypic observation found that transgenetic lines exhibited albino phenotype.The qRT-PCR analysis revealed that the expression of OsRPK2 significantly increased in the albino seedings compared with wild type plants,which suggested that the albino phenotype of rice was caused by the overexpression of OsRPK2.The tissue specific expression of OsRPK2 showed that OsRPK2 was expressed in different organs of rice,especially with high expression in shoot apical meristem and young leaves,which indicated that OsRPK2 played important roles in the development and plant architecture of rice.
rice;receptor-like protein kinase OsRPK2;overexpression;albino
Q943.2
A
1671-1114(2016)03-0050-04
2015-12-23
国家自然科学基金资助项目(31171515);天津市高校中青年骨干创新人才培养计划资助项目(ZX110gg017).
曹振华(1989—),女,硕士研究生.
栾维江(1971—),男,教授,主要从事水稻功能基因组学方面的研究.
