碱性蛋白酶水解豆粕制备ACE抑制肽水解条件的优化
2016-09-06田中原王亚萍孙建华
田中原,王亚萍,刘 屾,任 毅,冯 欣,孙建华
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
碱性蛋白酶水解豆粕制备ACE抑制肽水解条件的优化
田中原,王亚萍,刘 屾,任 毅,冯 欣,孙建华
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
为了寻求高效的血管紧张素转换酶(ACE)抑制肽制备方法,在实验室条件下利用碱性蛋白酶水解豆粕生产ACE抑制肽,并采用单因素和多因素实验相结合的方法对酶解条件进行优化.结果发现,适当延长碱性蛋白酶的水解时间和提高pH,可大幅度提高ACE抑制肽的抑制活性.单因素和多因素实验综合结果显示,碱性蛋白酶水解豆粕产生ACE抑制肽的适宜水解条件为:pH为9.0,水解温度为50℃,水解时间为4h,蛋白酶质量分数(酶质量/底物质量)为2.0%,底物质量浓度为40g/L,在此条件下制备的ACE抑制肽的抑制率可达到97.97%.
豆粕;ACE抑制肽;碱性蛋白酶;酶解条件;优化
豆粕是大豆提取豆油后的副产品,其蛋白质含量较高,一般为43%左右.其中,赖氨酸约为6.0%,色氨酸约为1.2%,亮氨酸约为9.4%[1].利用酶解豆粕法可以制备食源性的血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽[2],它能够抑制ACE的活性,从而实现降低血压的功能,是一种潜在的降压药物[3].ACE通过两条途径对血压产生影响:一方面,ACE可以将血管紧张素Ⅰ转变为血管紧张素Ⅱ,而血管紧张素Ⅱ能够促进血管收缩,导致血压升高;另一方面,ACE作用于舒激肽使其失活,从而失去扩张血管的作用,可以导致血压升高[4].若能够抑制ACE的活性,就可以对高血压进行有效防治.传统的化学合成降压药可有效抑制ACE的活性,但长期服用具有副作用大的缺点.食源性降压肽虽然效果不如合成药物,但其具有无副作用、温和、安全的特点且不影响正常者的血压.因此,食源性ACE抑制肽的研究备受关注,其应用前景十分广阔[5].降压肽的制备方法多种多样:从原料看,包含多种动植物原料及下脚料;从生产工艺区分又可分为发酵法[6]、自溶法[7]、酶解法[8]等.酶解法是目前最常用的制备方法,如使用碱性蛋白酶、中性蛋白酶、木瓜蛋白酶制备降压肽等.其中碱性蛋白酶水解产物具有较高的ACE抑制活性[9].
本课题组前期研究结果表明,碱性蛋白酶水解豆粕产物的ACE抑制活性能够随着酶解条件的优化有效提高至64.24%[10].在此基础上,本研究对碱性蛋白酶水解豆粕生产ACE抑制肽的酶解条件进行更深入的优化,旨在进一步提高碱性蛋白酶水解豆粕产物的ACE抑制活性,以期为ACE抑制肽的大规模生产提供理论和实验依据.
1 材料与方法
1.1 材料与试剂
碱性蛋白酶(天津市诺奥科技发展有限公司);食用级豆粕(市售);硼酸(分析纯,天津市风船化学试剂科技有限公司);硼砂(分析纯,天津市元立化工有限公司);三氟乙酸(分析纯,上海市科丰试剂厂);甲醇(色谱纯,美国迪马科技公司);马尿酰组氨酰亮氨酸(HHL)和ACE(ACE来自兔肺,美国Sigma公司).
1.2 仪器与设备
电热恒温水槽(DK-8D,上海精宏实验设备有限公司);加热磁力搅拌器(EMS-8A,天津市欧诺仪器仪表有限公司);pH计(PHS-3E,上海仪电科学仪器股份有限公司);高效液相色谱仪(1200,美国安捷伦公司);微型超声波清洗器(KQ116,郑州长城仪器有限公司).
1.3 方法
1.3.1 酶解抑制肽样品的制备
本研究主要考察pH、水解温度、水解时间、酶浓度、底物浓度对碱性蛋白酶水解豆粕制备ACE抑制肽的影响.通过向体系中滴加1mol/L的NaOH溶液保持反应体系pH值的恒定,同时记录加入量,用于计算水解度.将取得的样品溶液在4℃、12500 r/min条件下离心15min,吸取上清液.对上清液进行冷冻干燥,然后制成ACE抑制肽粉末.将粉末用硼酸缓冲液(pH 8.3,含0.3 mol/L的NaCl)稀释到一定浓度,测定其抑制活性.
1.3.2 碱性蛋白酶水解度的测定方法
采用Ph-STAT法[11]测定碱性蛋白酶的水解度.
1.3.3 ACE抑制肽活性的检测方法
本研究采用HPLC法测定ACE抑制肽的活性.原理:以HHL为底物,ACE抑制肽为催化剂,通过检测加入ACE抑制肽前后生成物马尿酸的峰面积的差值,计算得到抑制率.该方法检测时间短、准确性高[11],既可测定天然源抑制肽,也可测定人工合成的抑制肽.
用0.45 μm的滤膜分别过滤质量浓度为0.5、1.0、2.0、5.0、10.0、15.0和20.0 μg/mL的马尿酸标准液,之后用高效液相色谱仪检测,分别测得不同标准液的相对峰值,进行线性回归,得到回归方程为:
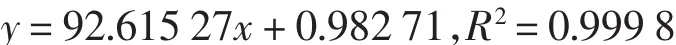
式中:x为马尿酸的质量浓度(μg/mL);y为峰面积(mAu·s).
色谱分析条件:色谱柱为Zorbax300SB-C18型(5 μm,4.6 mm×150 mm,美国Agilent公司);紫外检测波长为228 nm;柱温为26℃;流动相为甲醇-超纯水(体积比为1∶1),含体积分数为0.1%的三氟乙酸;流速为0.7 mL/min;进样量为20 μL;时间为8 min.
测定管:取配置好的0.5 g/L的抑制肽样品60μL 与10 μL的ACE溶液混合,37℃水浴10 min后,加入50 μL的HHL溶液.将反应体系置于37℃水浴中反应60 min后,加入100 μL的浓度为1 mol/L的HCl终止反应.而后将反应液过0.45 μm的滤膜,再进行液相色谱检测分析.
对照管:用60 μL的硼酸缓冲液(pH为8.3,含0.3 mol/L的NaCl)替代抑制肽溶液.
空白对照:用70 μL的硼酸缓冲液(pH为8.3,含0.3 mol/L的NaCl)替代抑制肽溶液和ACE溶液.
计算公式为:
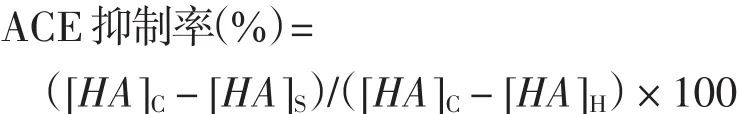
式中:[HA]C为对照样品的马尿酸浓度;[HA]S为测定样品的马尿酸浓度;[HA]H为空白对照的马尿酸浓度.
1.3.4 单因素实验
本研究设计了5组实验,每组只改变pH、水解温度、水解时间、酶浓度(酶质量/底物质量)、底物浓度5种因素中的1种,探讨其对碱性蛋白酶水解度的影响.
1.3.5 多因素实验
由于酶的最适水解温度和最适pH值相对固定,根据单因素实验的数据分析,遵循“均匀”和“整齐”的原则设计多因素实验,分析水解时间(2、3、4、5 h)、酶的质量分数(1.0%、1.5%、2.0%、2.5%)、底物质量浓度(40、45、50、55、60 g/L)3个因素对实验结果的影响.多因素实验能够对单因素实验的结果进行验证和补充说明.
2 结果与分析
2.1 碱性蛋白酶的水解度与其制备的冻干样品ACE抑制肽的活性
本研究采用碱性蛋白酶水解豆粕,其水解度和产生的ACE抑制肽的活性随取样时间的变化规律如图1所示.HHL和马尿酸的检测波长与保留时间参考温雪琴等[10]的方法.由图1可以看出,随着水解时间的延长,碱性蛋白酶的水解度在最初的1 h内急剧升高,之后增速放缓.ACE抑制肽的抑制率在最初的1 h内也是急剧升高,在水解2 h后达到峰值,抑制率超过55%.之后的2 h内抑制率保持平稳,水解4 h后抑制率开始下降.此结果与温雪琴等[10]的研究存在差异,可能是由于水解条件中pH的改变引起的.
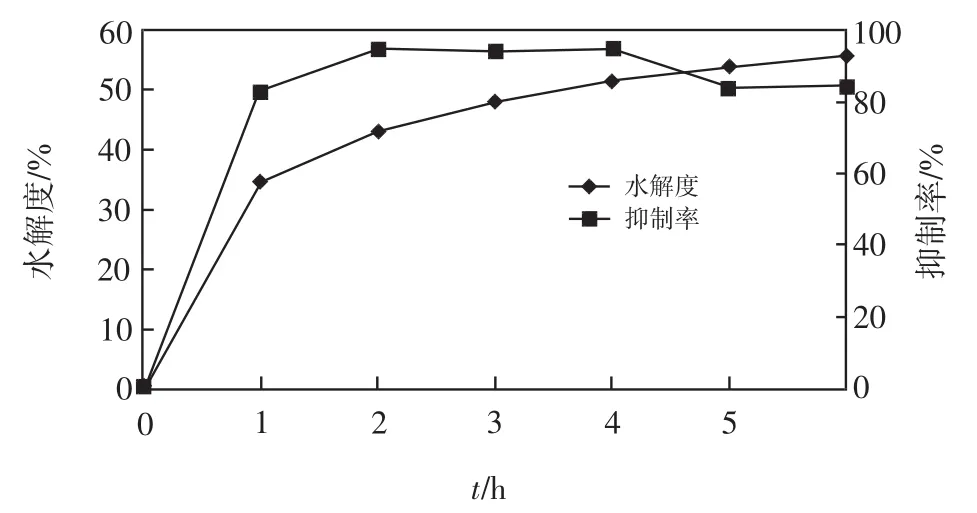
图1 碱性蛋白酶水解度与其制备的冻干样品ACE抑制肽的活性Fig.1 Hydrolysis degree and ACE inhibitory activity of alkali protease freeze dried samples
2.2 不同pH值对碱性蛋白酶水解度的影响
在底物质量浓度为40 g/L、温度为50℃、水解时间为4 h、酶的质量分数为2.0%的条件下,分别测定pH 为7.0、8.0、9.0、10.0、11.0时的水解度,结果如图2所示.
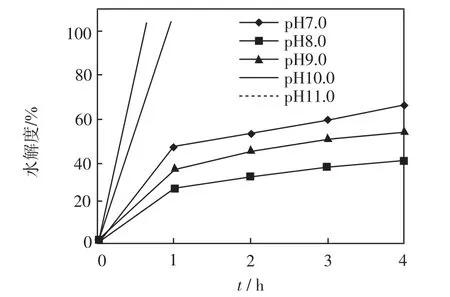
图2 不同pH值下碱性蛋白酶的水解度Fig.2 Hydrolysis degree of alkali protease under different pH
由图2可以看出,pH为7.0、8.0、9.0时,碱性蛋白酶水解度的曲线在4 h内的上升趋势相似,但pH为7.0时的水解程度明显高于pH为8.0和9.0时的水解程度.在pH为10.0和11.0的条件下,底物在最初的1 h内就快速水解,水解度高达90%以上,在2 h以后水解度均达到了100%,这种情况可能导致蛋白质在水解过程中大量水解成氨基酸,肽的得率相对较低.尽管pH为7.0时碱性蛋白酶的水解度高于pH为8.0和9.0,但是水解度的高低与抑制率的高低并不完全一致,后期实验结果表明在pH7.0、8.0、9.0条件下制备的ACE抑制肽活性分别是90.56%、94.62%、94.65%.综合以上结果,证实碱性蛋白酶水解豆粕生产ACE抑制肽的最佳pH为9.0.
2.3 不同温度对碱性蛋白酶水解度的影响
在底物质量浓度为40 g/L、pH为9.0、水解时间4 h、酶的质量分数为2.0%的条件下,测定水解温度分别为50、55、60、65、70℃条件下碱性蛋白酶的水解度,结果如图3所示.
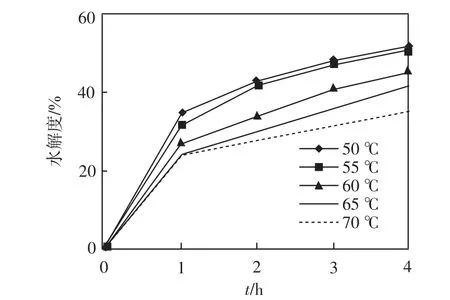
图3 不同温度下碱性蛋白酶的水解度Fig.3 Hydrolysis degree of alkali protease under different temperatures
由图3可以看出,反应体系中的温度越高,水解度反而越低,这可能是由于高温抑制了蛋白酶的活性.因此认为碱性蛋白酶的最佳反应温度为50℃.
2.4 不同水解时间对碱性蛋白酶水解度的影响
在底物质量浓度为40g/L、pH为9.0、温度为50℃、酶的质量分数为2.0%的条件下,分别测定水解1、2、3、4、5、6 h的水解度,结果如图4所示.
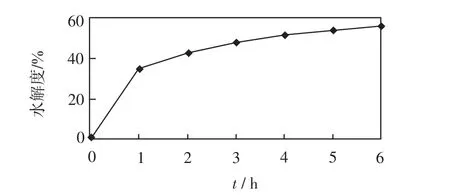
图4 不同时间下碱性蛋白酶的水解度Fig.4 Hydrolysis degree of alkali protease in different time
由图4可以看出,碱性蛋白酶的水解度随着反应的进行不断增加,在最初的1 h内增加速率很快,之后上升速率逐渐减慢,但是前期相关研究表明在3~4 h时该样品的ACE抑制率高于6 h时的数值[10].因此综合考虑实验效率、水解度和抑制率之间的关系,判定碱性蛋白酶的最佳水解时间为4 h.
2.5 不同酶浓度对碱性蛋白酶水解度的影响
在底物质量浓度为40g/L、pH为9.0、温度为50℃、水解时间为4 h的条件下,分别测定酶的质量分数为1.0%、1.5%、2.0%、2.5%、3.0%时的水解度,结果如图5所示.由图5可以看出,碱性蛋白酶质量分数为3.0%时豆粕的水解度最小,酶的质量分数在1.0%~2.5%范围内,水解程度差别不大,酶质量分数为2.5%的水解度要略高于酶质量分数为2.0%的水解度.综合考虑水解产生的抑制肽的活性和酶的使用量,判定碱性蛋白酶的最适质量分数为2.0%.
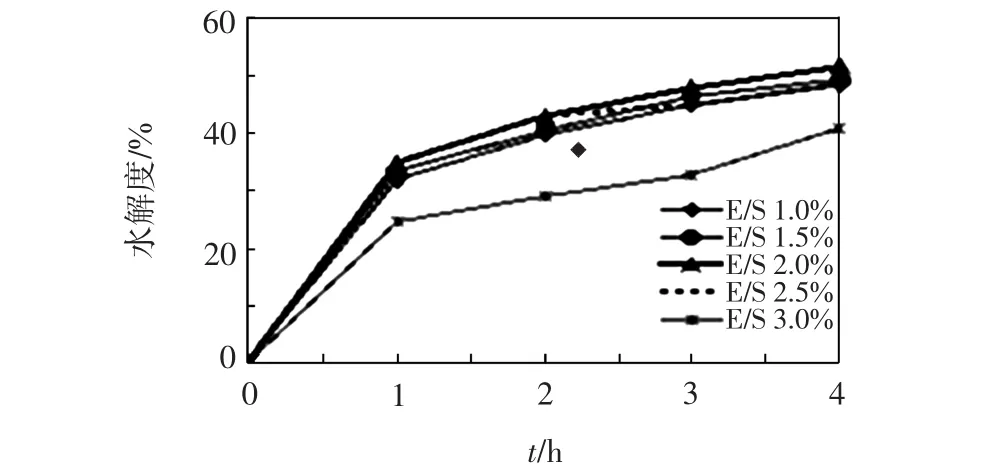
图5 不同酶浓度下碱性蛋白酶的水解度Fig.5 Hydrolysis degree of alkali protease under different enzyme concentrations
2.6 不同底物浓度对碱性蛋白酶水解度的影响
本课题组前期已研究了底物质量浓度为20、40、60 g/L条件下制备的ACE抑制肽的活性,发现底物浓度为20 g/L时抑制率最低,而40 g/L和60 g/L的抑制率差异不显著,因此本研究在40~60 g/L之间设置几个浓度梯度,结合其他因素进行进一步探索,以寻求最适条件.在酶质量分数为2.0%、pH为9.0、温度为50℃、水解时间4 h的条件下,分别测定底物质量浓度为40、45、50、55、60 g/L时的水解度,结果如图6所示.
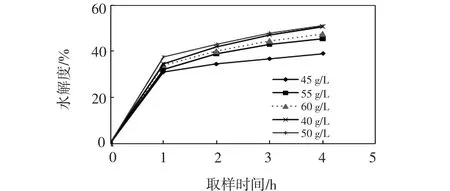
图6 不同底物浓度下碱性蛋白酶水解度的影响Fig.6 Hydrolysis degree of alkali protease under different substrate concentrations
由图6可以看出,在水解的前2 h内,底物质量浓度为50 g/L的水解度明显高于40 g/L的水解度,随着水解时间的延长,二者差别逐渐减弱,在4 h处近乎相等,均高于其他底物浓度的数值.据此判定碱性蛋白酶的最佳底物质量浓度为40 g/L.
2.7 单因素实验所得样品的ACE抑制活性
考察单一因素对碱性蛋白酶水解豆粕产生的ACE抑制肽活性的影响,计算各条件下的抑制率,结果如表1所示.
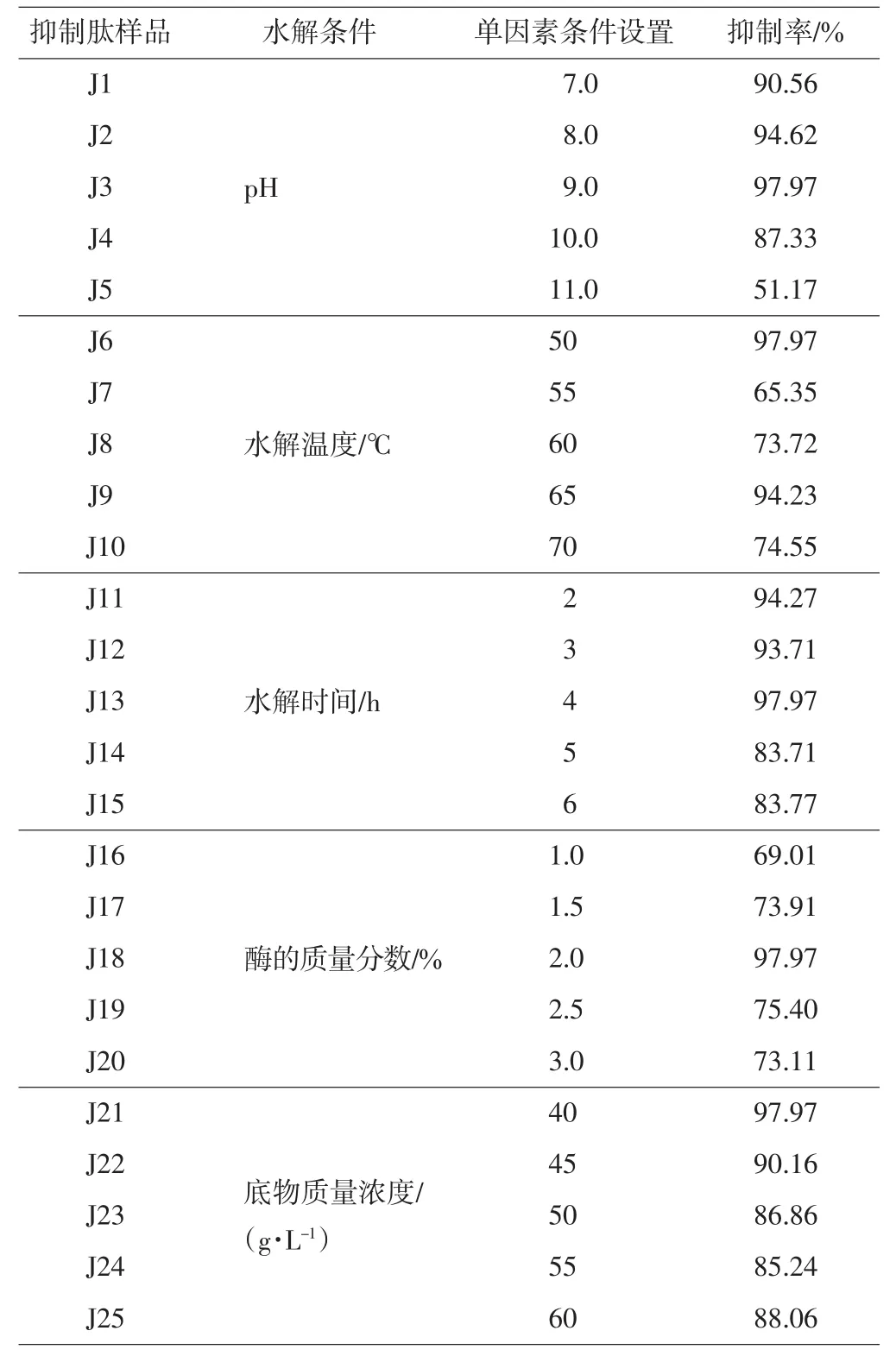
表1 碱性蛋白酶制备的冻干样品抑制肽的ACE活性抑制率Tab.1 ACE inhibition rate of freeze dried samples made by alkali protease
由表1可以看出,本研究在pH为9.0、水解温度为50℃、水解时间为4 h、碱性蛋白酶的质量分数为2.0%、底物质量浓度为40 g/L时,获得的ACE抑制肽的活性最大,抑制率达到97.97%.因此判定此条件为最佳水解条件.
2.8 碱性蛋白酶最适水解条件的多因素实验
在蛋白酶的水解温度和pH均为最适的条件下,考察水解时间、蛋白酶质量分数和底物浓度3个条件对碱性蛋白酶水解豆粕产生ACE抑制肽的影响,结果如表2所示.由表2可以看出,在各组合实验中,水解时间为4 h、蛋白酶质量分数为2.0%、底物质量浓度为40 g/L时,水解产生的ACE抑制肽的抑制率最大,为97.97%,这与单因素实验的结果相同.

表2 多因素实验中制备ACE抑制肽血抑制率Tab.2 ACE inhibition rate in multivariate experiment
3 讨论与结论
本研究以豆粕为底物,考察碱性蛋白酶在不同条件下的水解度和产生的ACE抑制肽的抑制率,并且寻求最优的水解条件.单因素实验和多因素实验结果都显示,本实验确定的最适且稳定的酶解工艺条件为:pH为9.0、水解温度为50℃、水解时间为4 h、蛋白酶质量分数为2.0%、底物质量浓度为40 g/L.在此条件下,豆粕酶解产物ACE的抑制率可提高到97.97%,远远高于本课题组之前研究所得到的抑制率(64.21%)[10].本研究还发现,适当提高pH(由8.0升至9.0)和延长水解时间(由水解3 h升至4 h)的条件下,可使制备的ACE抑制肽活性得到大幅度提高.原因可能是pH的提高抑制了ACE分解因子[12]的活性,推迟了ACE抑制肽活性峰值的出现时间;而且pH为9.0时碱性蛋白酶的活性更高,使ACE抑制肽大量生成,从而大大提高了酶解产物的抑制率.
[1]赵丽杰.浅析大豆蛋白制品的营养及功能作用[J].黑龙江农垦师专学报,1999(1):95-96.ZHAO L J.Analyses of the nutrition and function of soybean protein products[J].Journal of Heilongjiang Nongken Normal College,1999(1):95-96(in Chinese).
[2]吴炜亮,吴国杰,梁道双,等.ACE抑制肽的生理功能和研究进展[J].现代食品科技,2006(3):251-254.WU W L,WUG J,LIANG D S,etal.The physiological function and research progress of Angiotensin-Ⅰ-converting enzyme inhibitory petides[J].Modern Food Science and Technology,2006(3):251-254(in Chinese).
[3]余奕珂,胡建恩,白雪芳,等.源于食品蛋白质的血管紧张素Ⅰ转换酶抑制肽[J].食品与药品,2006,8(4):16-21.YU Y K,HU J E,BAI X F,et al.AngiotensinⅠ-converting enzyme inhibitory peptides derived from food proteins[J].Food and Drug,2006,8(4):16-21(in Chinese).
[4]肖红,段玉峰,刘平,等.食品蛋白降血压肽及其研究进展[J].食品研究与开发,2004(5):3-7.XIAO H,DUAN Y F,LIU P,et al.Antihypertensive peptides derived from food proteins and its research advances[J].Food Research and Development,2004(5):3-7(in Chinese).
[5]黄朝明,孔繁东,祖国仁,等.降血压肽分离的研究现状与展望[J].食品研究与开发,2006(4):161-164.HUANG C M,KONG F D,ZU G R,et al.The present situation and developmental tendency of separation on antihypertensive peptides[J].Food Research and Development,2006(4):161-164(in Chinese).
[6]OKAMOTO A,HARAGATA H,MATSUMOTO E,et al.Angiotensin Ⅰconverting enzyme inhibitory activities of various fermented foods[J].Biosci Biotech Biochem,1995,59(6):1147-1149.
[7]SHIN Z I,YU R,PARK S A,et al.His-His-Leu,an angiotensin I converting enzyme inhibitory peptide derived from Korean soybean,exerts antihypertensive activity in vivo[J].Agric Food Chem,2001,49(6):3004-3009.
[8]张国胜,孔繁东,祖国仁,等.大豆蛋白抗高血压活性肽的研究[J].中国乳品工业,2004,32(8):4-5.ZHANG G S,KONG F D,ZU G R,et al.Active-peptide of anti-hypertensive research in soybean protein[J].China Dairy Industry,2004,32(8):4-5(in Chinese).
[9]张焱,范远景.碱性蛋白酶水解大豆多肽及抑制ACE效果的研究[J].安徽农业科学,2007,35(20):6004-6006.ZHANG Y,FAN Y J.Hydrolysis of soybean polypeptide and inhibitive effect of ACE by alkaline protease[J].Journal of Anhui Agri Sci,2007,35(20):6004-6006(in Chinese).
[10]温雪琴,刘屾,黄弢,等.大豆粕碱性蛋白酶水解肽及ACE抑制活性的研究[J].食品研究与开发,2014,35(9):9-12.WEN X Q,LIU S,HUANG T,et al.ACE inhibitory activity on hydrolytic peptides from soybean meal hydrolyzed by alkaline protease[J].Food Research and Development,2014,35(9):9-12(in Chinese).
[11]ADLER-NISSEN J.Determination of the degree of hydrolysis of food protein hydrolyzates by it roben zenesulfonic acid[J].J Agric Food Chem,1979,27:1256-1262.
[12]MULLALLY M M,MEISEL H,FITZGERALD R J.Identification of a novel angiotensin-I-converting enzyme inhibitory peptide corresponding to a fragment of bovine beta-lactoglobulin[J].International Dairy Journal,1997,402:99-101.
(责任编校 纪翠荣)
Optimization of hydrolysis conditions for the preparation of ACE inhibitory peptides by alkaline protease from soybean meal
TIAN Zhongyuan,WANG Yaping,LIU Shen,REN Yi,FENG Xin,SUN Jianhua
(a.College of Life Sciences,b.Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin Normal University,Tianjin 300387,China)
To get a highly efficient method for the production of angiotensin converting enzyme(ACE)inhibitory peptides,the soybean meal was hydrolyzed by alkaline protease under laboratory conditions.Meanwhile,a series of hydrolytic conditions were optimized by single factor method combined with multi-factors method.The results showed that the proper extension of hydrolytic time and increase of pH can greatly enhance the inhibitory activity of ACE inhibitory peptides.The comprehensive results of single factor method and multi-factors method showed the optimum hydrolysis condition was that:pH was 9.0,hydrolysis temperature was 50℃,hydrolysis time was four hours,enzyme mass fraction was 2.0%,substrate mass concentration was 40 g/L.Under this condition,the inhibition rate of ACE was up to 97.97%.
soybean meal;ACE inhibitory peptides;alkaline protease;hydrolytic condition;optimization
Q556
A
1671-1114(2016)03-0064-05
2015-11-18
国家自然科学基金资助项目(31272019);公益性行业科研专项资助项目(201103018);天津市农业科技成果转化与推广重点资助项目(201002180).
田中原(1990—),男,硕士研究生.
冯 欣(1981—),女,实验师,主要从事微生物应用及发酵工程方面的研究.
