驱动蛋白分子Kif14细胞内中小体定位的研究
2016-09-06朱长军
马 新,姜 伟,,朱长军
(1.中国医学科学院 北京协和医学院肿瘤医院,北京 100021;2.天津师范大学 生命科学学院,天津 300387)
驱动蛋白分子Kif14细胞内中小体定位的研究
马 新1,姜 伟1,2,朱长军2
(1.中国医学科学院 北京协和医学院肿瘤医院,北京 100021;2.天津师范大学 生命科学学院,天津 300387)
为了探讨决定人体驱动蛋白分子Kif14在细胞有丝分裂末期时定位于细胞中小体的功能域,构建了驱动蛋白分子Kif14各功能域的绿色荧光蛋白(GFP)真核细胞表达质粒,分别转染于人体子宫颈癌细胞HeLa中.应用聚丙烯酰氨凝胶电泳和免疫印迹法(WesternBlot)检测各蛋白的表达情况;应用免疫荧光染色法(immunofluorescence)分别对微管蛋白(Tubulin)、着丝粒相关蛋白(CREST)和DNA染色,荧光显微镜下观察各绿色荧光融合蛋白在有丝分裂末期的亚细胞定位.结果发现,细胞有丝分裂末期,驱动蛋白分子Kif14的N末端GFP融合蛋白定位于中小体(midbody),马达区GFP融合蛋白沿微管分布,杆状尾区GFP融合蛋白以点状分布于细胞质,尾区GFP融合蛋白分布于整个细胞中.由此认为,Kif14驱动蛋白分子的N末端延伸区决定该蛋白分子在细胞有丝分裂末期定位于中小体.
驱动蛋白;Kif14;有丝分裂末期;中小体
驱动蛋白超家族是一类具有ATP水解酶活性、以微管为轨道定向运动的马达蛋白[1-2],它们参与调控细胞的基本生命活动过程.驱动蛋白分子Kif14(kinesin family member 14)属于Kinesin-3亚家族[3],它对于机体顺利完成细胞有丝分裂、维持基因组稳定性以及细胞内物质运输具有重要作用[4].在细胞有丝分裂末期,Kif14对于顺利形成中小体以及最后的细胞分裂至关重要,应用siRNA干涉Kif14时,细胞不能形成完整中小体,并且无法对细胞进行最后切割,最终会形成多核细胞[5-6].了解驱动蛋白分子Kif14各功能域在细胞有丝分裂末期的具体作用,将有助于阐明细胞有丝分裂末期的切割机制,但首先要明确Kif14各结构域在细胞有丝分裂末期的定位.
本研究通过构建Kif14不同功能域的绿色荧光蛋白真核细胞表达质粒,转染真核细胞后观察各功能域在细胞有丝分裂末期的绿色荧光融合蛋白的定位,探讨决定Kif14在细胞有丝分裂末期定位的功能域.
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
pEGFPC1真核表达载体、pEGFPC1-Kif14真核表达质粒为本实验室自存;大肠杆菌感受态细胞TOP10购自北京全式金生物技术有限公司;人子宫颈癌细胞HeLa为本实验室保存细胞株.
1.1.2 主要试剂
高保真PCR Taq酶(日本东洋纺公司);限制性内切酶SalⅠ、BamHⅠ以及转染试剂Turbofect(美国Fermentas公司);细胞完全培养基DMEM、胎牛血清和胰蛋白酶(美国Hyclone公司);鼠抗Tubulin抗体、CREST、FITC或Texas Red标记的羊抗二抗和4′,6-二脒基-2-苯基吲哚(DAPI,美国Invitrogen公司);T4 DNA连接酶和DNA Marker(大连宝生物公司);凝胶回收试剂盒和质粒小提试剂盒(北京康为世纪生物科技有限公司);其他化学试剂为进口或国产分析纯.DNA序列测定和引物合成均由苏州金唯智生物科技有限公司完成.
1.1.3 主要仪器
Mycycler普通PCR仪、miniPROTEAN tera system小型蛋白电泳仪(美国Bio-rad公司);ECLIPSE TS100倒置荧光显微镜(日本Nikon公司).
1.2 方法
1.2.1 Kif14各功能域绿色荧光蛋白表达质粒的构建
设计Kif14各功能域的上下游引物,如表1所示.以pEGFPC1-Kif14质粒为模板,分别扩增各功能域核酸序列,经过凝胶回收后,用限制性内切酶SalⅠ和BamHⅠ双酶切后再次回收.回收产物与已被限制性内切酶SalⅠ和BamHⅠ双酶切后的载体pEGFPC1以适当比例用T4 DNA连接酶室温连接4 h,将全部连接产物转化TOP10感受态细胞,筛选阳性克隆,小量提取质粒后进行双酶切鉴定.将初步鉴定正确的质粒送苏州金唯智生物科技有限公司测序.
1.2.2 细胞培养与质粒转染
将人体子宫颈癌细胞HeLa接种于24孔板,每孔接种40 000个细胞,每孔含有体积分数为10%的胎牛血清DMEM培养基500 μL,置于37℃、CO2体积分数为5%的细胞培养箱中培养,待细胞贴壁或爬片后进行质粒转染.使用Turbofect作为转染试剂,分别转染100 ng已构建好的Kif14各功能域质粒,对照组转染等剂量的pEGFPC1空载体,继续培养24 h后,在荧光显微镜下观察是否表达绿色荧光蛋白.

表1 Kif14各功能域上下游引物Tab.1 Upstream and downstream primers of each functional domain in Kif14
1.2.3 Western Blot检测蛋白表达
在24孔板中,各质粒转染24 h后,刮取细胞,用含有质量分数为2%的SDS buffer(SDS质量分数为2%,甘油体积分数为10%,Tris-Cl浓度为50 mmol/L,pH为6.8,β-巯基乙醇体积分数为1%,溴酚蓝质量分数为0.004%)裂解细胞,得到全细胞裂解液.取20 μL上样进行聚丙烯酰胺凝胶电泳,聚丙烯酰胺质量分数为12.5%,恒定电流为35 mA,分离蛋白质1 h之后转膜至PVDF膜,用质量浓度为50 mg/mL的脱脂奶粉(TBS浴)封闭30 min后,以兔抗GFP为一抗室温孵育2 h,以偶联了辣根过氧化物酶的羊抗兔抗体为二抗室温孵育1 h,用增强化学发光剂(ECL)反应2 min,暗室内显影.
1.2.4 细胞免疫荧光染色
在24孔板中,爬片细胞经转染24 h后,在荧光显微镜下观察,细胞表达绿色荧光的比率超过60%即可进行免疫荧光染色.取出爬片后用PBS洗3次,每次5 min,采用福尔马林固定液(含有体积分数为3%的甲醛、质量分数为2%的蔗糖的PBS缓冲液)固定15 min,PBS洗3次,每次5 min,甘氨酸终止5 min.用体积分数为10%的山羊血清(山羊血清体积分数为10%、TritonX-100质量分数为0.4%的PBS缓冲液)封闭30 min,用质量分数1%的PBS-TX洗3次,每次5 min.加入鼠抗Tubulin抗体和CREST室温孵育4 h,用质量分数为1%的PBS-TX洗3次,每次5 min.加入Texas Red标记的羊抗鼠二抗和羊抗兔二抗避光孵育2 h后加入DAPI,室温避光3 min.用质量分数为1% 的PBS-TX洗3次,每次5 min,加入抗淬灭剂后封片.
2 结果
2.1 Kif14各功能域绿色荧光蛋白表达质粒的构建
Kif14的结构模式图和已构建各功能域的模式图如图1(a)所示.构建的GFP重组表达质粒pEGFPKif14N356、pEGFP-Kif14Motor、pEGFP-Kif14C940和pEGFP-Kif14C416分别用限制性内切酶 SalⅠ和BamHⅠ进行双酶切鉴定.琼脂糖凝胶电泳分析结果表明,Kif14各功能域目的片段均已成功插入载体中,如图1(b)所示.测序后,经与NCBI公布序列比对,DNA序列信息完全相同,读码框正确,证明已成功构建了各功能域重组质粒.
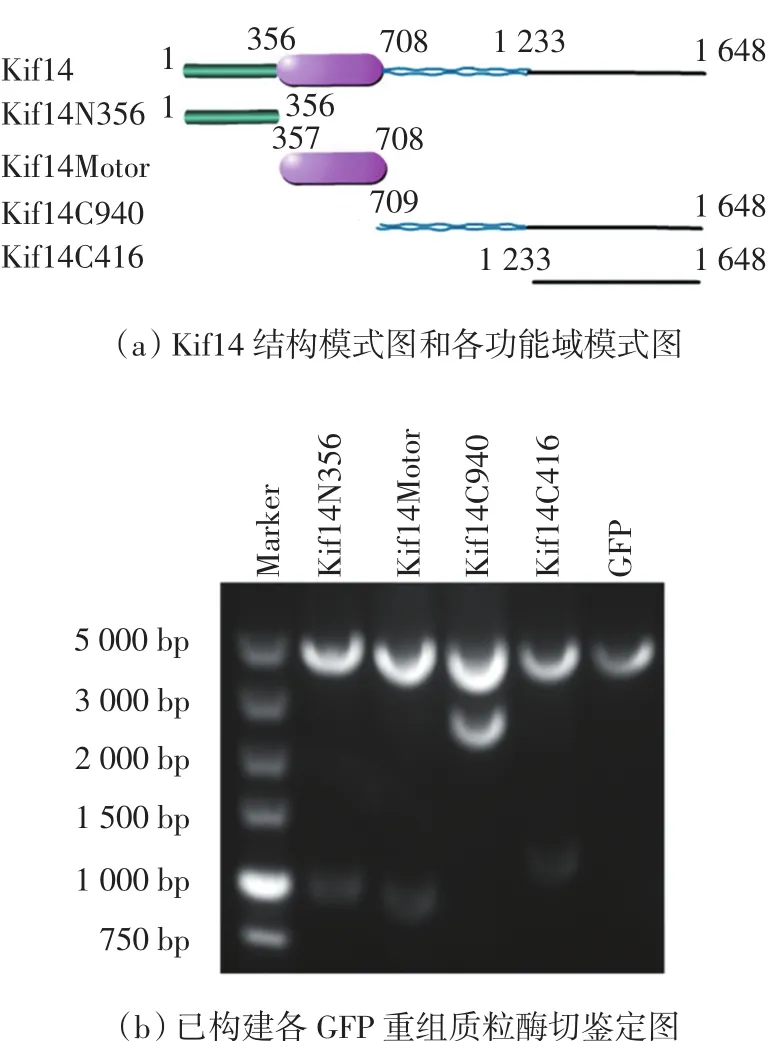
图1 Kif14各功能域绿色荧光蛋白表达质粒的构建Fig.1 Construction of GFP-expressing plasmids of Kif14 domains
2.2 Kif14各功能域绿色荧光蛋白的表达及在细胞有丝分裂末期的细胞内定位
将构建成功的Kif14各功能域绿色荧光蛋白表达质粒分别转染至HeLa细胞中,获得全细胞裂解液,进行Western Blot检测,结果如图2所示.由图2可知,各个融合蛋白均有表达,且蛋白相对分子质量与理论值相符.应用免疫荧光对已转染的各重组质粒细胞进行染色,荧光显微镜下观察各功能域的细胞内定位,结果如图3所示.在细胞有丝分裂末期,Kif14的N末端延伸区集中定位于中小体上,马达区绿色荧光沿微管分布,杆状尾区绿色荧光以点状分布于细胞质内,尾区绿色荧光分布于整个细胞中.

图2 Kif14各功能域绿色荧光融合蛋白的表达Fig.2 Expression of GFP fusion protein of Kif14 domains
3 讨论
Kif14基因位于人染色体1q32.1上,该基因编码1648个氨基酸,蛋白分子质量约为1.865×105(186.5kDa),1994年由Nomura等[7]从骨髓细胞cDNA文库中首次克隆.Kif14蛋白最先被发现参与调控细胞有丝分裂过程中姐妹染色体的整列[8],随后研究发现Kif14在胞质分裂过程中也起重要作用[5-6,9].应用RNAi敲降Kif14发现,敲降效率达到80%以上时,细胞明显出现多倍性.缺失Kif14细胞不能有效完成胞质分裂后期事件,破坏细胞周期进程,最终引起胞质分裂失败,呈现双核或多核细胞[1].免疫荧光研究发现,Kif14在间期定位于细胞质中,有丝分裂前中期至中期阶段,部分Kif14弥散于细胞质中,部分定位于纺锤体两极和纺锤体上;进入后期,Kif14集中定位于纺锤体中央区和分裂沟上,随着有丝分裂进入末期,大量Kif14定位于中小体上[1,5,10].Citron kinase是一种能与RhoA蛋白分子相互作用的蛋白激酶[11],在有丝分裂后期定位于分裂沟上,末期定位于中小体上,参与调节胞质分裂[12-14].免疫荧光实验发现,Kif14和Citron kinase在有丝分裂后期共定位于分裂沟上,末期共定位于中小体上[10].Kif14和Citron kinase之间的相互作用使Citron kinase能够及时从分裂沟转移到中小体,而Kif14由分裂沟向中小体的聚集和保持也依赖Citron kinase[6].RNAi无论干涉Kif14还是Citronkinase,细胞都不能对不完整的中小体进行最后切割,最终形成多核细胞.然而,Kif14在最后的中小体切割过程中的具体作用和机制还不明确,因此,研究确定Kif14在有丝分裂末期定位的功能域对阐明最后的中小体切割机制至关重要.
本研究通过构建Kif14不同功能域的真核表达质粒,转染Hela细胞,发现细胞有丝分裂末期,驱动蛋白分子Kif14的N末端延伸区绿色荧光定位于中小体,马达区绿色荧光沿微管分布,杆状尾区绿色荧光以点状分布于细胞质,尾区绿色荧光分布于整个细胞中.实验表明:外源蛋白只要含有Kif14的N末端延伸结构域,就可以在有丝分裂末期定位于中小体上;相反,其他功能域蛋白不含有Kif14的N末端延伸结构域,就不能在有丝分裂末期定位于中小体上.因此,本研究认为决定Kif14在有丝分裂末期定位于中小体的功能域是N末端延伸结构域.
临床研究显示,Kif14在多种肿瘤中存在基因扩增和高表达现象[2,15-17],并且与肿瘤的病理分级、预后密切相关,这表明Kif14可作为多种肿瘤发生发展的标志物[18-21].研究Kif14的分子功能机制将对寻找新的药物靶点、有效治疗恶性肿瘤提供新的思路.
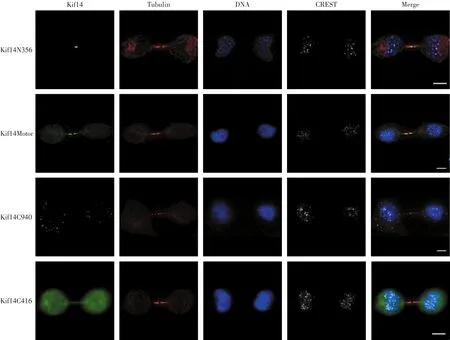
图3 细胞有丝分裂末期Kif14各功能域的定位Fig.3 Localization of Kif14 domains in telophase cells
[1]CARLETON M,MAO M,BIERY M,et al.RNA interference-mediated silencing of mitotic kinesin KIF14 disrupts cell cycle progression and induces cytokinesis failure[J].Molecular and Cellular Biology,2006,26(10):3853-3863.
[2]ARORA K,TALJE L,ASENJO A B,et al.KIF14 binds tightly to microtubules and adopts a rigor-like conformation[J].Journal of Molecular Biology,2014,426(17):2997-3016.
[3]LAWRENCE C J,DAWE R K,CHRISTIE K R,et al.A standardized kinesin nomenclature[J].The Journal of Cell Biology,2004,167(1):19-22.
[4]NAKAGAWA T,TANAKA Y,MATSUOKA E,et al.Identification and classification of 16 new kinesin superfamily(KIF)proteins in mouse genome[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(18):9654-9659.
[5]GRUNEBERG U,NEEF R,LI X,et al.KIF14 and citron kinase act together to promote efficient cytokinesis[J].The Journal of Cell Biology,2006,172(3):363-372.
[6]WATANABE S,DE ZAN T,ISHIZAKI T,et al.Citron kinase mediates transition from constriction to abscission through its coiled-coil domain [J].Journal of Cell Science,2013,126(8):1773-1784.
[7]NOMURA N,NAGASE T,MIYAJIMA N,et al.Prediction of the coding sequences of unidentified human genes.Ⅱ.The coding sequences of 40 new genes(KIAA0041-KIAA0080)deduced by analysis of cDNA clones from human cell line KG-1[J].DNA Res,1994,1(5):223-229.
[8]ZHU C,ZHAO J,BIBIKOVA M,et al.Functional analysis of humanmicrotubule-based motor proteins,the kinesins and dyneins,in mitosis/cytokinesis using RNA interference[J].Molecular Biology of the Cell,2005,16(7):3187-3199.
[9]SAMWER M,DEHNE H J,SPIRA F,et al.The nuclear F-actin interactome of Xenopus oocytes reveals an actin-bundling kinesin that is essential for meiotic cytokinesis[J].The EMBO Journal,2013,32(13):1886-1902
[10]BASSI Z I,AUDUSSEAU M,RIPARBELLI M G,et al.Citron kinase controls a molecular network required for midbody formation in cytokinesis[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(24):9782-9787.
[11]MADAULE P,FURUYASHIKI T,REID T,et al.A novel partner for the GTP-bound forms of rho and rac[J].FEBS Letters,1995,377(2):243-248.
[12]MADAULE P,FURUYASHIKI T,EDA M,et al.Citron,a Rho target that affects contractility during cytokinesis[J].Microscopy Research and Technique,2000,49(2):123-126.
[13]EDA M,YONEMURA S,KATO T,et al.Rho-dependent transfer of citron-kinase to the cleavage furrow of dividing cells[J].Journal of Cell Science,2001,114(18):3273-3284.
[14]SARKISIAN M R,LIW W,DI CUNTO F,et al.Citron-kinase,a protein essential to cytokinesis in neuronal progenitors,is deleted in the flathead mutant rat[J].The Journal of Neuroscience:the Official Journal of the Society for Neuroscience,2002,22(8):217-221.
[15]CORSON T W,HUANG A,TSAO M S,et al.KIF14 is a candidate oncogene in the 1q minimal region of genomic gain in multiple cancers [J].Oncogene,2005,24(30):4741-4753.
[16]BOWLES E,CORSON T W,BAYANI J,et al.Profiling genomic copy number changes in retinoblastoma beyond loss of RB1[J].Genes,Chromosomes&Cancer,2007,46(2):118-129.
[17]CLEATOR S,HELLER W,COOMBES R C.Triple-negative breast cancer:therapeutic options[J].The Lancet Oncology,2007,8(3):235-244.
[18]CORSON T W,GALLIE B L.KIF14 m RNA expression is a predictor of grade and outcome in breast cancer[J].International Journal of Cancer,2006,119(5):1088-1094.
[19]MADHAVAN J,CORAL K,MALLIKARJUNA K,et al.High expression of KIF14 in retinoblastoma:association with older age at diagnosis [J].Investigative Ophthalmology&Visual Science,2007,48(11):4901-4906.
[20]BASAVARAJAPPA H D,CORSON T W.KIF14 as an oncogene in retinoblastoma:atarget for novel therapeutics?[J].Future Medicinal Chemistry,2012,4(17):2149-2152.
[21]THERIAULT B L,PAJOVIC S,BERNARDINI M Q,et al.Kinesin family member 14:an independent prognostic marker and potential therapeutic target for ovarian cancer[J].International Journal of Cancer,2012,130(8):1844-1854.
(责任编校 纪翠荣)
Study on intracellular midbody localization of kinesin moter protein Kif14
MA Xin1,JIANG Wei1,2,ZHU Changjun2
(1.Cancer Hospital Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China;2.College of Life Sciences,Tianjin Normal University,Tianjin 300387,China)
To study the domain of Kif14 that determines its midbody localization in telophase in eukaryotic cells,the green fluorescent protein(GFP)expression plasmids for different Kif14 domains were constructed and transfected into HeLa cells respectively.The expression of GFP-fused proteins were detected by Western Blot and the localization of these proteins was detected by immunofluorescence staining.The results showed that the GFP-fused N-terminal extension domain of Kif14 locates in midbody in telophase,GFP-fused motor domain distributes along the microtubule,GFP-fused stock and tail domain appears dots distribution in cytoplasm,and GFP-fused tail region distributes throughout the cell.In conclusion,N-terminal extension of Kif14 determines its localization in midbody in telophase.
kinesin;Kif14;telophase;midbody
Q966
A
1671-1114(2016)03-0054-05
2016-01-08
国家自然科学基金面上资助项目(31271485);2011年教育部“新世纪优秀人才支持计划”资助项目(NCET-11-1066);天津市应用基础与前沿技术研究计划一般资助项目(14JCYBJC24200);天津市科技型中小企业技术创新资金资助项目(14ZXCXSY00121).
马 新(1990—),女,硕士研究生.
朱长军(1974—),男,教授,主要从事细胞有丝分裂调控机制以及细胞骨架功能方面的研究.
