MRI引导下兔肝血管旁VX2肿瘤射频消融的实验研究
2016-09-06陈一平林征宇宋倩倩陈仲武林清锋
陈一平,林征宇,宋倩倩,陈 锦,陈仲武,林清锋
(福建医科大学附属第一医院介入科,福建福州 350005)
MRI引导下兔肝血管旁VX2肿瘤射频消融的实验研究
陈一平,林征宇*,宋倩倩,陈锦,陈仲武,林清锋
(福建医科大学附属第一医院介入科,福建福州350005)
目的探讨MRI引导下射频消融(RFA)治疗较大血管旁兔肝VX2肿瘤的疗效。方法选取11只新西兰大白兔,在MRI引导下将VX2肿瘤种植在兔肝大血管(直径≥3 mm)旁。2~3周后行MR扫描,随机处死1只实验兔,行病理证实。剩余10只肿瘤兔行MRI引导下RFA,术后MR扫描后即刻处死实验兔行病理学检查。结果11只实验兔肝脏VX2肿瘤均种植成功,肿瘤平均直径(1.35±0.22)cm。3D-vibe上肿瘤呈稍低信号,FS-TSE T2WI上呈稍高信号。10只肿瘤兔均成功接受RFA,消融灶在T2WI上呈等低信号;3D-vibe上呈同心圆状改变;大体病理上RFA凝固坏死区最大径为(2.16±0.50)cm,3D-vibe上高信号消融灶最大径为(2.27±0.66)cm,FS-TSE T2WI上低信号消融灶最大径为(2.25± 0.58)cm,三者比较差异均无统计学意义。血管旁部分不完全消融的2个病灶,在3D-vibe显示为高信号环未完全包绕低信号瘤灶。结论MRI引导下RFA治疗兔肝VX2肿瘤是一种有效、可行的治疗方法。
磁共振成像;血管;射频消融术;肝脏;兔
位于较大血管旁的肝肿瘤在进行射频消融时,由于血流热沉效应容易造成消融不完全,肿瘤组织残留[1]。本研究建立了兔肝VX2肿瘤模型并在MR引导下对其进行射频消融术,现报道如下。
1 材料与方法
1.1实验动物新西兰大白兔13只,均为雄性,体质量>2.0 kg,由上海市松江区松联实验动物场提供[许可证号:SCXK(沪)2012-0011]。瘤株类型为VX2鳞状细胞癌。
1.2仪器与方法
1.2.1仪器与参数采用Siemens Espree 1.5T MR扫描仪,环形表面线圈(直径10 cm),MRI兼容射频针(17 G、20 cm,RITA),射频发生器(1500X,RITA),MR兼容穿刺针(14G、10 cm,Daum),凝胶海绵,剪刀,镊子等。采用三维容积式内插法屏气检查(3D-volumetric interpolated breath-hold examination,3D-vibe)序列成像,脂肪抑制快速自旋回波T2加权成像(fat suppression turbo spin-echo T2-weighted imaging,FS-TSE T2WI)及DWI进行轴位扫描。3D-vibe序列:TE 2.39 ms,TR 5.04 ms,FA 12o,FOV 19.9 cm×27.5 cm,层厚3 mm;FS-TSE T2WI:TE 76 ms,TR 4 000 ms,FA 90o,FOV 18 cm×18 cm,层厚3.5 mm;DWI:TE 94 ms,TR 4 900 ms,FOV 19.9 cm×27.5 cm,层厚3 mm,b值取50、800 s/mm2。
1.2.2方法取2只实验兔,采用氯胺酮(1 ml/kg体质量)和氯丙嗪(0.5 ml/kg体质量)进行全麻,将VX2瘤株接种于兔双侧后腿外侧肌肉组织,使之成瘤,约2~3周后,切取肿瘤边缘生长旺盛的鱼肉样VX2瘤组织,并剪成约1 mm×1 mm×1 mm瘤块。余11只实验兔以上述方法全麻后仰卧位保定于MRI扫描床上,常规将表面线圈置于剑突下穿刺部位。在MR图像上选定肝左叶直径>3 mm的一条血管旁为接种部位。常规消毒铺巾,采用14G MR兼容穿刺针沿设定的角度进行穿刺,术中多次重复行3D-vibe扫描以确定穿刺针方向,到达目标位置后拔出针芯,将3~4个瘤块推入肝内,随后推入明胶海绵以封堵肝内针道,快速拔针。术后连续3天肌注40万U青霉素,预防感染。所有实验兔在种植2~3周后行肝脏MR检查,确定实验兔肿瘤生长至1~2 cm后,随机处死1只实验兔行病理学检查证实,余10只接受射频消融(radio-frequency ablation,RFA)治疗。
采用上述扫描序列及穿刺方法,以14G MR兼容穿刺针在MR引导下穿刺肝组织达到肿瘤边缘后拔出针芯,将17G射频电极经穿刺针鞘穿透肿瘤组织。设定功率35 W,靶温103℃,消融时间9 min。消融过程中如实验兔躁动,则以半量氯胺酮及氯丙嗪维持麻醉。完成消融后,行常规MR平扫,评估治疗效果。消融灶完全覆盖原病灶,且超出病灶边缘0.5~1.0 cm为完全消融;如病灶残留,则需补充消融,消融后撤回电极针。
消融完成后,在3D-vibe及FS-TSE T2WI上测量消融灶最大径。之后立即处死实验兔,取出肝脏组织,观察RFA区的大体形态,测量凝固性坏死区最大径;然后以10%甲醛溶液固定72 h、常规石蜡包埋、切片和苏木素-伊红染色,行病理检查。
1.3统计学分析采用SPSS 19.0统计分析软件。计量资料以±s表示,数据的比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
11只实验兔VX2肿瘤均种植成功,未出现大出血、肝撕裂等并发症。瘤灶紧邻血管壁,大小0.95~1.62 cm,平均(1.35±0.22)cm。10只实验兔均成功接受RFA,未出现麻醉意外及术中死亡,其中2只实验兔的消融灶边缘靠近大血管旁出现VX2肿瘤组织残留,余下8个瘤灶消融完全,未发现肿瘤细胞残留。2.1MRI表现RFA前,肿瘤灶在3D-vibe上呈稍低信号,部分瘤灶中心液化坏死,呈更低信号;FS-TSE T2WI呈稍高信号,部分瘤灶中央为更高信号,邻近的血管呈流空信号影;DWI上瘤灶呈高信号,ADC上呈低信号(图1)。
RFA后,完全消融MRI表现:消融灶在T2WI上呈等低信号;3D-vibe上呈同心圆状改变,中央区原病灶仍呈低信号,周边呈明显环状高信号,边界清晰;DWI上呈等、稍高信号,ADC图上呈等高信号(图2)。不完全消融MRI表现:3D-vibe上消融灶高信号环未完全包绕低信号瘤灶,在病灶邻近血管处形成缺口(图3)。
2.2组织病理学检查RFA前,瘤灶呈圆形,色灰白,质地韧,边界清楚,无明显包膜组织,切面呈鱼肉样,瘤灶中央有液化性坏死呈奶酪样;低倍镜下VX2肿瘤呈浸润性癌巢排列,与正常肝实质无明显分界,间质边界不清,癌巢边缘可见初浸润的肝索结构,新生毛细血管丰富;高倍镜下可见肿瘤细胞分散排列,呈圆形、梭形或不规则形,细胞体积较大,胞浆较少,核大、深染,细胞排列紊乱,有少量纤维间隔,可见实体样或假腺体样结构,细胞间质少,呈浸润性生长,周围无包膜,可见新生毛细血管。
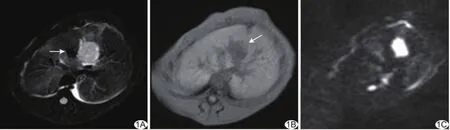
图1 兔肝VX2肿瘤位于血管旁,在FS-TSE T2WI上呈高信号,血管呈流空信号(A,箭);瘤灶在3D-vibe序列呈低信号(B,箭)、在DWI上呈高信号(C)

图2 兔肝VX2肿瘤完全消融MRI表现 A.在T2WI上消融灶呈低信号(箭);B.3D-vibe上消融灶呈同心圆状改变,中央区原病灶仍呈低信号,周边呈明显环状高信号(箭);C.DWI上消融灶呈等低信号
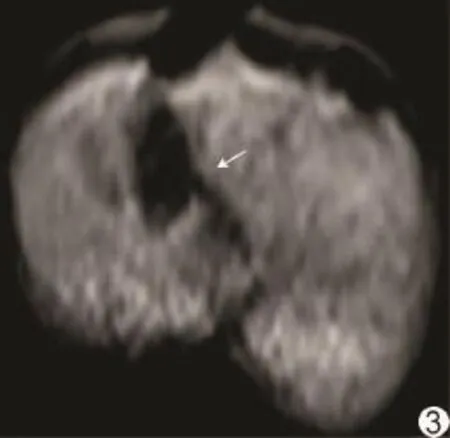
图3 兔肝VX2肿瘤不完全消融MRI表现3D-vibe上血管旁消融灶高信号环未完全包绕低信号瘤灶,可见一流空血管影沿高信号环缺口穿入病灶(箭)
RFA术后,即刻消融区肿块呈灰白色的坏死组织块,消融区外缘不清,周围肝组织淤血;镜下见完全消融后消融区由中心至外周分别为肿瘤细胞凝固性坏死区、肝实质凝固性坏死区、炎性细胞带,最外围可见水肿区肝细胞。凝固性坏死区可见大片状不定形坏死的VX2肿瘤细胞及肝实质细胞,核固缩、深染,周边可见炎性反应带,其内可见较多中性粒细胞、红细胞以及淋巴细胞聚集;水肿区肝细胞呈气球样变,外周肝窦充血扩张,未见明显炎细胞浸润;肝实质凝固性坏死区、炎症反应带、水肿区及正常肝实质区呈过渡性改变,邻近大血管扩张、充血(图4)。肿瘤残留区可见残存的癌组织,肿瘤细胞皱缩,细胞核缩小(图5)。
2.3消融灶的测量在大体标本上测得RFA凝固坏死区最大径(DR)为1.52~2.71 cm,平均(2.16± 0.50)cm,3D-vibe上高信号消融灶最大径(DT1)为1.54~2.96 cm,平均(2.27±0.66)cm,FS-TSE T2WI上低信号消融灶最大径(DT2)为1.58~2.89 cm,平均(2.25±0.58)cm,DR与DT1、DT2比较差异均无统计学意义(t=1.219、0.748,P均>0.05),DT1与DT2比较差异无统计学意义(t=0.354,P>0.05)。
3 讨论
3.1热沉效应RFA是治疗早期肝脏恶性肿瘤的有效手段,但由于热沉效应,较大血管旁的肿瘤灶不易被彻底消融。Lu等[2]消融了15个邻近较大血管(直径≥3 mm)的肝癌病灶,平均7.5个月后行肝移植,术后病理检查证实8个病灶复发或残留;而消融了32个非邻近大血管的病灶,仅4个病灶复发。Lu等[1]对10只活体猪行肝脏RFA实验以评估热沉效应,在直径3 ~5 mm血管周围50%(12/24)存在活组织残留,直径>5 mm血管周围100%(7/7)存在活组织残留,而直径<3 mm血管周围仅有11.7%(13/111)存在热沉效应。本研究中10只瘤兔消融灶均位于较大血管旁,2个消融灶经组织病理证实有肿瘤残留,因此热沉效应是致肝脏肿瘤RFA后肿瘤残留的重要原因。因严重热损伤及组织水肿,残留病灶在CEUS、CT和MRI增强扫描也无异常强化,仅在T1WI上显示高信号环在邻近血管处有缺损[3]。本研究2个血管旁残留病灶均显示肿瘤细胞皱缩、细胞核缩小,出现明显热损伤现象,3D-vibe上显示在邻近血管处高信号环有缺损。本实验过程中,在大血管旁高信号环缺损处多次行补充消融,局部肿瘤残留率明显降低,但仍不能达到所有病灶均完全消融的结果。因此,肝脏血管旁肿瘤除了RFA外,有时需联合其他治疗手段。Lin等[4]对肝细胞癌行RFA后,在瘤灶邻近大血管处植入125I放射性粒子进行治疗,取得较好疗效。

图4 兔肝VX2肿瘤消融后病理图(HE,×10) 消融区由中心至外周分别为肿瘤细胞凝固性坏死区(A1)、肝实质凝固性坏死区(A2)、炎性细胞带(A3),最外围可见水肿区肝细胞

图5 兔肝VX2肿瘤消融后残留病灶的病理图 血管旁可见残存的癌组织(A,箭,HE,× 10)、肿瘤细胞皱缩,细胞核缩小(B,箭,HE,×40)
3.2引导设备引导RFA的影像学设备有超声、CT 和MRI。CT对金属电极显示清楚,但仅能行轴位扫描,有时不能显示射频针全长;CT平扫对病灶显示能力差、金属伪影易遮盖病灶、术后消融区边界显示不清及存在X线辐射等缺陷。超声操作简便、价格低廉,能够实时引导射频针穿刺;但易受气体、骨骼伪影等因素干扰,对某些小病灶及特定区域(如膈顶)的病灶有时显示不清;金属电极显示欠佳;消融时因高温产生气泡导致高回声,易夸大消融范围。MR组织分辨率高,能够显示CT与超声难以显示的病灶,可多方位成像,方便非轴位穿刺;由于存在流空效应,无需注射对比剂即可清晰显示血管,还可显示消融灶。Sironi等[5]认为,MR平扫是评估小肝癌RFA疗效的有效方法。MR平扫显示消融灶在T1WI上呈高信号,T2WI上呈低信号,边缘清晰,与RFA前瘤灶呈长T1、长T2信号形成鲜明对比。本研究MR图像上消融灶与大体病理上的消融区范围一致。消融灶在TlWI上呈高信号,可能与消融灶区蛋白浓缩及灶内出血有关,在T2WI上呈低信号,可能与病灶组织热损伤后的脱水效应有关。Khankan等[6]认为T1WI平扫可以准确显示消融灶的范围。本研究3D-vibe显示消融灶的范围是由中央低信号区和周边环状高信号区构成。本组2只瘤兔RFA后发现VX2肿瘤残留,回顾性分析其RFA后即刻MR平扫结果,3D-vibe上消融灶靠近血管旁仍为低信号,未形成明显高信号环,虽予补充消融,仍未达完全消融。VX2肿瘤与肝内原发肿瘤发生机制不同,且VX2肿瘤更易坏死,但不影响消融时血管热沉效应的研究。
本研究的局限性:①仅研究肝内较小肿瘤的消融,未研究较大(3~5 cm)的瘤灶;②大体病理上消融灶的测量不完全准确;且研究的是消融后的急性损伤,并未研究消融后亚急性及慢性损伤所致的组织学改变;③MRI可无创监测组织温度变化[7],但本研究MRI设备上未配备相关软件,且因射频发生器与MRI射频场互相干扰,在停止消融时才能扫描,无法实时术中扫描监控消融全过程,只能采用经验性消融条件。
综上所述,MRI引导下RFA治疗肝脏恶性肿瘤,在病灶显示、术后即时疗效评估、发现热沉效应所致较大血管旁的亚临床残留灶方面有独特的优势;MRI是引导小肝癌RFA治疗有效的影像学手段。
[1] Lu DS,Raman SS,Vodopich DJ,et al.Effect of vessel size on creation of hepatic radiofrequency lesions in pigs:Assessment of the"heat sink"effect.AJR Am J Roentgenol,2002,178(1):47-51.
[2] Lu DS,Raman SS,Limanond P,et al.Influence of large peritumoral vessels on outcome of radiofrequency ablation of liver tumors.J Vasc Interv Radiol,2003,14(10):1267-1274.
[3] 陈锦,陈群林,林征宇,等.射频消融治疗肝脏恶性肿瘤急性热损伤的MRI表现及疗效判定.中国介入影像与治疗学,2013,10 (12):713-716.
[4] Lin ZY,Chen J,Deng XF.Treatment of hepatocellular carcinoma adjacent to large blood vessels using 1.5T MRI-guided percutaneous radiofrequency ablation combined with iodine-125 radioactive seed implantation.Eur J Radiol,2012,81(11):3079-3083.
[5] Sironi S,Livraghi T,Meloni F,et al.Small hepatocellular carcinoma treated with percutaneous RF ablation:MR imaging follow-up.AJR Am J Roentgenol,1999,173(5):1225-1229.
[6] Khankan AA,Murakami T,Onishi HA,et al.Hepatocellular carcinoma treated with Radio frequency ablation:An early evaluation with magnetic resonance imaging.J Magn Reson Imaging,2008,27(3):546-551.
[7] Stollberger R,Ascher PW,Huber D,et al.Temperature monitoring of interstitial thermal tissue coagulation using MR phase images.J Magn Reson Imaging,1998,8(1):188-196.
Experimental study on MRI-guided radiofrequency ablation in treatment of VX2 tumor adjacent to blood vessels in rabbit liver
CHEN Yiping,LIN Zhengyu*,SONG Qianqian,CHEN Jin,CHEN Zhongwu,LIN Qingfeng
(Department of Interventional Radiology,the First Affilliated Hospital of Fujian Medical University,Fuzhou 350005,China)
ObjectiveTo explore the curative effect of MRI-guided radiofrequency ablation(RFA)in treatment of VX2 tumor adjacent to major blood vessels in rabbit liver.MethodsUnder the guidance of MRI,the VX2 tumor was implanted near the large blood vessel(diameter≥3 mm)in 11 New Zealand rabbits liver.MRI was performed 2—3 weeks after the implantation and 1 rabbit was executed radomly for pathological confirmation.The remaining 10 rabbits received MRI-guided RFA.The rabbits were sacrificed immediately after post-operative MR scan and pathological examination was carried out.ResultsAll of the VX2 liver tumor of rabbits were established successfully,the average diameter of tumors was(1.35±0.22)cm.The VX2 tumor demonstrated slightly hypointensity on 3D-vibe and hyperintensity on T2WI.All of the VX2 liver tumor of 10 rabbits were underwent RFA successfully.The ablated lesion showed a low-intensity signal on T2WI and a concentric pattern on 3D-vibe.The mean maximal diameter of coagulated zone(DR)was(2.16±0.50)cm on gross pathology,the mean maximal diameter of high signal ablated zone (DT1)was(2.27±0.66)cm on the images of 3D-vibe,the mean maximal diameter of low signal ablated zone(DT2)was(2.25± 0.58)cm on the image of FS-TSE T2WI,there were no statistically significant among DR,DT1and DT2.The part of lesions beside the vascular in 2 lesions were ablated incompletely,a high signal ring of ablation lesions was not completely around the low signal tumor lesions on 3D-vibe.ConclusionThe MRI-guided RFA in treatment of VX2 tumor in rabbit liver is an effective and feasible technology.
Magnetic resonance imaging;Blood vessels;Radiofreqency ablation;Liver;Rabbits
R730.5;R445.2
A
1672-8475(2016)08-0500-05
10.13929/j.1672-8475.2016.08.012
陈一平(1971—),男,福建仙游人,学士,副主任医师。研究方向:介入放射学。E-mail:ptchenyp@163.com
林征宇,福建医科大学附属第一医院介入科,350005。E-mail:linsinlan@aliyun.com
2016-01-29
2016-03-18
