不同药物含量血管支架对内皮化进程的影响
2016-09-06刘恒全潘长江张文凯
刘恒全,潘长江,张文凯,刘 涛
(1.深圳迈德科技有限公司,广东深圳 518103;2.淮阴工学院江苏省介入医疗器械重点实验室,江苏淮安 223003)
·基础与实验研究·
不同药物含量血管支架对内皮化进程的影响
刘恒全1*,潘长江2,张文凯1,刘涛2
(1.深圳迈德科技有限公司,广东深圳518103;2.淮阴工学院江苏省介入医疗器械重点实验室,江苏淮安223003)
目的探讨不同剂量的药物支架在抑制血管再狭窄过程中对内皮化进程的影响。方法采用超声雾化法在L605金属支架表面制备不同雷帕霉素含量的药物支架,将其分别植入新西兰大白兔腹主动脉,第1、4、12周后通过扫描电镜、组织切片分析药物含量对血管支架内皮化程度的影响。结果不同药物含量的血管支架在各时间点血管内腔通畅、光滑、无血栓形成,但随着药物含量的升高,内皮化程度会延迟。结论雷帕霉素含量80~110 μg/cm时药物支架对血管功能恢复及防止再狭窄作用显著。
支架;冠状动脉再狭窄;药物含量;内皮化
血管支架植入术是治疗冠状动脉狭窄的有效方法。与球囊简单扩张和金属裸支架相比,药物洗脱血管支架(drug eluting stent,DES)的临床应用使得血管内再狭窄率下降到10%以内,有效降低了介入治疗中支架内再狭窄等并发症的发生[1-2]。然而,DES表面涂层所装载的药物(一般为雷帕霉素、紫杉醇等)在抑制平滑肌细胞(smooth muscle cells,SMCs)增殖的同时,也阻碍了具有天然抗凝和保护血管功能的内皮细胞(endothelial cells,ECs)层愈合,导致靶病变血管血运重建(target lesion revascularization,TLR)中血管支架在病变血管部位晚期贴壁不完全或内皮化延迟,最终导致支架内再狭窄和晚期血栓形成等不良事件的发生[3-5]。本研究在支架表面调控载药量,旨在减少药物支架在抑制血管再狭窄过程中对内皮化进程的影响。
1 材料与方法
1.1一般资料药物载体选用聚乳酸-羟基乙酸共聚物(PLGA),其聚乳酸(PL)与羟基乙酸(GA)混合比例为4∶1,定量时精确到0.001 mg。实验动物为新西兰大白兔42只,由广东省实验动物中心提供,体质量2.0~2.5 kg,雄雌随机。
1.2仪器与方法
1.2.1药物支架的制作采用超声雾化法在L605支架表面制备雷帕霉素药物涂层,根据喷涂圈数来设计涂层重量,根据药物含量不同分为A(不含雷帕霉素)、B(雷帕霉素80 μg/cm)、C(雷帕霉素110 μg/ cm)、D组(雷帕霉素170 μg/cm),每组植入9只实验动物,余6只备用。采用高效液相色谱法(high performance liquid chromatography,HPLC)确认药物含量及药物比率,HPLC测量浓度60 μg/ml,洗脱液体积4 ml,保留时间为14 min。药物比率计算方法:药物比率=药物含量/(药物支架重量-支架喷涂前重量)×100%。
1.2.2动物实验采用巴比妥类麻醉剂对36只实验兔全麻后切开后腿皮肤,钝性分离兔右股动脉,结扎股动脉远端;股动脉切开小口,逆行置入导丝(0.014× 190 cm)至腹主动脉,在导丝引导下植入药物支架;通过压力泵向球囊内注入肝素/生理盐水,维持压力16 atm不少于5 s,将支架释放并固定腹主动脉的位置,撤出球囊导管;术后逐层缝合皮下组织及皮肤,消毒伤口周围皮肤后肌肉注射青霉素20万U,保温至动物苏醒后归笼饲养。
在支架植入后在第1、4、12周分别以空气栓塞法处死实验兔,每次3只,分离腹主动脉并剪取含支架部分血管。以生理盐水冲洗血管内外壁,在血管支架1/ 2处剪下带支架一段血管,再沿纵轴剪断支架并小心展开支架与血管壁,以戊二醛溶液固定。将已固定的血管段分别置于 60%、70%、80%、90%、100%乙醇中各脱水1 h;之后分别浸入98%乙醇与99%丙酮比为40∶60、20∶80的溶液中换液0.5 h;最后浸入99%丙酮换液1 h。快速干燥后用扫描电镜观察。
将剩下血管段直接浸入4%多聚甲醛溶液中固定24~48 h;之后予以脱水、透明、树脂包埋,切片厚度约为100 μm,然后再用磨抛机磨薄至50 μm,HE染色后用光学显微镜拍片,根据形态学分析内膜增生情况。
2 结果
图1示雷帕霉素药物含量为110.00 μg/cm时HPLC到达吸收峰的时间约为14 min。通过支架喷涂前、后的重量差值计算得药物涂层重量约为277.20 μg/cm,对雷帕霉素特征峰面积进行积分处理,该涂层中雷帕霉素药物含量为109.50 μg/cm,药物比率为39.50%。
血管支架表面药物涂层分布均一、连续,颜色均匀(图2)。所有支架均顺利植入且实验动物均存活至终点,将靶血管取出后均未发现支架内血栓。第1周4组支架均有新生组织不连续情况出现,但支架表面细胞及组织物差别不显著;A、D组支架表面组织物覆盖较B、C组更薄,即B、C组支架表面组织覆盖较完全。支架植入后第4周与第12周所有血管段组织均完全被组织物覆盖,各组差异性不大,但第4周时,C组比A、B、D组的组织覆盖程度高(图3)。各血管支架的硬组织切片示D组支架比其他组支架的血管段壁厚。支架植入后第1周时,各组支架植入后血管内膜增生均不明显,第4周时A、D组支架表面有少量组织物覆盖,C组支架表面已完全被连续组织覆盖;支架植入后第12周,所有支架表面均被连续内膜组织覆盖,无内膜增生。支架植入时间愈长D组的内壁厚度较其他组增厚越明显(图4)。

图1 药物支架雷帕霉素特征吸收峰
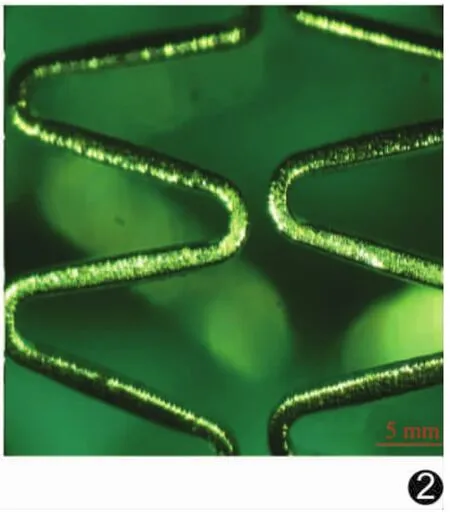
图2 药物涂层支架的表面形貌
3 讨论
本研究中药物聚合物载体PLGA属于脂肪族聚酯,分子长链的每个单体单元中均含有酯键,链以羧基和羟基为端基[6]。由于血管壁表面的内皮层不仅具有调节血压以及凝血与抗凝平衡等特殊功能,而且健康完整的内皮层还是阻止粥样硬化斑块和血栓形成的天然屏障[7]。在内皮细胞完全覆盖血管支架前,抗增生药物可直接作用于局部血管壁,因此选择适量的药物可起到抑制平滑肌细胞的过度增殖、迁移,从而预防支架内再狭窄的作用[8-9]。一般情况下,血管支架表面药物含量通过体外释放来评估其释放速率及安全性,尚缺少在体实验来评价药物含量对内皮化进程影响的直接证据,尤其是不同植入周期药物释放量对血管组织的影响。若血管组织局部药物剂量过高,容易产生炎症反应、血管愈合延迟,影响血管正常重塑过程[10-11]。
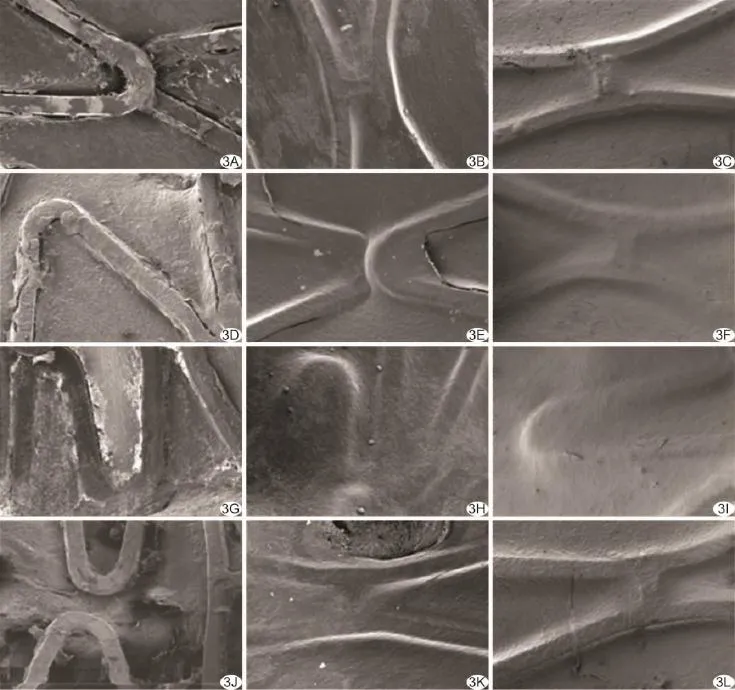
图3 不同周期血管支架表面形貌 A~C.分别为A组支架植入后第1、4、12周;D~F.分别为B组支架植入后第1、4、12周;G~I.分别为C组支架植入后第1、4、12周;J~L.分别为D组支架植入后第1、4、12周
与裸支架比较,药物洗脱支架植入后血管内皮化延迟,其机制可能与聚合物的生物相容性,药物的剂量、特性与分布有关。当局部药物浓度过高会抑制内皮层的修复[12-13]。本研究结果表明,支架植入后第1、4、12周不同雷帕霉素含量的药物洗脱支架(包括只含有PLGA涂层的支架)均无血栓形成。支架植入后第1周,只含PLGA涂层和170 μg/cm雷帊霉素药物的支架,较80 μg/cm与110 μg/cm雷帊霉素的药物支架内皮化覆盖程度有一定差异,因此无论药物支架还是普通支架,新生内膜的细胞成分和内皮化过程相似,雷帕霉素在抑制平滑肌细胞的同时,对内皮细胞也有一定的影响,特别是药物浓度较高时影响更显著。雷帕霉素药物支架植入后第12周时无内膜增生,无支架内血栓形成,表明其有减少内膜增生与降低支架内再狭窄的作用。

图4 不同周期血管支架的组织切片(HE,×100) A~C.分别为A组支架植入后第1、4、12周;D~F.分别为B组支架植入后第1、4、12周;G~I.分别为C组支架植入后第1、4、12周;J~L.分别为D组支架植入后第1、4、12周
综上所述,雷帕霉素含量为80~110 μg/cm的药物支架能较早内皮化,对血管功能恢复以及防止血栓形成作用明显。
[1] Garg S,Bourantas C,Serruys PW.New concepts in the design of drug-eluting coronary stents.Nat Rev Cardiol,2013,10(5):248-260.
[2] Iakovou I,Schmidt T,Bonizzoni E,et al.Incidence,predictors,and outcome of thrombosis after successful implantation of drug-eluting stents.JAMA,2005,293(17):2126-2130.
[3] Nordmann AJ,Briel M,Bucher HC.Mortality in randomized controlled trials comparing drug-eluting vs.bare metal stents in coronary artery disease:A meta-analysis.Eur Heart J,2006,27(23):2784-2814.
[4] 罗来龙,王贵学,尹铁英.药物洗脱性血管内支架药物涂层的研究进展.中国医疗器械杂志,2006,30(2):1.
[5] Choi C,Hwang I,Cho YL et al.Fabrication and characterization of plasma-polymerized poly(ethylene glycol)film with superior biocompatibility.ACS Appl Mater Interfaces,2013,5(3):697-702.
[6] 张琳,张瑞岩,朱政斌.国产雷帊霉素洗脱支架与裸支架植入后血管再内皮化实验研究.介入放射学杂志,2009,18(8):616-619.
[7] Wang HG,Yin TY,Ge SP,et al.Biofunctionalization of titanium surface with multilayer films modified by heparin-VEGF-fibronectin complex to improve endothelial cell proliferation and blood compatibility.J Biomed Mater Res A,2013,101(2):413-420.
[8] Meyers SR,Kenan DJ,Khoo X,et al.Bioactive stent surface coating that promotes endothelialization while preventing platelet adhesion.Biomacromolecules,2011,12(3):533-539.
[9] Alexander MR,Owens GK.Epigenetic control of smooth muscle cell differentiation and phenotypic switchingin vascular development and disease.Annu Rev Physiol,2012,74:13-40.
[10] 逢淑峰,徐大海,赵利华.冠状动脉内支架置入术后再狭窄与炎症反应.实用心脑血管病杂志,2011,19(2):163-165.
[11] De Visscher G,Mesure L,Meuris B,et al.Improved endothelialization and reduced thrombosis by coating a synthetic vascular graft with fibronectin and stem cell homing factor SDF-1α.Acta Biomater,2012,8(3):1330-1338.
[12] Finn AV,Joner M,Nakazawa G,et al.Pathological correlates of late drug-eluting stent thrombosis:Strut coverage as a marker of endothelialization.Circulation,2007,115(18):2435-2441.
[13] Wendeln C,Rinnen S,Schulz C,et al.Rapid preparation of multifunctional surfaces for orthogonal ligation by microcontact chemistry. Chem Eur J,2012,18(19):5880-5888.
Effect of various drug-content coated stents during endothelialization in vivo
LIU Hengquan1*,PAN Changjiang2,ZHANG Wenkai1,LIU Tao2
(1.Shenzhen Medtech Co.Ltd.,Shenzhen 518103,China;2.Jiangsu Provincial Key Laboratory for Interventional Medical Devices,Huaiyin Institute of Technology,Huai'an 223003,China)
ObjectiveTo explore the effect of various drug-content coated stents during endothelialization in vivo.Methods The various contents of Rapamycin coated L605 stents were prepared by ultrasonic nebulization method,and the stents were implanted into abdominal aorta of New Zealand rabbits.The effect at 1st,4th,12thweeks of various drug-content stents on endothelialization process was investigated by scanning electron microscopy and tissue section.ResultsIntravascular lumen was smooth,and no any thrombosis was observed to all stents in each period,but the endothelialization was delayed while the drug concentrate rose.ConclusionIt is satisfactory drug concentrate of 80-110 μg/cm to vessel remodeling and prevent restenosis.
Stents;Coronary restenosis;Drug content;Endothelialization
R543.3;R452
A
1672-8475(2016)08-0490-05
10.13929/j.1672-8475.2016.08.010
国家自然科学基金(31470926)、深圳市科创委专项基金(CXZZ20140401143609670)。
刘恒全(1977—),男,四川资阳人,博士,高级工程师。研究方向:心血管植入器械的研究和开发。
刘恒全,深圳迈德科技有限公司,518103。
E-mail:liuhengquan@aliyun.com
2016-04-11
2016-06-30
