Shh信号通路阻断对人结肠癌细胞HT-29增殖、侵袭的影响及机制探讨
2016-09-05梁新军魏少忠
梁新军,魏少忠
(湖北省肿瘤医院,武汉430079)
Shh信号通路阻断对人结肠癌细胞HT-29增殖、侵袭的影响及机制探讨
梁新军,魏少忠
(湖北省肿瘤医院,武汉430079)
目的观察阻断Sonic Hedgehog(Shh)信号通路对人结肠癌细胞HT-29增殖和侵袭的影响,并探讨其机制。方法取对数生长期HT-29细胞分为A、B、C、D组,分别置于含0、5、10、20 μmol/L Shh信号通路特异性抑制剂Cyclopamine的培养基中培养。采用MTT法检测各组干预24、48、72 h时细胞增殖抑制率,采用Transwell法检测各组干预48 h时体外侵袭能力,采用实时荧光定量PCR法检测各组细胞Shh、下游转录因子GLI1 mRNA。结果干预24、48、72 h时各组细胞增殖抑制率为B组
结肠癌;Shh信号通路;下游转录因子;细胞增殖;细胞侵袭
结肠癌是临床常见的恶性肿瘤之一,发病率已跃居全球恶性肿瘤的第3位,其发病机制目前尚不明确[1]。基因突变和表观遗传学改变等参与了结肠癌的发生、发展过程[2]。Sonic Hedgehog(Shh)信号通路是调控胚胎发育及细胞分化的重要通路,GLI1是其下游转录因子。研究发现,Shh信号通路在肺癌、乳腺癌、胃癌、结肠癌等多种恶性肿瘤中呈激活状态,且与肿瘤的恶性程度和患者预后密切相关[3~5]。目前Shh信号通路在结肠癌中的具体作用机制的研究报道较少。2015年1~12月,我们观察了阻断Shh信号通路对人结肠癌细胞HT-29增殖和侵袭的影响,并探讨其在结肠癌发生、发展中的意义。现报告如下。
1 材料与方法
1.1材料HT-29购自美国ATCC公司,置于含10%胎牛血清的RPMI 1640培养基中,于37 ℃、5%CO2、饱和湿度的培养箱内培养。胎牛血清、RPMI 1640培养基及TRIzol为美国Gibco公司产品;胰酶、DMSO、MTT、Shh信号通路特异性抑制剂Cyclopamine等购自Sigma公司;SYBR Premix EX Taq试剂盒购自Invitrogen公司;引物由上海吉玛公司合成;Transwell小室购自Corning公司;Bio-Rad iQ5实时荧光定量PCR仪购自Bio-Rad公司;Multiskan MK3全自动酶标仪购自Thermo公司。
1.2细胞分组及处理取对数生长期HT-29细胞,胰酶消化、重悬后分为A、B、C、D组,分别置于含0、5、10、20 μmol/L Cyclopamine的培养基中培养,每组6个复孔,均置于37 ℃、5% CO2、饱和湿度的培养箱内培养。
1.3HT-29增殖情况观察采用MTT法。分别于干预24、48、72 h取对数生长期各组细胞,调整细胞密度5×104/mL。每孔200 μL接种于96孔板,每组6个复孔。培养24 h,加入20 μL的MTT(5 g/L)行MTT检测,所有操作均严格按照使用说明书进行。采用酶标仪检测各组490 nm波长处的吸光度值,计算增殖抑制率。细胞增殖抑制率=(对照组吸光度值-实验组吸光度值)/对照组吸光度值×100%。实验重复3次。
1.4HT-29侵袭能力观察采用Transwell法。干预48 h时取对数生长期各组细胞,1×105/mL培养在无血清的PRMI 1640培养基中,置于Transwell小室上室,下室每孔加入0.5 mL含10%胎牛血清的PRMI 1640培养基。置于37 ℃、5% CO2、饱和湿度的培养箱中,培养24 h。拭去上室表面剩余细胞,将迁移到下室的细胞用多聚甲醛固定30 min,Giemsa染色15 min;显微镜下计数,以穿膜细胞数表示细胞的侵袭能力。实验重复3次。
1.5细胞Shh、GLI1 mRNA检测采用实时荧光定量PCR法。干预48 h时取对数生长期各组细胞,照TRIzol试剂盒说明提取总RNA,逆转录合成cDNA。按照SYBR试剂盒说明进行实时荧光定量PCR,对Shh、GLI1的mRNA进行定量检测。引物采用Primer 5.0软件设计,具体如下:Shh上游引物5′-CCAACGTAGCCGAGAAGACC-3′,下游引物5′-TCC-CGTGTTTCCTCATCCT-3′;Gli1上游引物5′-TGAGGTGGGCAGGTTAGGA-3′,下游引物5′-CAGAGGGAGATGGGGTGTTTT-3′。内参GAPDH上游引物5′-TGTCCCCACCCCCAATGTATC-3′,下游引物5′-CTCCGATGC CTGCTTCACACCTT-3′。反应条件:94 ℃预变性5 min;94 ℃、30 s,58 ℃、30 s,72 ℃、30 s,共35个循环。以GAPDH为内参,采用2-ΔΔCt法计算目的基因的相对表达量。
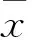
2 结果
2.1各组细胞增殖抑制率比较见表1。
表1 干预24、48、72 h时各组细胞增殖抑制率比较
注:与B组同时点比较,#P<0.05;与C组同时点比较,*P<0.05;与本组前一时点比较,△P<0.05。
2.2各组穿膜细胞数比较干预48 h时,A、B、C、D组的穿膜细胞数分别为(55.670±6.506)、(35.330±7.371)、(28.330±4.041)、(23.330±2.309)个。B、C、D组穿膜细胞数均低于A组(P均<0.05),但B、C、D组间比较差异无统计学意义。
2.3各组Shh、GLI1 mRNA表达比较各组Shh、GLI1 mRNA的相对表达量均为A组>B组>C组>D组,P均<0.05。见表2。

表2 各组HT-29组织Shh、GLI1 mRNA相对表达量比较
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,ΔP<0.05。
3 讨论
目前认为结肠癌的发生是多因素、多步骤的复杂过程,基因突变和表观遗传学改变等均参与了结肠癌的侵袭与转移过程,但其确切机制尚不明确[6~8]。国内外学者已发现多个与结肠癌转移相关的基因,如VEGF、MMP-9等,并针对这些因子采取了包括药物、基因转染等多种方法进行调控,虽能取得部分抑制转移的效果,但结果尚不满意[9~11]。
Shh信号转导通路不仅在胚胎发育过程中发挥重要作用,也参与了组织修复和细胞再生以及肿瘤发生和发展的过程。目前认为,Shh信号转导通路主要由Hh信号肽、跨膜受体以及下游转录分子组成,通过复杂的信号转导过程将上游信号传递到核内,进一步促进下游基因的表达而参与细胞的各项调控过程[12,13]。研究表明,Shh信号转导通路的关键信号分子主要有Shh、跨膜蛋白受体Ptch、Smo及下游的转录因子Gli等。在Shh信号被激活后,Shh与跨膜蛋白受体Ptch(Ptch1、Ptch2)相结合,解除了其对Smo的抑制作用,继而传递信号至下游的Gli(Gli1、Gli2、Gli3),Gli蛋白进入核内后进一步激活下游NF-κB、Bmi-1等因子的表达,从而参与调控细胞的增殖与凋亡过程。Shh信号可能通过多种机制参与调控恶性肿瘤细胞的增殖与侵袭[14,15]。Sharma等[16]研究发现,Shh信号可能与PI3K/Akt/mTOR信号共同参与了胰腺癌干细胞增殖和分化的调控过程,继而参与了胰腺癌的侵袭与转移。Giakoustidis等[17]研究认为,Shh信号、WNT/β-catenin信号及Notch信号等可能共同参与了肝癌侵袭与转移的过程。本研究前期研究发现,结肠癌中Shh信号通路呈异常激活状态,本研究发现,干预24、48、72 h时各组细胞增殖抑制率均为B组
[1] Siegel R, Desantis C, Jemal A. Colorectal cancer statistics[J]. CA Cancer J Clin, 2014,64(2):104-117.
[2] Storm EE, Durinck S, de Sousa Melo F, et al. Targeting PTPRK-RSPO3 colon tumours promotes differentiation and loss of stem-cell function[J]. Nature, 2016,529(7584):97-100.
[3] Bora-Singhal N, Perumal D, Nguyen J, et al. Gli1-mediated regulation of sox2 facilitates self-renewal of stem-like cells and confers resistance to EGFR inhibitors in non-small cell lung cancer[J]. Neoplasia, 2015,17(7):538-551.
[4] Duan ZH, Wang HC, Zhao DM, et al. Cooperatively transcriptional and epigenetic regulation of sonic hedgehog overexpression drives malignant potential of breast cancer[J]. Cancer Sci, 2015,106(8):1084-1091.
[5] Xu M, Gong A, Yang H, et al. Sonic hedgehog-glioma associated oncogene homolog 1 signaling enhances drug resistance in CD44(+)/Musashi-1(+) gastric cancer stem cells[J]. Cancer Lett, 2015,369(1):124-133.
[6] Schmoll HJ, Tabernero J, Maroun J, et al. Capecitabine plus oxaliplatin compared with fluorouracil/folinic acid as adjuvant therapy for stage Ⅲ colon cancer: final results of the NO16968 randomized controlled phase Ⅲ trial[J]. J Clin Oncol, 2015,33(32):3733-3740.
[7] de Ridder JA, van der Stok EP, Mekenkamp LJ, et al. Management of liver metastases in colorectal cancer patients: A retrospective case-control study of systemic therapy versus liver resection[J]. Eur J Cancer, 2016(59):13-21.
[8] Wada Y, Takami Y, Tateishi M, et al. Efficacy of surgical treatment using microwave coagulo-necrotic therapy for unresectable multiplecolorectal liver metastases[J]. Onco Targets Ther, 2016(9):937-943.
[9] Artemov A, Aliper A, Korzinkin M, et al. A method for predicting target drug efficiency in cancer based on the analysis of signaling pathway activation[J]. Oncotarget, 2015,6(30):29347-29356.
[10] Kim DH, Sung B, Kang YJ, et al. Sulforaphane inhibits hypoxia-induced HIF-1α and VEGF expression and migration of human colon cancer cells[J]. Int J Oncol, 2015,47(6):2226-2232.
[11] Goos JA, Coupé VM, van de Wiel MA, et al. A prognostic classifier for patients with colorectal cancer liver metastasis, based on AURKA, PTGS2 and MMP9[J]. Oncotarget, 2016,7(2):2123-2134.
[12] Jung IH, Jung DE, Park YN, et al. Aberrant Hedgehog ligands induce progressive pancreatic fibrosis by paracrine activation of myofibroblasts and ductular cells in transgenic zebrafish[J]. PLoS One, 2011,6(12):27941.
[13] Ransohoff KJ, Sarin KY, Tang JY. Smoothened Inhibitors in Sonic Hedgehog Subgroup Medulloblastoma[J]. J Clin Oncol, 2015,33(24):2692-2694.
[14] Wang ZC, Gao J, Zi SM, et al. Aberrant expression of sonic hedgehog pathway in colon cancer and melanosis coli[J]. J Dig Dis, 2013, 14(8):417-424.
[15] Xu X, Liu H, Zhang H, et al. Sonic hedgehog-GLI family zinc finger 1 signaling pathway promotes the growth and migration of pancreatic cancer cells by regulating the transcription of eukaryotic translation initiation factor 5A2[J]. Pancreas,2015,44(8):1252-1258.
[16] Sharma N, Nanta R, Sharma J, et al. PI3K/AKT/mTOR and sonic hedgehog pathways cooperate together to inhibit human pancreaticcancer stem cell characteristics and tumor growth[J]. Oncotarget, 2015,6(31):32039-32060.
[17] Giakoustidis A, Giakoustidis D, Mudan S, et al. Molecular signalling in hepatocellular carcinoma: Role of and crosstalk among WNT/β-catenin, Sonic Hedgehog, Notch and Dickkopf-1[J]. Can J Gastro Hepat, 2015,29(4):209-217.
Effects of blocking Shh signaling pathway on proliferation and invasion of colon cancer cell line HT-29
LIANGXinjun,WEIShaozhong
(HubeiCancerHospital,Wuhan430079,China)
ObjectiveTo observe the effects of blocking Sonic Hedgehog (Shh) signaling pathway on the proliferation and invasion of colon cancer cell line HT-29 and to investigate the mechanism. MethodsHT-29 cells in the logarithmic phase were divided into groups A, B, C, and D and were cultured in the culture medium containing 0, 5, 10 and 20 mol/L Shh signaling pathway specific inhibitor Cyclopamine, respectively. The inhibitory rate of cell proliferation was detected by MTT method at 24, 48 and 72 h after the treatment of Cyclopamine. Transwell method was used to detect the invasive ability of each group at 48 h. The Shh and downstream transcription factor GLI1 mRNA in HT-29 cells was detected by real-time fluorescence quantitative PCR. ResultsThe proliferation inhibition rate at 24 h, 48 h and 72 h: group B
colon carcinoma; Sonic Hedgehog signaling pathway; downstream transcription factor; cell proliferation; cell invasion
湖北省武汉市科技局科技计划项目(2013062301010813);湖北省武汉市晨光计划(2015070404010204)。
梁新军(1976-),男,博士,副主任医师,主要研究方向为肿瘤免疫。E-mail: doctorlxj@163.com。
10.3969/j.issn.1002-266X.2016.18.004
R735.3
A
1002-266X(2016)18-0012-03
2016-01-11)
