盐水浓度对铸造铝合金腐蚀行为的影响*
2016-09-05石伟和刘春柳
陈 林,石伟和,刘春柳
(百色学院材料科学与工程学院,广西 百色 533000)
盐水浓度对铸造铝合金腐蚀行为的影响*
陈林,石伟和,刘春柳
(百色学院材料科学与工程学院,广西百色533000)
铝合金材料的表面氧化薄膜很容易受到氯离子的腐蚀从而减少其使用寿命。试验采用浸泡法研究了铸造铝合金A356.2在低浓度NaCl溶液中的腐蚀行为,通过不同浓度NaCl溶液腐蚀情况进行对比,随着浓度的增加,腐蚀会逐渐加剧,而在2%~4%NaCl浓度下,腐蚀较为平缓,没有因为浓度的增加而产生明显的加剧腐蚀,在4%浓度后会有明显的腐蚀加剧现象。
铝合金A356.2;点腐蚀;NaCl浓度
铝产业的发展和汽车的发展息息相关,如今汽车铝化率日益提高,对铝合金车轮的耐腐蚀性能、轻量化要求也迈上了新的台阶,特别是在中国[1-2]。腐蚀是一种自发进行的现象,具体表现为材料和周围的环境发生反应而被破坏[7]。腐蚀对我们的经济有着巨大的危害,带来的损失远比想象中的多。调查显示:腐蚀造成的经济损失是非常严重的,基本上占各国国民经济总产值的1%~5%,是自然灾害损失总和的6倍。腐蚀就像是金属材料在“患病”,要想控制或者减少金属的腐蚀损失,就必须要了解金属腐蚀行为是如何进行的,通过了解金属的腐蚀行为从而应用防腐蚀知识和技术可以将腐蚀的损失减少25%~30%。
环境污染日益严重,对汽车的使用环境要求也日益提高,汽车的使用环境也会变得较为恶劣,对于轮毂铝合金耐腐蚀性能的研究鲜有报道,因此有必要探究盐水对铝合A356.2的腐蚀行为影响,这将有助于汽车车轮在盐碱地带、沿海地区、海洋大气环境下使用寿命的评估,对保障汽车的安全使用有重要的意义。
1 实 验
铝合金A356.2,主要化学成分(w%)为:Si 6.5~7.5、Ti 0.10~0.20、Sr 0.01~0.02、Mg 0.25~0.40、余量Al[19]。把试验材料切割成块,然后用金相打磨机和抛光机把材料打磨成试验需要的尺寸8 mm×4 mm×2 mm。铝合金轮毂腐蚀主要发生在盐碱地、海洋气候、沿海地区,Cl-离子浓度一般较低,故腐蚀溶液的浓度区间定为2%~6%(ω),而微量的双氧水则是为了加速腐蚀。轮毂在户外使用过程中由于摩擦、阳光的暴晒等原因,都会使得车轮的温度高于气温,所以把腐蚀的温度定为45℃,腐蚀时间为48 h。腐蚀试验采用浸泡法,腐蚀介质分为5组,由不同浓度的NaCl和一定浓度的H2O2组成,成分含量如表1所示。分别在8 h、16 h、24 h、32 h、40 h和48 h将试样取出,用超声波清洗仪清洗腐蚀样品,然后用电子天平称量质量测量腐蚀损失状况并用金相显微镜观察腐蚀表面。

表1 腐蚀溶液化学成分
2 结果与讨论
图1中a、b、c分别是e、f、g的腐蚀前的金相图,e为在2%NaCl浓度下的腐蚀后的金相图,可以发现腐蚀坑点并不是很多,f是在5%NaCl浓度下的腐蚀金相图,相对于2%浓度下腐蚀坑点分布得更为广泛,坑点大小没有明显的区别,g是在6%NaCl浓度下的腐蚀后金相图,腐蚀坑点明显的变大,腐蚀坑得数目也开始变多变密集,说明其对低浓度的盐水的腐蚀有一定的抵抗能力。由金相图可以推断铝合金A356.2在低浓度Cl-的腐蚀下是以点腐蚀为主,其他腐蚀形态暂时没有出现。
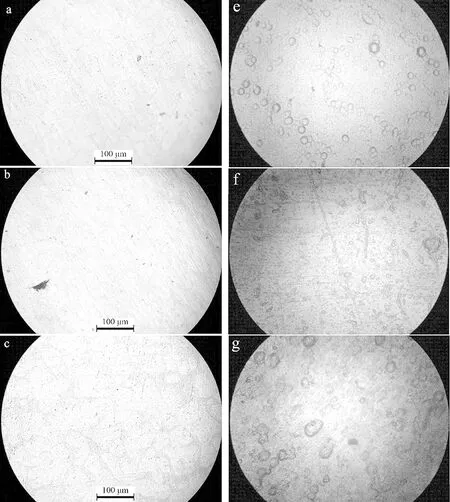
图1 腐蚀前后金相图
试样的失重作为评价腐蚀程度主要参考标准,并以此标准来研究溶液对试样腐蚀行为的影响,各个浓度下的试样失重与时间的关系曲线如图2所示。
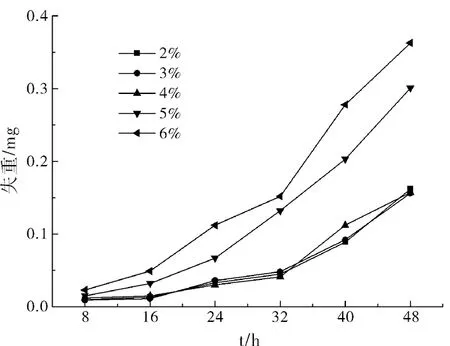
图2 失重曲线
由图2可以看出在32 h前,由于铝合金表面氧化薄膜的关系,腐蚀的速率比较缓慢,在32 h以后由于Cl-和Al(OH)3发生反应生成AlCl3,而AlCl3的水解则会使溶液的pH变越来越低,使得腐蚀速率增加。在同一时间内5%和6%浓度下的试样腐蚀速率明显高于4%以下的腐蚀速率,说明了Cl-的浓度是决定腐蚀速率的关键因素。
经过48 h的腐蚀后,试样经过处理后称量得到溶液浓度与试样的腐蚀速率关系如图3所示。
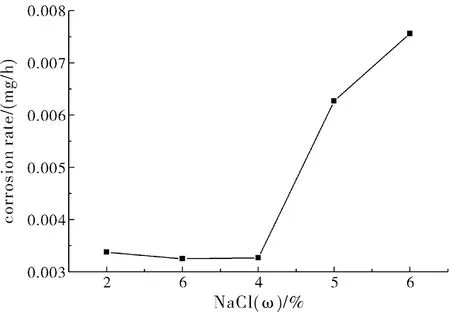
图3 铝合金A356.2的腐蚀速率曲线
由图3可以看出来在4%浓度前腐蚀的速率和腐蚀失重都相差不大,在4%之后腐蚀的速率和腐蚀失重都有明显的提升,说明4%浓度是铝合金A356.2腐蚀的一个临界点。再结合金相图e表明铝合金的氧化薄膜在低浓度盐水下发挥出了很好的防腐蚀作用,高于4%之后铝合金的抗腐蚀能力会变的相当弱,使得铝合金的基体遭到破坏。
不管是在溶液还是大气环境下,铝合金发生点腐蚀的主要原因都是和Cl-发生反应,在铝合金发生腐蚀的产物中硫酸盐腐蚀排在第一,而氯化产物就排在第二,足以说明Cl-在铝合金腐蚀中的作用。在大气环境下,Cl-主要是通过气相的HCl、含氯的的有机气体、海盐等通过降雨进入江水、湖水,然后与铝合金发生接触产生点腐蚀,如果有应力的作用下会使得点蚀坑内产生晶间腐蚀[3]。而铝合金发生点腐蚀的最初一步是液膜中Cl-在铝合金的表面的活性位发生吸附,在铝合金氧化膜不完整和缺陷的地方这种现象会被增强,接下来吸附的离子会和氧化膜发生进一步的化学反应,使得铝合金的氧化膜被削弱而进一步的直接溶解[4]。
Cl-的存在会使氧化膜被渗透,氧化膜会被破坏,因此Al3+会向外迁移。铝合金的表面活化,点腐蚀从此开始。在点腐蚀坑处,阳极会溶解为Al3+,而在电力场的作用下Cl-会进一步向合金内部迁移。腐蚀产物中以AlCl3为主,其只要原因是Al(OH)3经过一系列的绿化步骤形成的,Al(OH)nCl3-n则是OH-和Cl-在铝合金表面的氧化膜竞争吸附形成的产物,其反应情况如下:
(1)
腐蚀产物AlCl3的水解会使得腐蚀坑中的pH降低,使得腐蚀作用进一步的增强[5]。双氧水的加入则是考虑到了实验时间的问题,双氧水会和铝合金发生以下反应:
(2)
而Al(OH)3则会和Cl-上述式(1)的反应,故而会加速铝合金的腐蚀,从而缩短实验的时间,因为铝合金的的盐水腐蚀实验想要得出比较明显的实验结果需要长达几个月甚至上年的时间,在有双氧水的条件下时间要短上很多。
3 结 论
铸造铝合金A365.2在较低浓度的NaCl溶液中的腐蚀程度很小,具有一定的抵抗能力;但是当盐水浓度高于4%时,合金的腐蚀速率会快速的增长,这说明铝合金的点腐蚀行为受
Cl-浓度增加影响,当Cl-离子浓度达到一个极限值后其抵抗腐蚀的能力几乎被完全破坏,使得合金组织被腐蚀。
[1]宋鸿武,李昌海,常海平,等.高强韧铝合金轮毂的轻量化铸旋新工艺[J].稀有金属,2012,4(5):630-635.
[2]姜玉波.铝合金材料在汽车轻量化中的应用分析[J].试验技术与试验机,2004,44(3):31-34.
[3]徐火平,刘慧丛,朱立群,等.盐水环境下高强铝合金暴露面积对腐蚀行为的影响[J].材料工程,2010(05):41-46.
[4]陈文敬.高强铝合金应力条件下的腐蚀行为及其电化学行为研究[D].长沙:中南大学,2008.
[5]Nguyen T H,Foley R T.chemical nature of aluminum corrosion -3.the dissolution mechanism of aluminum oxide and aluminum powder in various electrolytes.[J].Journal of the Electrochemical Society,1980,127(12):2563-2566.
Effect of Salt Concentration on the Corrosion of Cast Aluminium Alloy*
CHEN Lin,SHI Wei-he,LIU Chun-liu
(School of Materials Science and Engineering,Baise University,Guangxi Baise 533000,China)
The performance of surface oxide film of aluminum alloy is susceptible to corrosion of chlorine ion and reduced the service life of aluminum alloy.Alloy A356.2 were immersion in different concentrations of NaCl,the corrosion rate increased with the concentration,when the NaCl concentration was 2%to 4%,the corrosion was gentle,but when the concentration ≥4%,the phenomenon of corrosion were very evident.
A356.2 aluminum alloy; corrosion; NaCl concentration
广西高校科学技术研究重点资助项目(2013ZD070);广西高校科学技术研究项目(YB2014387、KY2015LX384);白色学院校级一般项目(2015KBN04);2015 年地方高校国家级大学生创新创业训练计划项目(201510609004)。
陈林(1987-),男,硕士,主要研究方向高性能铝合金材料。
TG172.6+3
A
1001-9677(2016)06-0040-03
