优化胰蛋白酶消化强度进行人子宫内膜上皮细胞培养技术探讨*
2016-09-05秦雯蒋凌云莫馥华朱时敏顾克英罗远富覃爱平广西医科大学第一附属医院医学生殖中心广西南宁500广西医科大学第一附属医院病理科广西南宁500广西医科大学广西南宁500
谢 伟,秦雯,蒋凌云,莫馥华,朱时敏,顾克英,罗远富,覃爱平△(.广西医科大学第一附属医院医学生殖中心,广西南宁500;.广西医科大学第一附属医院病理科,广西南宁500;.广西医科大学,广西南宁500)
·论著·
优化胰蛋白酶消化强度进行人子宫内膜上皮细胞培养技术探讨*
谢伟1,秦雯2,蒋凌云1,莫馥华1,朱时敏3,顾克英3,罗远富3,覃爱平1△(1.广西医科大学第一附属医院医学生殖中心,广西南宁530021;2.广西医科大学第一附属医院病理科,广西南宁530021;3.广西医科大学,广西南宁530021)
目的探讨优化改良的人子宫内膜原代上皮细胞培养技术。方法将2014年7月1日至2014年9月30日需行诊断性清宫术的患者21例分为0.125%胰蛋白酶组(A组)、0.250%胰蛋白酶组(B组)和1 mg/mL胶原酶组(C组)。同时结合使用100目滤网(150 μm)及400目(38 μm)滤网进行子宫内膜上皮及间质细胞分离,比较各组间子宫内膜上皮细胞纯度和生长状态。结果子宫内膜细胞培养成功19例,A组子宫内膜组织污染1例,C组因细胞量过少接种失败1例。细胞获得后培养进行上皮细胞团百分比计算,A组为(85.71±1.38)%、B组为(75.28±1.50)%和C组为(84.86± 2.34)%,其中A组和C组的上皮细胞百分比高于B组,差异均有统计学意义(P<0.05)。细胞培养3~5 d后待细胞基本铺满培养孔,免疫组化辣根过氧化物酶底物显色(ABC法)进行纯度检测,A组为(90.28±2.13)%、B组为(84.57±2.76)%和C组为(86.14±4.06)%,A组细胞纯度均大于B、C组,差异均有统计学意义(P<0.05)。A组子宫内膜上皮细胞获得数量和纯度均高于其他两组,差异均有统计学意义(P<0.05)。结论0.125%胰蛋白酶消化子宫内膜组织结合100目滤网(150 μm)及400目(38 μm)滤网过滤,可以稳定地获得质量良好的子宫内膜上皮原代细胞。
子宫内膜;上皮细胞;细胞培养技术;胰蛋白酶
10.3969/j.issn.1009-5519.2016.11.002
A
1009-5519(2016)11-1606-03
子宫内膜上皮细胞是胚胎着床最先接触的部位,也是妇女月经周期变化的基础。对子宫内膜组织及细胞的研究是深入了解妇科疾病发病机制的重要手段,但由于临床患者妇科疾病的特点及医学伦理学的限制,子宫内膜组织来源有限,单纯临床研究受到很大限制,所以子宫内膜上皮细胞培养是研究子宫内膜功能和基因调控的重要辅助手段。而人子宫内膜上皮细胞原代培养一直存在材料标本容易污染,细胞分离困难、纯度低、生长缓慢及传代效果不良等诸多问题[1]。最常见的子宫内膜上皮细胞分离培养方法主要有酶消化、筛网过滤/离心等。酶消化分离纯化方法有胶原酶消化后分离纯化上皮细胞[2]或多种消化酶联合使用,如胶原酶、胰酶或分支酶按配方使用[3],但试剂具有较昂贵、上皮细胞收获小及间质细胞多等缺点,筛网过滤有不同孔径规格,需要配合优化使用,而离心法相对要复杂一些。本文将从人子宫内膜的取材、细胞分离、纯化及培养等方面进行一些改良,从而获得较为满意的原代子宫内膜上皮细胞,经过培养和纯化的子宫内膜上皮细胞可为下一步的细胞生长、分化、代谢及鉴定等实验打下良好基础。
1 材料与方法
1.1材料
1.1.1标本来源选择2014年7月1日至2014年9月30日在广西医科大学第一附属医院生殖中心就诊需行诊断性清宫术的21例患者作为研究对象,所有患者诊断取材均进行谈话、详细交代手术及实验过程,并签订同意书。组织标本部分送病理检查,经病理组织学检查确定,其中增生期15例,分泌期6例。剩余子宫内膜标本经过整刮取材,去除大块血块及组织黏液,置专用细胞培养液中于4℃保存,30 min内直接送实验室做进一步处理。
1.1.2试剂PRMI1640培养基(Gibco公司),胰蛋白酶(Sigma公司),四季青牌胎牛血清(天杭生物科技股份有限公司),鼠抗人角蛋白抗体(Abcam公司),链霉素-生物素-过氧化物酶标记羊抗鼠试剂盒(北京中杉公司),CO2培养箱(Thermo),超净工作台(苏州净化公司)。
1.2方法
1.2.1人子宫内膜上皮细胞分离和纯化人子宫内膜组织标本进入实验室后,余下所有细胞培养实验均在细胞培养室完成,严格按照细胞培养常规操作流程完成。首先予以0.01 mol/L磷酸盐缓冲溶液(PBS)反复冲洗,再去除一些小的血块和黏液。转入清洁灭菌小瓶,将子宫内膜组织剪碎成约1 mm3大小组织块,按照实验分组给予一定浓度胰蛋白酶或胶原酶,在37℃下消化2~4 h,期间间隔1~5 min吹打组织1次,保证消化、分离细胞充分。根据预实验和参照文献[4]按照消化子宫内膜组织的胰蛋白浓度分组,具体如下:0.125%胰蛋白组(A组)7例(增生期5例,分泌期2例),消化时间 2~4 h;0.250%胰蛋白组(B组)7例(增生期6例,分泌期1例),消化时间2~4 h;1 mg/mL胶原酶组(C组)7例(增生期4例,分泌期3例),消化时间为1 h。以胎牛血清终止消化后,1000r/min离心,弃上清液,三组均再将沉淀分别予以100目滤网(150μm)及400目(38μm)滤网充分过滤。
1.2.2人子宫内膜上皮细胞培养培养液反复冲洗400目(38 μm)过滤网,其中剩下的组织细胞团大部分为上皮细胞团,初步细胞计数后按每毫升5×106个细胞密度将其接种于6孔细胞培养板,需进行免疫组化等检查的孔内置放小玻璃片,于37℃、5%CO2培养箱中培养。
1.2.3培养液选择使用改良的专用上皮细胞培养液(PRMI1640培养基),加入15%胎牛血清和0.5 mL青霉素-链霉素双抗。每天观察细胞生长情况,定期换液。
1.2.4人子宫内膜上皮细胞传代倒置显微镜观察培养孔细胞生长到密度约90%时可以进行细胞形态总结和纯度检测。
1.2.5子宫内膜上皮免疫组化检查当细胞基本长满后取出盖玻片,以0.01 mol/L PBS洗涤2次,用多聚甲醛固定后,使用鼠抗人细胞角蛋白一抗作用,并设阴性对照(PBS)(4℃过夜),使用链霉素-生物素-过氧化物酶标记羊抗鼠试剂盒进行实验,再用苏木素复染。细胞质被染成棕黄色的细胞为阳性细胞。三组每张片取10个不同的视野进行计数,统计上皮细胞和间质细胞的比例。
1.3统计学处理应用SPSS16.0统计软件进行数据分析,计量资料以x±s表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1细胞培养结果细胞培养成功19例,A组子宫内膜组织污染1例。C组因细胞量过少接种失败1例。细胞获得后种板前进行上皮细胞团百分比计算,A组为(85.71±1.38)%、B组(75.28±1.50)%和C组为(84.86± 2.34)%,其中A组和C组的上皮细胞百分比高于B组,差异均有统计学意义(P<0.05)。上皮细胞生长贴壁较慢,铺满6孔板需要3 d左右,而间质细胞贴壁生长快,接种后0.5 h就可贴壁,生长迅速,若上皮细胞纯度不够,间质细胞可严重干扰子宫内膜上皮细胞生长。
2.2人子宫内膜上皮细胞鉴定细胞形态学特征上皮细胞呈现多角形或蝌蚪形,成团或漩涡状排列。细胞质成细颗粒状、核大、核仁明显。免疫组织化学鉴定:腺体细胞团角蛋白染色为棕色颗粒,即为阳性细胞。见图1~6。
2.3细胞纯度检验培养子宫内膜细胞辣根过氧化物酶底物显色(ABC法)进行免疫组化检查,腺体细胞团角蛋白染色为棕色颗粒,计算10个视野中上皮细胞和间质细胞的比例。各组上皮细胞纯度检测:A组为(90.28± 2.13)%、B组(84.57±2.76)%和C组(86.14±4.06)%,A组细胞纯度均高于B、C组,差异均有统计学意义(P<0.05)。见图1、2、3。
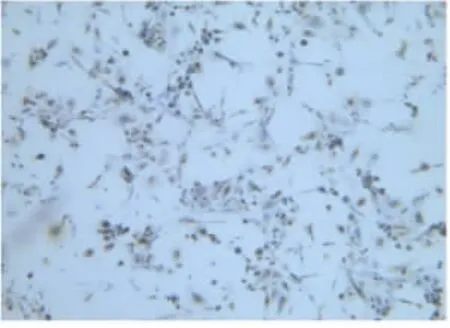
图1 子宫内膜原代上皮细胞A组(100×)

图2 子宫内膜原代上皮细胞B组(100×)
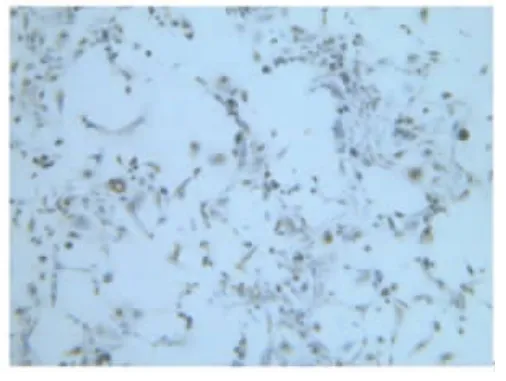
图3 子宫内膜原代上皮细胞C组(100×)
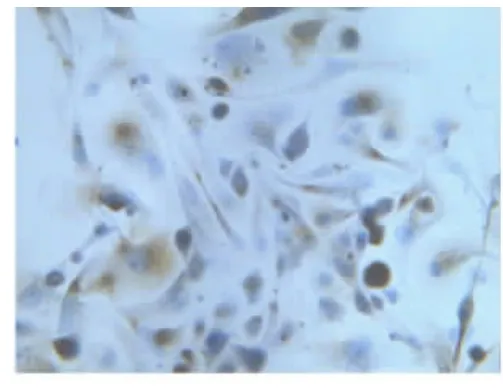
图4 子宫内膜原代上皮细胞A组(400×)

图5 子宫内膜原代上皮细胞B组(400×)
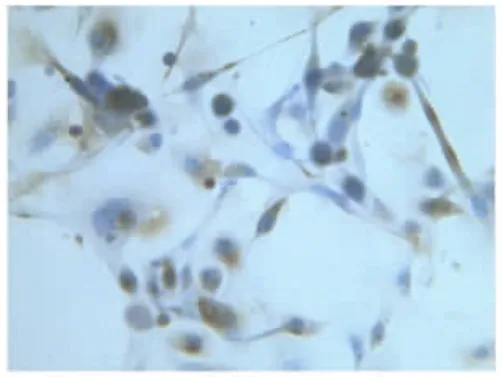
图6 子宫内膜原代上皮细胞C组(400×)
3 讨 论
子宫内膜上皮细胞培养技术是研究子宫内膜结构和功能的基础方法之一,获得较高纯度的原代上皮细胞有许多方法,但对于子宫内膜上皮细胞体外培养体系尚有很多亟待解决的问题。其中消化酶的选择就有多种,早在20世纪90年代就有胰蛋白酶使用的相关报道[5]。胰蛋白酶消化能力较强,因而较多地在细胞传代中使用。胰蛋白酶是专一作用于有碱性氨基酸——精氨酸及赖氨酸羧基所组成的肽键,具有较强的消化分离细胞的能力,是一种有利于分解上皮细胞间较多的紧密连接方式[6]。分析胰蛋白酶在人子宫内膜上皮细胞培养中可行原因如下:(1)子宫内膜上皮细胞成团状,抗胰酶消化能力强,团块中间的上皮细胞不易受到胰酶的消化、损害。(2)子宫内膜组织基质细胞丰富,且容易分散,而上皮细胞较少,成团块,较难分散,2种细胞特性差异较大。基质细胞承担了大部分的胰酶消化能力,有利于保护上皮细胞,同时通过胰酶的强消化能力可以减少基质细胞的数量,有利于细胞的纯化。(3)子宫内膜上皮细胞存在较多的紧密连接,不容易被分离,需要使用消化能力较强的酶。本实验根据子宫内膜上皮细胞的特点对胰蛋白酶的作用进行重点改进,主要是浓度调整、结合不同孔径滤网过滤,以获得最佳质量的子宫内膜上皮细胞。其中A组0.125%胰蛋白酶消化子宫内膜组织,同时辅助100目滤网(150 μm)及400目(38 μm)滤网过滤来获得子宫内膜上皮细胞的方法经济实用,且不易出现过度消化的现象,这与相关报道结果相似[7-8]。
在子宫内膜上皮细胞培养中分离细胞的数量是关键,细胞数太少容易引起种细胞失败,细胞数太多可出现分离的细胞纯度下降,所以要根据不同子宫内膜组织量和消化个体差异,选择不同的酶消化时间,既要充分消化,又要避免过度消化[9]。本实验根据情况选择2~4h,且需及时调整。
团块状分布的上皮细胞和间质细胞的分离根据上皮细胞和间质细胞的特性,上皮细胞容易成团分布,而间质细胞分散分布,上皮细胞贴壁慢,而间质细胞贴壁快,所以在用胰蛋白酶消化后需要使用一定孔径的筛网进行过滤。但分离的孔径和次数需要经过探索,Sinha等[10]认为使用75 μm滤网一次过滤即可以获得较多的间质细胞,但上皮细胞较少。有文献报道了38 μm滤网在子宫内膜细胞培养方面的作用[11-13],本实验使用150 μm和38μm 2种孔径滤网进行子宫内膜上皮细胞分离和培养,取得较好的子宫内膜上皮细胞数量和纯度。150 μm用来除去血块黏液杂质和没有起作用的消化大细胞组织团块,38 μm用来分离子宫内膜上皮细胞和基质细胞,从而达到较为满意的效果。
在获得子宫内膜上皮细胞的质量比较中,本研究发现,A组子宫内膜上皮细胞的质量最好、纯度高,细胞培养密度均匀,见图1、4。提示0.125%胰蛋白酶的良好消化作用,在细胞消化中掌握好消化时间,结合滤网过滤可以取得良好的细胞培养效果。
在细胞培养液的选择方面,由于子宫内膜上皮细胞生长比较缓慢,需要使用改良专用细胞培养液,除了在培养基选择方面使用有利于上皮细胞生长的PRMI1640培养基外,还需要对胎牛血清浓度进行调整。本研究中加大了胎牛血清的浓度,在普通细胞培养的10%的基础上加大了5%,给予细胞更充分的营养支持,使用发现上皮细胞生长较好,而并不会对后继实验造成影响[14]。
在防止细胞及取材污染方面,组织或细胞受到污染就意味着整个实验的失败,所以需要严格进行操作。在组织取材中,首先要进行仔细的外阴皮肤及阴道消毒准备,动作轻柔,严格按照无菌操作要求进行,取得组织材料后要及时送检,4℃保存,取材组织器材和装组织的材料要进过高压灭菌消毒[15]。本研究中仅1例标本污染,事后分析是当时时间较紧、装组织材料的小瓶消毒不严格、送检时间偏长所致,因此后续研究时需注意。
综上所述,取材前严格无菌准备器械和材料,使用0.125%胰蛋白酶消化加150 μm和38 μm孔径滤网过滤可以获得较多的上皮细胞,同时适当提高培养液的胎牛血清浓度有利于建立稳定的原代子宫内膜上皮细胞培养体系。
[1]Segerer SE,Martignoni F,Bogdan A,et al.Thrombopoietin modulates the proliferation,migration and cytokine profile of decidual cell subsets during early gestation[J].Mol Hum Reprod,2013,19(6):361-368.
[2]王海燕,薛晓鸥,姜恩魁,等.人子宫内膜腺上皮细胞及基质细胞分离方法的研究[J].锦州医学院学报,2003,24(4):36-39.
[3]张玮,李静辉,王秀霞.血小板源性生长因子-BB及肝细胞生长因子对体外培养子宫内膜腺上皮细胞增殖及整合素αBβ3表达的影响[J].中国实用妇科与产科杂志,2013,29(6):454-458.
[4]Ryan IP,Schriock ED,Taylor RN.Taylor isolation,characterization,and comparison of human endometrial and endometriosis cells in vitro[J].J Clin Endocrinol Metab,1994,78(3):642-649.
[5]曾卫,封志纯.人子宫内膜细胞的体外培养技术及鉴定[J].中国现代医学杂志,1999,9(6):11.
[6]Kim NS,Yu HY,Chung ND,et al.High-level production of recombinant trypsin in transgenic rice cell culture through utilization of an alternative carbon source and recycling system[J].Enzyme Microb Technol,2014,63:21-27.
[7]Wang Y,Tan ZB,Qin LM,et al.Simplified protocol for isolation of multipotential NG2 cells from postnatal mouse[J].J Neurosci Methods,2013,219(2):252-261.
[8]靳辉,杨蓬勃,冯改丰,等.胰蛋白酶消化强度优化获得高纯度体外培养的星形胶质细胞[J].生理学报,2015,67(1):103-109.
[9]Manjusha K,Jayesh P,Jose D,et al.Alkaline protease from a non-toxigenic mangrove isolate of Vibrio sp.V26 with potential application in animal cell culture[J].Cytotechnology,2013,65(2):199-212.
[10]Sinha S,Dovey HF,Seubert P,et al.The protease inhibitory properties of the Alzheimer′s beta-amyloid precursor protein[J].J Biol Chem,1990,265(16):8983-8985.
[11]杨晓清,张沐,唐小军,等.人子宫内膜细胞的纯化、培养方法的改进及细胞保存[J].江苏医药,2012,38(4):389-392.
[12]鲍远红,王秀霞.一种新的子宫内膜腺上皮细胞和基质细胞的分离纯化及培养方法的探讨[J].中国医科大学学报,2007,36(5):608-610.
[13]Arnold JT,Kaufman DG,Seppala M,et al.Endometrial stromal cells regulate epithelial cell growth in vitro:a new co-culture model[J].Hum Reprod,2001,16(5):836-845.
[14]Reinhardt CD,Lee TL,Thomson DU,et al.Restricted nutrient intake does not alter serum-mediated measures of implant response in cell culture[J]. J Anim Sci Biotechnol,2013,4(1):45.
[15]谢润桂,林洋洋,娄季武,等.240例绒毛细胞培养过程中的母体细胞污染情况分析[J].广东医学院学报,2015,33(1):108-110.
Study on culture technology of human endometrial epithelial cells by optimizing trypsin digestion intensity*
Xie Wei1,
Qin Wen2,Jiang Lingyun1,Mo Fuhua1,Zhu Shimin3,Gu Keying3,Luo Yuanfu3,Qin Aiping1△(1.Reproduction Center,First Affiliated Hospital of Guangxi Medical University,Nanning,Guangxi 530021,China;2.Department of Pathology,First Affiliated Hospital ofGuangxiMedicalUniversity,Nanning,Guangxi530021,China;3.GuangxiMedicalUniversity,Nanning,Guangxi530021,China)
ObjectiveTo investigate an optimized and improved culture technology of primary human endometrial epithelial cells.MethodsTwenty-one patients undergoing diagnostic uterine curettage from July 1 to September 30,2014 were divided into the 0.125%trypsin group(A),0.250%trypsin group(B)and 1mg/mL collagenase group(C).Meanwhile 100-mesh strainer(150 μm)and 400-mesh strainer(38 μm)were used to separate the endometrial epithelial cells and interstitial cells.Then the cells purity and growth state were compared among various groups.ResultsNineteen cases succeeded in the endometrial epithelial cell culture.One case in the group A was contaminated by endometrial tissues,1 case in the group C failed in the inoculation due to too little cell amount.In conducting the epithelial cell cluster percentage calculation after obtaining cells and inoculating,the group A was(85.71±1.38)%,group B was(75.28±1.50)%and group C was(84.86±2.34)%,in which the percentage of epithelial cells in the group A and C was higher than that in the group B,and the difference was statistically significant(P<0.05).After the cells basically overspread the culture holes by 3-5 d of cell culture,the purity was detected by using the immunohistochemistry ABC method,the group A was(90.28±2.13)%,group B was(84.57±2.76)%and group C was(86.14±4.06)%.The purity of the group A was higher than that of the group B and C,and the difference had statistic significance(P<0.05).The acquired endometrial epithelial cells amount and purity in the group A were higher than those in the other two groups,the difference was statistically significant(P<0.05).Conclusion0.125%trypsin digesting endometrial tissues and combining with the filtration by 100-mesh strainer(150 μm)and 400-mesh strainer(38 μm)can stably acquire good-quality primary endometrial epithelial cells.
Endometrium;Epithealial cells;Cell cutture techniques;Trypsin
广西优秀博士论文培养计划资助项目(YCBZ2014033)。
谢伟(1977-),副主任医师,主要从事生殖医学方面的工作。
△
,E-mail:fenglingcao1980@163.com。
(2016-02-27)
