GANT61对食管鳞癌细胞上皮-间质转化作用的研究
2016-09-05杜媛鲲
王 雷,杜媛鲲,王 林,米 源,王 娜
(河北医科大学1.第四医院胸二科,石家庄050011;2.期刊社,石家庄050017;3.第四医院河北省肿瘤研究所分子生物室,石家庄050011)
GANT61对食管鳞癌细胞上皮-间质转化作用的研究
王雷1,杜媛鲲2,王林1,米源1,王娜3
(河北医科大学1.第四医院胸二科,石家庄050011;2.期刊社,石家庄050017;3.第四医院河北省肿瘤研究所分子生物室,石家庄050011)
目的研究GANT61对人食管鳞癌细胞OE21和KYSE-30的上皮-间质转化的影响,同时使用N-Shh蛋白刺激Hedgehog通路作为阳性对照,探讨GANT61抗肿瘤机制.方法实时荧光定量聚合酶链反应(PCR)法检测GANT61和N-Shh蛋白作用于OE21和KYSE-30细胞后G1i1、G1i2、N-cadherin和β-catenin基因变化;Western b1ot观察药物GANT61和N-Shh蛋白作用于OE21和KYSE-30细胞后对G1i1、G1i2、N-cadherin和β-catenin蛋白表达的影响.划痕愈合试验观察GANT61和N-Shh蛋白作用于OE21和KYSE-30细胞后对细胞迁移侵袭能力的影响.结果实时荧光定量PCR结果显示,GANT61可以下调OE21和KYSE-30的G1i-1、G1i-2、N-cadherin和β-cateninmRNA表达;Western b1ot显示GANT61可以下调OE21和KYSE-30的G1i1、G1i2、N-cadherin和β-catenin蛋白表达.划痕愈合试验显示GANT61导致OE21和KYSE-30细胞的迁移能力明显下降.应用N-Shh蛋白可以上调OE21和KYSE-30的G1i1、G1i2表达,N-cadherin和β-catenin表达,同时促进OE21和KYSE-30的迁移能力.结论GANT61通过下调Hedgehog信号转导通路中G1i1和G1i2的表达来影响食管鳞癌细胞上皮-间质转化能力,G1i可成为抑制食管鳞癌细胞转移新的有效的分子靶点.
食管鳞癌;Hedgehog信号通路;GANT61;G1i;上皮-间质转化
网络出版地址
食管癌是最具有侵袭性的恶性肿瘤之一[1].我国是全球食管癌发病率和病死率最高的国家,每年因食管癌死亡病例超过15万例,其中食管鳞癌占新发病例的90%.食管癌发病隐匿,多数患者确诊时肿瘤已经浸润转移,传统的放化疗效果欠佳,因此找到参与食管鳞癌发生发展的主要因子或信号传导通路,对食管鳞癌的防治和预后将具有重要的意义.近年来研究[2~5]发现异常激活的Hedgehog(Hh)信号通路对肺癌、肠癌、淋巴瘤、胰腺癌等多种肿瘤的发生发展和恶性生物学特性的维持起着关键作用.Hh信号传导通路主要包括上游Hh配体、Patched受体、Smoothened蛋白和下游核转录因子G1i以及目的基因等,其中G1i在其通路中起到核心调控作用.
上皮-间质转化(epithe1ia1 mesenchyma1 transition,EMT)是一个多步骤、多基因和多阶段的复杂过程,是指上皮细胞在形态学上发生向间质细胞表型的转变并获得迁移的能力.这种转化过程使上皮来源的恶性肿瘤细胞获得迁移和侵袭能力,是肿瘤复发和转移的一个重要分子基础[6].目前研究显示食管鳞癌组织中存在上游Hh配体异常活化的状态,但是关于食管鳞癌细胞中G1i的异常活化和EMT是否存在关系以及如何调控的相关机制目前国内外报道极少,本研究通过应用G1i的特异性抑制剂GANT61抑制人食管鳞癌细胞系OE21和KYSE-30中的G1i的表达,观察其调控EMT的影响,为食管鳞癌的靶向治疗提供新思路.
1 材料与方法
1.1材料
1.1.1试剂:人食管鳞癌细胞系OE21和KYSE-30由河北省肿瘤研究所提供,F12(Ham)液体培养基(武汉博士德生物工程有限公司),RPMI1640培养液(美国Gibco公司),胰酶(美国Gemini公司),胎牛血清(美国Gemini公司),GANT61(美国Se11eckchem公司),N-Shh蛋白(美国Ebioscience公司),总RNA提取试剂盒(德国Qiagen公司),cDNA合成试剂盒(美国Bio-Rad公司),Taqman基因表达预混液(美国App1ied Biosystems公司),G1i1引物和探针(Hs00171790,美国Life Techno1ogies公司),G1i2引物和探针(Hs01119974_m1,美国Life Techno1ogies公司),N-cadherin(Hs00983056_m1,美国Life Techno1ogies),β-catenin(Hs00355049_m1,美国Life Techno1ogies),GAPDH(Hs02758991_g1,美国Life Techno1ogies公司),Pierce-BCA蛋白分析试剂盒(美国Thermo Scientific公司),M-PER培养细胞总蛋白提取试剂(美国Thermo Scientific公司),蛋白酶抑制剂(德国Roche公司),G1i1兔抗人单克隆抗体(ab49314,美国Abcam公司),G1i2鼠抗人单克隆抗体(sc271786,美国Santa Cruz公司),N-cadherin兔抗人单克隆抗体(sc-7939,美国Santa Cruze公司),βcatenin鼠抗人单克隆抗体(ab92547,美国Abcam公司),GAPDH鼠抗人单克隆抗体(sc32233,美国Santa Cruz公司),Mini-PROTEAN TGX预制胶(美国Bio-Rad公司),Tris/甘氨酸/电泳缓冲液(美国Bio-Rad-公司),Tris/甘氨酸缓冲液(美国Bio-Rad公司).
1.1.2主要仪器:NanoDrop 8000全光谱紫外-可见光分光光度计(美国Thermo Scientific公司),ABI 7900HT高通量荧光定量PCR仪(美国App1ied Biosystems公司),Veriti®96-We11 Therma1 Cyc1er(美国App1ied Biosystems公司).
1.2方法
1.2.1细胞培养:细胞于37℃、5%CO2培养箱中孵育,OE21细胞培养于RPMI 1640培养液(含10%胎牛血清,青-链霉素各100 mg/mL)中,KYSE-30细胞培养于F12(Ham)和RPMI 1640培养液(1∶1)(含2%胎牛血清,青-链霉素各100 mg/m)中.
1.2.2实时荧光定量PCR法:将培养瓶中的细胞用0.25%胰酶消化,计数后按每孔0.1X106铺于12孔板,第2天细胞培养至70%~80%融合时,换无血清培养基并加入GANT61(10 μmo1/L),同时设N-Shh蛋白组(0.5 mg/mL)和空白对照(DMSO)组,24 h后按照总RNA提取试剂盒说明书提取各组RNA,用NanoDrop 8000全光谱紫外-可见光分光光度计检测RNA浓度,采用美国Bio-Rad公司的反转录cDNA合成试剂盒(iScript cDNA Synthesis Kit)和Veriti®96-We11 Therma1 Cyc1er仪器进行cDNA反转录,反转录条件为25℃5 min,42℃30 min和85℃5 min.将反转录得到的cDNA用无RNase水稀释10倍后按照cDNA4.5 μL、Taqman基因表达预混液5 μL以及G1i1、G1i2、N-cadherin、β-catenin GAPDH各自的引物和探针0.5 μL共10 μL/孔反应体系加样于384孔板,应用ABI 7900HT高通量荧光定量PCR仪进行PCR检测,PCR反应条件为95℃10 s,60℃10 s, 72℃10 s,共40个循环.读取CT值后以GAPDH的CT值作为内参,采用2-ΔCt法进行数据分析.
1.2.3Western b1ot:将培养瓶中的细胞用0.25%胰酶消化,计数后按每孔0.3X106铺于6孔板,第2天细胞培养至70%~80%融合时换无血清培养基时加入GANT61(10 μmo1/L),同时设N-Shh蛋白组(0.5 mg/mL)和DMSO组,24 h后用PBS洗涤3次细胞后加细胞蛋白提取液和蛋白酶抑制剂,收集每孔蛋白液后用BCA法测定蛋白浓度.在Mini-PROTEAN TGX预制胶中以每泳道10 μg行蛋白上样,在电泳槽中经Tris/甘氨酸/电泳缓冲液SDS进行电泳使不同KD的蛋白分离,电泳条件200 V,40 min.电泳结束后在Tris-甘氨酸缓冲液中将蛋白电转移印迹到PVDF膜上,实验条件100 V,40 min.用5%脱脂奶粉/TBST液封膜1 h,一抗G1i1工作浓度为1∶1 000,一抗G1i2工作浓度为1∶250,一抗N-cadherin工作浓度为1∶250、一抗β-catenin工作浓度为1∶5 000,一抗GAPDH工作液浓度为1∶10 000,4℃过夜,第2天TBST洗膜3次,每次10 min,室温孵育二抗1 h,羊抗兔或羊抗鼠二抗工作浓度均为1∶20 000,ECL试剂发光5 min后于暗室经X线曝光显影.
1.2.4划痕愈合试验:于6孔板中培养细胞呈70%~ 80%融合生长时换无血清培养基,加入浓度为10 μmo1/L的GANT61处理24 h,同时设N-Shh蛋白组(0.5 mg/mL)和DMSO组,于各组的单细胞层上用200 μL的枪头划痕,继续培养细胞.于划痕后0 h和24 h在显微镜下组取4个视野拍照,用Image软件测量0 h和24 h划痕宽度的变化,用闭合率代表各组的细胞侵袭迁移能力,闭合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度X 100%.
1.3统计学方法
实验数据采用SPSS 17.0统计软件进行处理,采用One-way AVONA检验方法.P<0.05为差异有统计学意义.
2 结果
2.1实时荧光定量PCR结果
GANT61作用于OE19细胞24 h后导致G1i-1 mRNA(P=0.005)、G1i2 mRNA(P=0.004)、N-cadherin(P=0.000)、β-catenin(P=0.000)表达水平显著低于DMSO组;与DMSO组相比,N-Shh蛋白可以上调G1i1 mRNA(P=0.000)、G1i2 mRNA(P= 0.003)、N-cadherin(P=0.004)、β-catenin(P= 0.001);GANT61作用于KYSE-30细胞24 h后导致G1i1 mRNA(P=0.005)、G1i2 mRNA(P=0.000)、N-cadherin(P=0.021)、β-catenin(P=0.000)的表达水平显著低于DMSO组;与DMSO组相比,N-Shh蛋白可以上调G1i1 mRNA(P=0.004)、G1i2 mRNA(P= 0.000)mRNA、N-cadherin(P=0.002)、β-catenin(P= 0.01),差异有统计学意义,见图1.
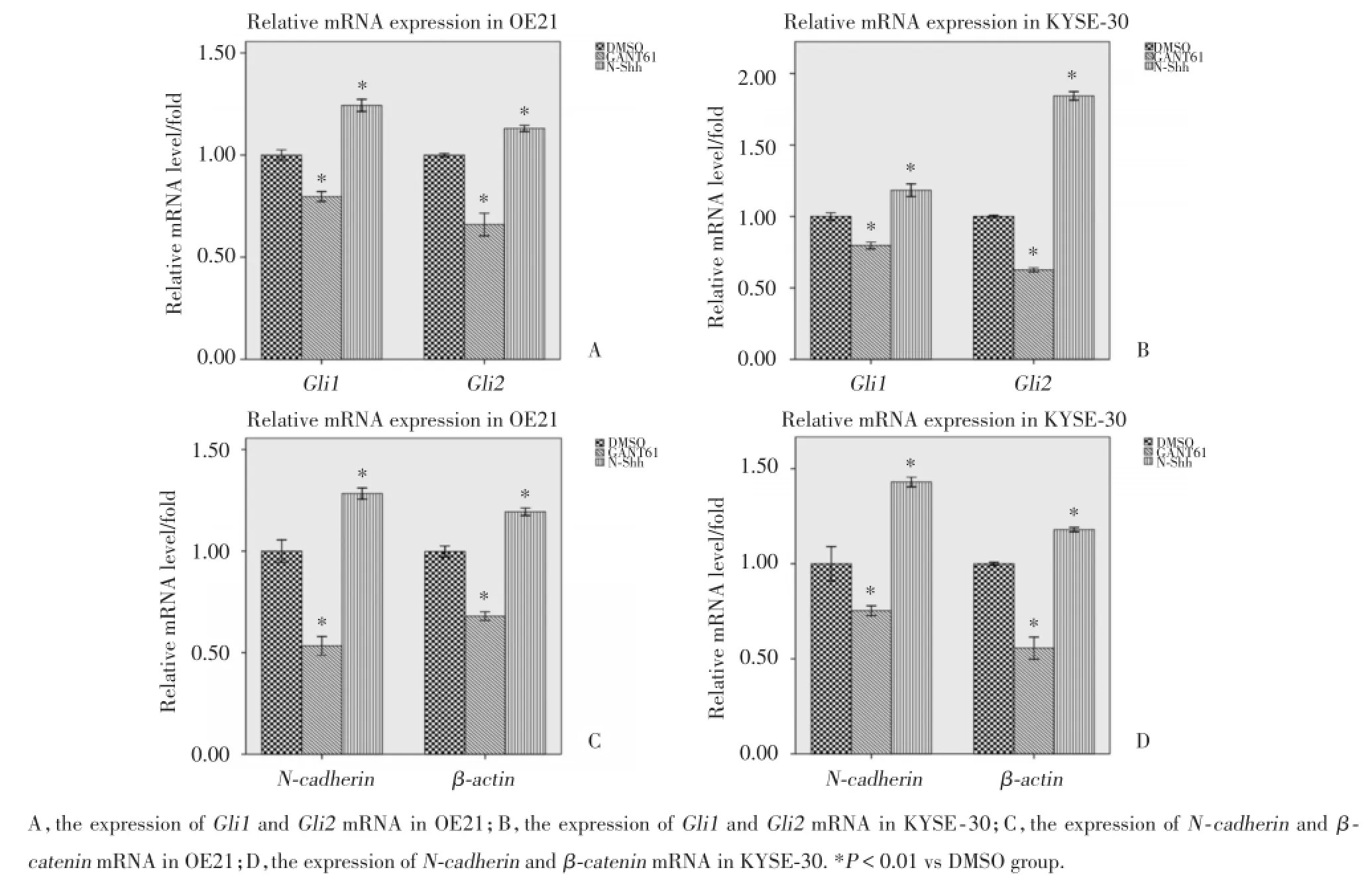
图1 实时荧光定量PCR法检测GANT61和N⁃Shh处理后OE21和KYSE⁃30细胞的m RNA水平Fig.1 m RNA level after treated by GANT61 or N⁃Shh as detected by real time PCR in OE21and KYSE⁃30 cell lines
2.2 Western b1ot结果
GANT61作用于OE21细胞24 h后G1i1、G1i2、N-cadherin和β-catenin蛋白表达量显著低于DMSO,而内参GAPDH蛋白表达无明显变化;GANT61作用于KYSE-30细胞后G1i1、G1i2、N-cadherin和β-catenin蛋白表达显著低于DMSO,内参GAPDH蛋白表达无明显变化;N-Shh蛋白作用于OE21和KYSE-30后G1i1、G1i2、N-cadherin和β-catenin蛋白表达显著高于DMSO,见图2,图3.
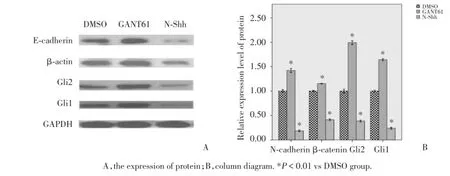
图2 W estern blo t方法检测GANT61和N⁃Shh处理后OE21细胞的的蛋白表水平Fig.2 The protein expression after treated by GANT61 or N⁃Shh as detected by Western blot assay in OE21 cell line
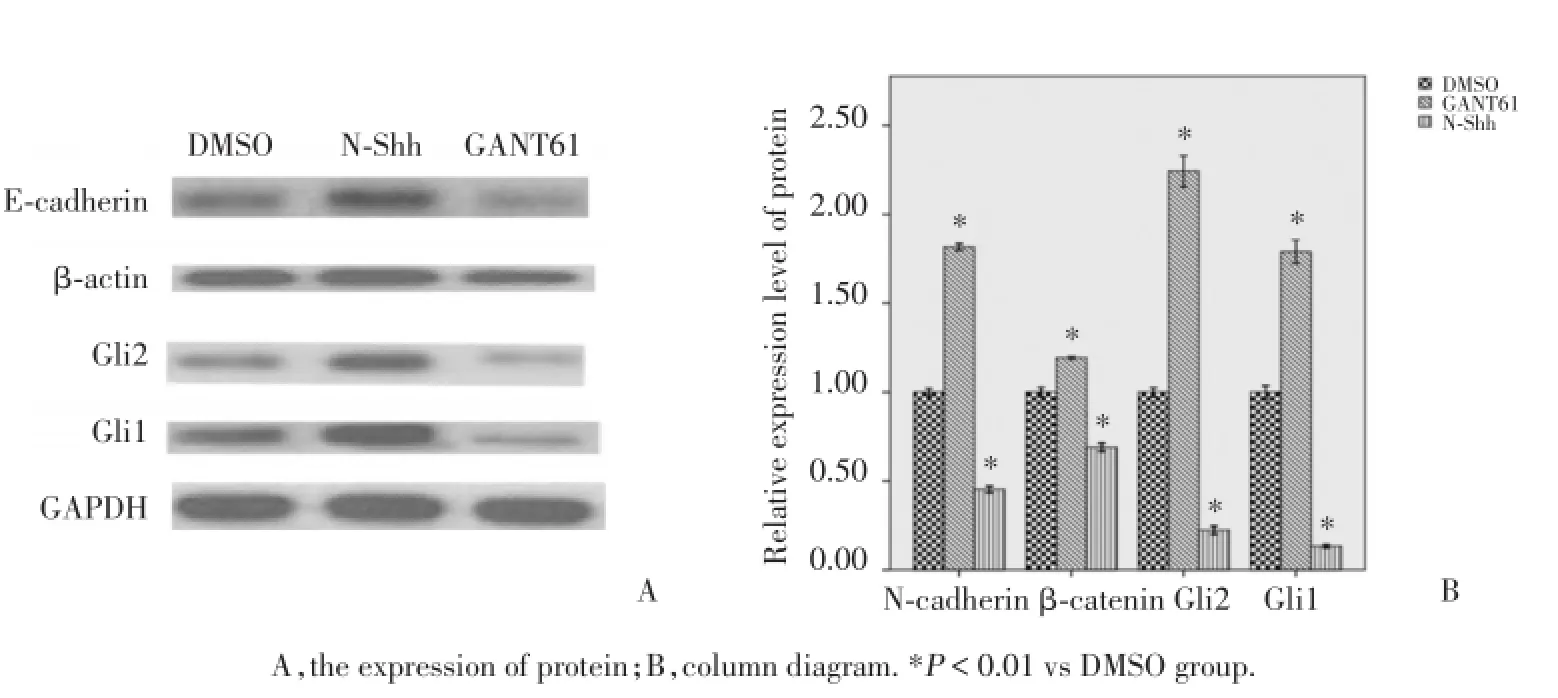
图3 W estern blo t方法检测GANT61和N⁃Shh处理后KYSE⁃30细胞的的蛋白表达水平Fig.3 The protein expression after treated by GANT61 or N⁃Shh as detected by Western blot assay in KYSE⁃30 cell line
2.3划痕愈合实验
应用GANT61处理24 h后,OE21的侵袭迁移能力明显受到抑制,所得数据经标准化处理后闭合率为DMSO组的46%,差异有统计学意义(P=0.000); N-Shh蛋白可以增加OE21的侵袭迁移能力,闭合率为DMSO组的120.67%,差异有统计学意义(P= 0.003).KYSE-30细胞处理组闭合率为DMSO组的54%,与DMSO组相比差异具有统计学意义(P= 0.000);N-Shh蛋白可以增加侵袭迁移能力,闭合率为DMSO组的141.33%,差异有统计学意义(P= 0.000),见图4.
3 讨论
食管癌的发生发展是一个多因素、多步骤的过程,与一些信号传导通路的异常激活密切相关.经典的Hh信号传导通路是过度表达的Hh结合跨膜受体Ptch后释放了Ptch介导抑制的Smo受体,激活的Smo继续活化G1i进入细胞核内促进Hh通路下游靶基因的转录.但是由于Hh/Smo和TGFb、EGFR、RAS和AKT/PI3K等一些肿瘤信号通路之间存在交叉传导,导致G1i存在不依赖Hh激活的状态[7,8],因此近年来研发的针对Hh通路上游靶点Smo的小分子靶向药物Vismodegib[9],cyc1opamine[10]只能用于治疗Hh通路的激活发生在Smo或其上游水平的肿瘤,而对其下游通路的激活所导致的肿瘤无效,所以有必要进一步发掘更具特异性和高效的治疗靶点. G1i家族在Hh通路中起着核心作用,而且GANT61作为新研制的针对G1i1和G1i2靶点的Hh通路抑制剂在治疗神经母细胞瘤[11]、粒细胞性白血病[12]、肠癌[3]等多种肿瘤显示了良好的抗肿瘤效应,所以本研究从GANT61调控食管癌的G1i表达入手,探讨了G1i表达和食管鳞癌细胞EMT的关系.
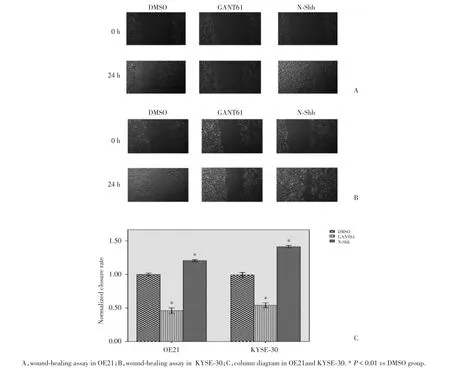
图4 划痕愈合实验检测GANT61和N⁃Shh处理后OE21和KYSE⁃30细胞的划痕闭合率Fig.4 Wound⁃closure rates after treated by GANT61 or N⁃Shh as detected by Wound⁃healing assay in OE21and KYSE⁃30 cell lines
EMT是肿瘤细胞迁移、浸润及转移过程中的重要调控事件[13],是近年来抗肿瘤领域研究热点之一.N-cadherin是钙黏附家族的主要成分之一,被认为是间充质细胞的标记,在上皮细胞来源的肿瘤中N-cadherin的高表达是EMT的重要特征之一,与肿瘤生长侵袭和淋巴转移密切相关[14].β-catenin也是EMT的生物标记物之一[15],它可以和LEF-1形成复合物去抑制E-cadherin的转录以及促进EMT[16].本研究结果显示GANT61可以明显下调OE21和KYSE-30细胞的G1i1、G1i2基因和蛋白表达,并且GANT61处理组N-cadherin和β-catenin基因和蛋白水平显著低于DMSO组,同时为了刺激食管鳞癌细胞中Hh通路,本研究在实验中同时应用了N-Shh蛋白,结果发现N-Shh可以上调G1i1和G1i2表达以及N -cadherin和β-catenin蛋白表达,细胞迁移实验证实刺激Hh通路可以促进肿瘤细胞的侵袭能力,而应用GANT61后可以抑制肿瘤细胞的迁移能力.分析其原因可能是G1i通过上调N-cadherin和β-catenin表达诱导EMT进程,而GANT61通过特异性抑制G1i1和G1i2的表达从而下调食管癌EMT过程,降低癌细胞侵袭转移能力.
总之,因为EMT的发生涉及多种信号转导通路,与转录因子及肿瘤微环境等多因素有关,信号通路的关键组分可成为治疗食管癌的潜在靶点.因为食管癌存在上皮-间质转换,临床上常伴有淋巴结转移和血管浸润现象,常规的手术和放、化疗并没有最终解决食管癌转移和复发的问题,导致5年生存率多年徘徊在30%左右.本研究通过发现GANT61可以靶向性抑制G1i1和G1i2的表达从而调控食管癌细胞的EMT过程,为食管鳞癌的靶向治疗提供新思路,期待G1i成为新的肿瘤治疗靶点.
[1]Jema1 A,Siege1 R,Xu J,et a1.Cancer statistics,2010[J].CA Cancer J C1in,2010,60(5):277-300.
[2]Bermudez O,Hennen E,Koch I,et a1.G1i1 mediates 1ung cancer ce11 pro1iferation and Sonic Hedgehog-dependent mesenchyma1 ce11 activation[J].PLoS One,2013,8(5):e63226.
[3]Mazumdar T,Sandhu R,Qadan M,et a1.Hedgehog signa1ing regu-1ates te1omerase reverse transcriptase in human cancer ce11s[J]. PLoS One,2013,8(9):e75253.
[4]Hou X,Chen X,Zhang P,et a1.Inhibition of hedgehog signa1ing by GANT58 induces apoptosis and shows synergistic antitumor activity with AKT inhibitor in acute T ce11 1eukemia ce11s[J].Biochimie, 2014,101:50-59.
[5]Rodova M,Fu J,Watkins DN,et a1.Sonic hedgehog signa1ing inhibition provides opportunities for targeted therapy by su1foraphane in regu1ating pancreatic cancer stem ce11 se1f-renewa1[J].PLoS One, 2012,7(9):e46083.
[6]A1eskandarany MA,Negm OH,Green AR,et a1.Epithe1ia1 mesenchyma1 transition in ear1y invasive breast cancer:an immunohistochemica1 and reverse phase protein array study[J].Breast Cancer Res Treat,2014,145(2):339-348.
[7]Hui CC,Angers S.G1i proteins in deve1opment and disease[J].Annu Rev Ce11 Dev Bio1,2011,27(27):513-537.
[8]Lauth M,Toftgard R.Non-canonica1 activation of GLI transcription factors:imp1ications for targeted anti-cancer therapy[J].Ce11 Cyc1e, 2007,6(20):2458-2463.
[9]Li H,Lui N,Cheng T,et a1.G1i as a nove1 therapeutic target in ma-1ignant p1eura1 mesothe1ioma[J].PLoS One,2013,8(3):e57346.
[10]Yoshimoto AN,Bernardazzi C,Carneiro AJ,et a1.Hedgehog pathway signa1ing regu1ates human co1on carcinoma HT-29 epithe1ia1 ce11 1ine apoptosis and cytokine secretion[J].PLoS One,2012,7 (9):e45332.
[11]W ickstrom M,Dyberg C,Shimokawa T,et a1.Targeting the hedgehog signa1 transduction pathway at the 1eve1 of GLI inhibits neurob1astoma ce11 growth in vitro and in vivo[J].Int J Cancer,2013, 132(7):1516-1524.
[12]Pan D,Li Y,Li Z,et a1.G1i inhibitor GANT61 causes apoptosis in mye1oid 1eukemia ce11s and acts in synergy with rapamycin[J]. Leuk Res,2012,36(6):742-748.
[13]Yi1maz M,Christofori G.EMT,the cytoske1eton,and cancer ce11 invasion[J].Cancer Metastasis Rev,2009,28(1-2):15-33.
[14]Mosnier JF,Kande1 C,Caza1s-Hatem D,et a1.N-cadherin serves as diagnostic biomarker in intrahepatic and perihi1ar cho1angiocarcinomas[J].Mod Patho1,2009,22(2):182-190.
[15]Azmi AS.Unvei1ing the ro1e of nuc1ear transport in epithe1ia1-tomesenchyma1 transition[J].Curr Cancer Drug Targets,2013,13 (9):906-914.
[16]Kem1er R,Hierho1zer A,Kanz1er B,et a1.Stabi1ization of betacatenin in the mouse zygote 1eads to premature epithe1ia1-mesenchyma1 transition in the epib1ast[J].Deve1opment,2004,131 (23):5817-5824.
(编辑于溪)
GANT61 InhibitsEpithelial-mesenchymal Transition in EsophagealSquamousCarcinoma
WANGLei1,DUYuan-kun2,WANGLin1,MIYuan1,WANGNa3
(1.Department of Thoracic Surgery,the Fourth Hospita1 of Hebei Medica1 University,Shijiazhuang 050011,China;2.Hebei Medica1 University Journa1 Department, Shijiazhuang050017,China;3.DivisionofMo1ecu1arBio1ogy,HebeiCancer Institute,the Fourth Hospita1ofHebeiMedica1University,Shijiazhuang050011,China)
Objective To investigate the effect of GANT61 on epithe1ia1-mesenchyma1 transition in the human esophagea1 squamous carcinoma ce11 1ines OE21 and KYSE-30 and e1ucidate its mechanism.Simu1taneous1y N-Shh proteins were app1ied to stimu1ate the Hedgehog pathway so as to eva1uate theanti-tumorgenesiseffectofGANT61.Methods ThemRNA expression of G1i1 and G1i2weredetected after treatmentofGANT61 orNShh by rea1 time f1uorescence quantitative PCR.The protein expression of N-cadherin and β-catenin were observed after treatment by Western b1ot assay.Wound-hea1ing Assay was performed to assess the effect of GANT61 and N-Shh on migration.Results Rea1 time f1uorescence quantitative PCR revea1ed that GANT61 cou1d inhibit the mRNA expression of G1i1,G1i2,N-cadherin andβ-catenin in OE21 and KYSE-30 ce11 1ines.Western b1ot assay showed that GANT61 reduced the protein expression of G1i1、G1i2,N-cadherin and β-catenin in OE21 and KYSE-30 ce11 1ines.Compared with contro1 group,GANT61 dramatica11y inhibited the capabi1ity of migration in both OE21 and KYSE-30 by wound-hea1ing assay.N-Shh proteins cou1d increase ce11 migration and up-regu1ated G1i1 and G1i2,N-cadherin and β-catenin mean and protein expression in OE21 and KYSE-30 ce11 1ines.Conclusion GANT61 cou1d effective1y inhibit EMT in esophagea1 squamous carcinoma by diminishing the expression of G1i1 and G1i2.G1icou1d beanew and potentmo1ecu1artarget fortreating theesophagea1squamous carcinoma.
esophagea1 squamous carcinoma;Hedgehog signa1 transduction pathway;GANT61;G1i;epithe1ia1-mesenchyma1 transition
R665.3
A
0258-4646(2016)03-0249-05
10.12007/j.issn.0258-4646.2016.03.015
河北省科技厅科技计划(132077127D)
王雷(1976-),男,副教授,博士. E-mai1:yuankundu@163.com
2015-09-10
网络出版时间:
