补阳还五汤含药血浆和含药血清对氧剥夺大鼠脑微血管内皮细胞分泌NO、vWF、6-keto-PGF1α的影响及与体内实验的比较研究
2016-09-02罗银河葛金文刘林王国佐易亚乔廖君石咏梅
罗银河葛金文刘 林王国佐易亚乔廖 君石咏梅
补阳还五汤含药血浆和含药血清对氧剥夺大鼠脑微血管内皮细胞分泌NO、vWF、6-keto-PGF1α的影响及与体内实验的比较研究
罗银河1葛金文1刘 林2王国佐1易亚乔1廖 君1石咏梅1
(1湖南中医药大学,长沙,410208;2湖南中医药大学第一附属医院,长沙,410007)
目的:比较补阳还五汤含药血清和含药血浆对缺氧培养的大鼠脑微血管内皮细胞(BMECs)分泌NO、vWF、6-keto-PGF1α的水平与体内实验真实值的接近程度,为半体内实验选择含药血浆还是含药血清提供参考依据。方法:以氧剥夺BMECs模型为研究对象,观察补阳还五汤含药血浆和含药血清对BMECs条件培养液中一氧化氮(NO)、血管性假血友病因子(vWF)、6-酮-前列腺素1α(6-keto-PGF1α)含量的影响,并与补阳还五汤干预的中动脉阻塞模型大鼠血浆上述指标水平进行比较。结果:结果发现:与空白血浆组合空白血清组比较,补阳还五汤含药血浆和含药血清均能明显降低氧剥夺BMECs条件培养液中vWF的含量,升高NO、6-keto-PGF1α水平,差异均有统计学意义(P<0.05或P<0.01);含药血浆组vWF、6-keto-PGF1α水平与体内实验的相关系数r分别为0.928和0.933,明显高于含药血清组(r=0.715、0.770,P<0.05),而含药血浆组和含药血清组NO含量与体内实验相关系数分别为0.702、0.759,两者差异无统计学意义(P>0.05)。结论:运用半体内实验研究补阳还五汤对脑血管内皮细胞的作用,血浆药理学方法比血清药理学方法可靠。
血清药理学;血浆药理学;体内实验;一氧化氮(NO);血管性血友病因子(vWF);6-酮-前列腺素1α(6-keto-PGF1α)
一般认为,中药血清药理学方法可避免了中药复方制剂直接体外用药的一系列干扰因素,直接反映中药及其代谢产物的药理作用,提高中药药理研究的可信度[1-2]。但仍存在许多不足[3-6],我们对此进行了质疑[5-6],并提出建立血浆药理方法,加强多层次半体内实验研究。已有学者[7]通过含药血浆和含药血清平行观察,发现含药血浆作用更优于含药血清;也有学者[8]研究发现在不同浓度给药条件下和不同采血时间条件下,血浆药理学方法得到的量-效曲线和时-效曲线更符合药效学和药动学规律,能更好地再现药物在体内环境中产生的药理效应。但是在半体内实验研究中,对于检测不同的指标,是选择含药血浆还是含药血清还没有相关报道。因此,有必要通过观察不同的检测指标,比较评价血浆药理学方法和血清药理学方法与体内实验效应的一致性。鉴于此,本试验比较补阳还五汤含药血清和含药血浆对氧剥夺大鼠脑微血管内皮细胞(BMECs)分泌NO、vWF、6-keto-PGF1α的影响,并与体内实验真实值的接近程度进行分析,为中药复方血浆药理学方法的选择提供参考依据。
1 材料与方法
1.1实验材料
1.1.1实验药物 补阳还五汤(生黄芪120 g,当归尾6 g,赤芍5 g,地龙、桃仁、红花、川芎各3 g)出自《医林改错》。中药饮片购自湖南中医药大学第一附属医院并经鉴定符合2005年《中华人民共和国药典》的规定。煎两次后混合,浓缩至含生药1 g/mL, 4℃冷藏备用。
1.1.2实验动物 清洁级SD大鼠,雌雄各半,体重200~300 g,由湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘)2011-0003。
1.1.3主要试剂 碳酸缓冲液(pH 9.6);稀释液(PBS-Tween);封闭液;邻苯二胺溶液;终止液(H2SO4);羊抗鼠二抗(货号:CW0102,厂家:北京康为世纪生物科技有限公司);辣根过氧化物酶羊抗兔IgG(货号:CW0103,厂家:北京康为世纪生物科技有限公司);氯化三苯基四氮唑(中国医药集团上海化学试剂公司);大鼠脑微血管内皮细胞特制培养体系:MED-0002培养基、SUP-0002添加剂(含10%胎牛血清,肝素0.75 U/mL,维生素C50 μg/mL,L-谷氨酰胺10 mM,氢化可的松1 μg/mL,成纤维细胞生长因子5 ng/mL,血管内皮细胞生长因子5 ng/mL,人表皮生长因子5 ng/mL,胰岛素样生长因子15 ng/ mL)、进口胎牛血清(武汉原生原代生物医药科技有限公司);大鼠NO、vWF、6-keto-PGF1α酶联免疫检测试剂盒(南京建成生物工程研究所)。
1.1.4主要仪器 -80℃超低温冰箱(型号:DWHL538,中科美菱);低温台式高速离心机(型号:hR/T 16M,赫西仪器装备有限公司);酶标仪(型号:318C+,上海沛欧分析仪器有限公司);水平摇床(型号:WD-9405B,北京六一科技有限公司);自动洗板机(型号:DNX-9620G,北京普朗新技术有限公司);台式高速冷冻离心机(型号:5424R,Eppendorf);三气细胞培养箱(型号:CO48R-230,NEW BRUNSWICK GALAXY 48R);双人单面垂直净化工作台(型号:SW-CJ-2FD,苏州智净净化设备有限公司);倒置荧光显微镜(型号:IX71,OLYMPUS)。
1.2实验方法
1.2.1动物造模 参照文献[10]方法制备大鼠大脑中动脉栓塞(MCAO)模型并作适当改进。20只SD大鼠适应性饲养3d后造模,10%水合氯醛(0.35 g/ kg)腹腔注射麻醉,颈部正中切开皮肤,分离颈内动脉、颈外动脉和翼腭动脉。结扎翼腭动脉,用动脉夹夹闭颈内、颈总动脉,颈外动脉近心端及远心端结扎,中间剪断。由颈外动脉插入尼龙线,0号丝线结扎,打开颈内动脉处动脉夹,颈内动脉插入尼龙线约(18.5±0.5)mm,固定线栓,逐层缝合,尼龙线残端留lcm长于皮外。
1.2.2动物给药及取血 动物造模后6h起灌服补阳还五汤24 mL/kg(按体表面积计算,相当人临床等效剂量的2倍,12.87 g/kg),分2次喂服,连续给药后1、3、5、7d各取5只大鼠采血,10%水合氯醛(0.35 g/kg)腹腔注射麻醉后腹主动脉取血5 mL置于0.109 mmol/L(1∶9抗凝)的枸橼酸钠抗凝剂的试管中,轻轻混匀,静置30min,3 000 r/min离心10min,用皂土法去除纤维蛋白原得血浆(取40 mg皂土和0.5 mL吸附缓冲液加入离心管中,充分混匀,再加入1 mL血浆,在回旋混合器上震荡混匀,缓慢震摇10min。5 000 r/min离心15min,吸取上清液至另一试管,再如以上步骤重复1次,取上清液, -20℃冰箱中冻存)。
1.2.3含药血浆、含药血清制备 50只SD大鼠适应性饲养3d后,随机分为空白组10只,补阳还五汤血浆组20只,补阳还五汤血清组20只。补阳还五汤血清和血浆组按24 mL/kg灌服补阳还五汤(按体表面积计算,相当人临床等效剂量的2倍,12.87 g/kg),分2次喂服。空白组灌服等量生理盐水,2 次/d。连续给药1、3、5、7d后各取5只大鼠,10%水合氯醛(0.35 g/kg)腹腔注射麻醉,无菌条件下腹主动脉取血,一部分血液收集于0.109 mmol/L(1∶9抗凝)的枸橼酸钠抗凝剂的试管中,轻轻混匀,静置30min,3 000 r/min离心10min,取血浆,用皂土法(方法同1.2.2)去除纤维蛋白原得血浆(含药血浆或空白对照血浆);另一部分血液收集于洁净玻璃管中,室温静置2h,3 000 r/min离心10min取血清,56℃灭活60min(含药血清或空白对照血清)。取得的含药血清、含药血浆、空白对照血清、空白对照血浆均置于-20℃冰箱保存备用。
1.2.4大鼠BMECs的培养 原代大鼠脑微血管内皮细胞购自武汉原生原代生物医药科技有限公司。接种于75 mL培养瓶中,放入5%CO2、37℃培养箱中,贴壁生长至融合状态。用0.25%的胰酶消化10min传代,取50 μL细胞悬液注入血球计数板上计数,经台盼蓝染色证明活细胞数大于90%,细胞密度为1.5×105个/mL,接种于96孔板和24孔板培养。2~3d细胞长满融合成片后进行试验。
1.2.5细胞分组与缺氧造模 将融合生长的BMECs随机分为10组:空白血清组,空白血浆组,第1、3、5、7天含药血清组,第1、3、5、7天含药血浆组。每组5孔,分别向细胞反应体系加入终浓度为10%的血清,10%血浆,置于37℃、85%N2、10%H2、5% CO2三气细胞培养箱中孵育24h。
1.2.6酶联免疫吸附法(ELISA)检测 操作步骤严格按照南京建成生物工程研究所提供的试剂盒说明书进行。取酶标板,空白对照孔不加样品,生物素标记的抗体,链霉亲和素-HRP,只加显色剂A&B和终止液,其余各步操作相同;标准品孔加入标准品50 μL,链霉素-HRP50 μL(标准品中已事先整合好生物素抗体,故不加);待测样品孔加入样本40 μL,然后各加入抗-T-PA-抗体10 μL、链霉亲和素-HRP50 μL,盖上封板膜,轻轻震荡混匀,37℃温育60min;将30倍浓缩洗涤液用蒸馏水30倍稀释后备用;小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此反复5次,拍干;每孔先加入显色剂A50 μL,在加入显色剂B50 μL,轻轻震荡混匀,37℃避光显色10min;每孔加终止液50 μL,终止反应(此时蓝色立转黄色);以空白孔调零, 450nm波长依序测量各孔的吸光值(OD值)。根据标准品的浓度及对应的OD值计算出标准曲线的回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
1.2.7统计学分析 应用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(x¯±s)表示,对样本先进行方差齐性检验,方差齐时,用One-Way ANOVA检验,并进行组间的多重比较;方差不齐时,用非参数秩和检验,先用Kruskal-Wallish test比较总的差异,再用Mann-Whitney U进行2组之间比较。两变量间的关系用相关分析。P<0.05差异有统计学意义。
2 结果
2.1各组不同时间点体内实验与细胞实验NO的变化 相同时间点含药血清组和含药血浆组表达基本接近,无统计学意义(P>0.05);第3、5、7天含药血浆组、第1、3、5、7天含药血清组分别与相同时间点体内实验比较,均有统计学意义(P<0.05或P<0.01);第1、3、5、7天体内实验组、第5、7天含药血浆组、第7天含药血清组NO均明显增加,分别与空白血浆组比较,均有统计学意义(P<0.05或P<0.01);第1、3、5、7天体内实验组、第1、3、5、7天含药血浆组、第3、5、7天含药血清组均明显升高,分别与空白血清组比较,均有统计学意义(P<0.05或P <0.01)。见表1、图1。含药血浆组与体内实验组相关系数r1=0.702,含药血浆组与体内实验值存在中度相关;含药血清组与体内实验组相关系数r2= 0.759,含药血清组与体内实验值存在中度相关,r1与r2基本接近,差异无统计学意义(P>0.05)。
表1 各组不同时间点体内实验与细胞实验NO的表达(±s,n=5)(μmol/L)
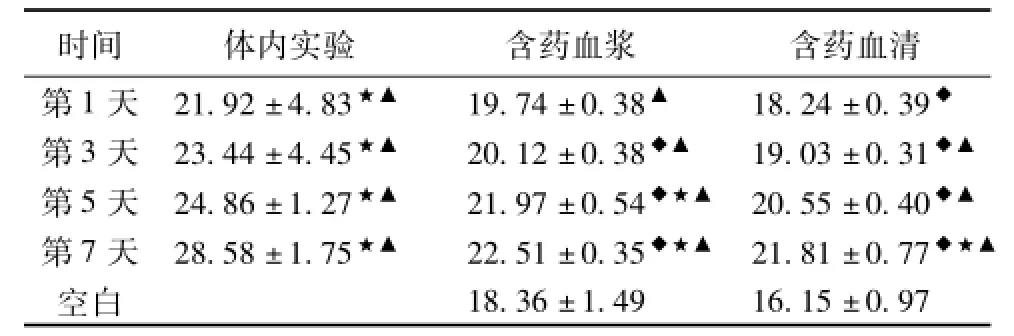
表1 各组不同时间点体内实验与细胞实验NO的表达(±s,n=5)(μmol/L)
注:与相同时间点体内实验比较,◆P<0.05或P<0.01;与空白血浆组比较,★P<0.05;与空白血清组比较,▲P<0.05。
时间体内实验含药血浆含药血清第1天21.92±4.83★▲19.74±0.38▲18.24±0.39◆18.36±1.4916.15±0.97 第3天23.44±4.45★▲20.12±0.38◆▲19.03±0.31◆▲第5天24.86±1.27★▲21.97±0.54◆★▲20.55±0.40◆▲第7天28.58±1.75★▲22.51±0.35◆★▲21.81±0.77◆★▲空白
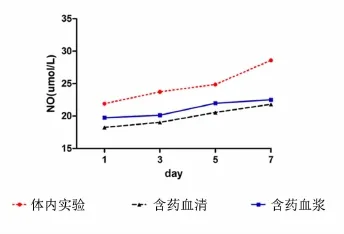
图1 各组不同时间点体内实验与细胞实验NO的表达
2.2各组不同时间点体内实验与细胞实验vWF的变化 相同时间点含药血清组和含药血浆组表达基本接近,无统计学意义(P>0.05);第1天含药血浆组、第1天含药血清组分别与相同时间点体内实验比较,均有统计学意义(P<0.05或P<0.01);第1、3、5、7天体内实验组、第3、5、7天含药血浆组、第1、3、5、7天含药血清组vWF均明显降低,分别与空白血浆组比较,均有统计学意义(P<0.05或P<0.01);第1、3、5、7天体内实验组、第3、5、7天含药血浆组、第3、5、7天含药血清组vWF均明显减少,与空白血清组比较,均有统计学意义(P<0.05或P <0.01)。见表2、图2。含药血浆组与体内实验组相关系数r3=0.928,含药血浆组与体内实验值存在高度相关;含药血清组与体内实验组相关系数r6= 0.715,含药血清组与体内实验值存在中度相关,r3>r4(P>0.05)。
表2 各组不同时间点体内实验与细胞实验vWF的表达(±s,n=5)(ng/mL)
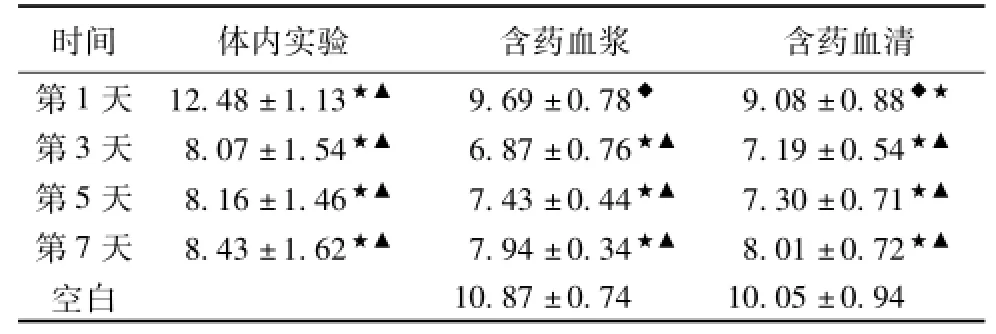
表2 各组不同时间点体内实验与细胞实验vWF的表达(±s,n=5)(ng/mL)
注:与相同时间点体内实验比较,◆P<0.05或P<0.01;与空白血浆组比较,★P<0.05;与空白血清组比较,▲P<0.05。
时间体内实验含药血浆含药血清第1天12.48±1.13★▲9.69±0.78◆9.08±0.88◆★10.87±0.7410.05±0.94 第3天8.07±1.54★▲6.87±0.76★▲7.19±0.54★▲第5天8.16±1.46★▲7.43±0.44★▲7.30±0.71★▲第7天8.43±1.62★▲7.94±0.34★▲8.01±0.72★▲空白
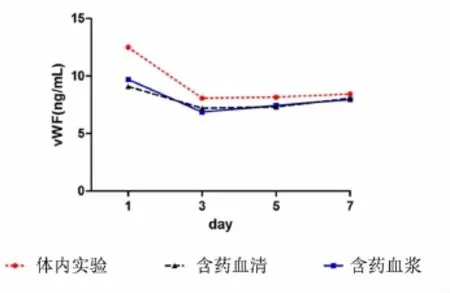
图2 各组不同时间点体内实验与细胞实验vWF表达
2.3各组不同时间点体内实验与细胞实验6-keto-PGF1α的变化 相同时间点含药血清组和含药血浆组表达基本接近,无统计学意义(P>0.05);第1、3、5、7天含药血浆组、第1、3、5、7天含药血清组分别与相同时间点体内实验比较,均有统计学意义(P<0.05或P<0.01);第1、3、5、7天体内实验组、第1、3、5、7天含药血浆组、第1、3、5、7天含药血清组均明显增加,分别与空白血浆组、空白血清组比较,均有统计学意义(P<0.05或P<0.01)。见表3、图3。含药血浆组与体内实验组相关系r5=0.933,含药血浆组与体内实验值存在高度相关;含药血清组与体内实验组相关系数r6=0.770,含药血清组与体内实验值存在中度相关,r5>r6。
表3 各组不同时间点脑组织与细胞中6-keto-PGF1α的表达(±s,n=5)(ng/mL)
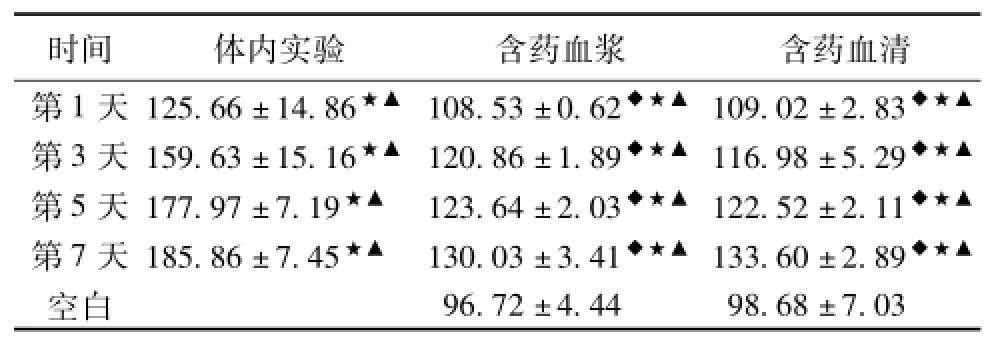
表3 各组不同时间点脑组织与细胞中6-keto-PGF1α的表达(±s,n=5)(ng/mL)
注:与相同时间点体内实验比较,◆P<0.05或P<0.01;与空白血浆组比较,★P<0.05;与空白血清组比较,▲P<0.05。
体内实验含药血浆含药血清第1天125.66±14.86★▲108.53±0.62◆★▲109.02±2.83时间◆★▲96.72±4.4498.68±7.03 第3天159.63±15.16★▲120.86±1.89◆★▲116.98±5.29◆★▲第5天177.97±7.19★▲123.64±2.03◆★▲122.52±2.11◆★▲第7天185.86±7.45★▲130.03±3.41◆★▲133.60±2.89◆★▲空白
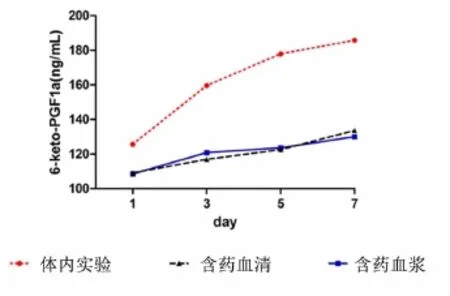
图3 各组不同时间点体内实验与细胞实验6-keto-PGF1α的表达
3 讨论
以往的体内实验研究表明补阳还五汤能抑制血管内皮细胞释放vWF[9],促进血管内皮细胞合成NO[10],并升高6-keto-PGF1α水平[11]。本次试验我们平行观察并比较补阳还五汤含药血清和含药血浆对氧剥夺大鼠BMECs培养液中NO、vWF、6-keto-PGF1α表达,并与体内实验真实值的作相关分析。实验结果显示补阳还五汤含药血浆与含药血清均能明显降低vWF,升高NO、6-keto-PGF1α水平,相同时间点含药血清组和含药血浆组表达基本接近;含药血浆组vWF与体内实验相关系数高于含药血清组,有差异性,而含药血浆组NO、6-keto-PGF1α与体内实验相关系数接近于含药血清组与体内实验相关系数,无差异性。因此在半体内实验研究中,检测vWF、6-keto-PGF1α指标时,建议优先选择含药血浆,检测NO指标时,选择含药血浆和含药血清均可。
vWF主要由血管内皮细胞合成,当内皮细胞损伤、异常活化或受到凝血酶等物质刺激时,vWF可以在30min内被释放入血液循环[12]。vWF具有加速血小板黏附、聚集,介导血小板释放相关因子,干扰纤溶过程,促进血管平滑纤维化、动脉粥样斑块及血栓形成,且与疾病的轻重呈正相关。本次试验结果表明补阳还五汤含药血浆和含药血清均能抑制缺氧损伤的大鼠BMECs释放vWF;相同时间点含药血清组和含药血浆组表达基本接近,无统计学意义。
血管内皮细胞是合成NO最主要的细胞,NO与心脑血管病发生、发展有密切关系。NO产生的减少是内皮功能障碍早期典型的特征之一[13]。6-keto-PGF1α是血管内皮细胞合成和释放的前列环素的稳定代谢产物,具有抑制血小板聚集和扩张血管的重要作用。本次试验结果显示补阳还五汤含药血浆和含药血清均能促进缺氧损伤的大鼠BMECs释放NO、6-keto-PGF1α;相同时间点含药血清组和含药血浆组表达基本接近,无统计学意义。
中药血清药理学方法用含药血清代替煎剂或粗提物进行体外实验,具有更强的可信性和科学性[14]。但含药血清药理方法不可能完全替代在体的动物实验方法,在中药及其复方的药理学研究中,可以作为使其更完善的一种新思路而充实到药理学可供选择的实验方法中[15]。而含药血浆应用于体外反应体系更加接近药物进入体内后的环境,因此所得到的实验结果相对可靠,其科学性较强。在半体内试验中,应当采用含药血浆和含药血清药理学方法同时并举的方法进行。只有这样才能排除凝血等相关过程带来的影响,从而得到令人信服的可靠结论[6]。本研究通过补阳还五汤含药血清和含药血浆与体内实验平行观察,作相关性分析,发现含药血浆组与体内实验vWF、6-keto-PGF1α与体内实验相关系数高于含药血清组,含药血浆组NO与体内实验相关系数接近于含药血清组与体内实验相关系数。
综上所述,在半体内实验研究中药复方对vWF、6-keto-PGF1α表达的影响时,建议优先选择血浆药理学方法,研究NO表达时,选择血浆药理学方法和血清药理学方法均可。
[1]孙莉娜,孟静岩,孙晓霞.中药血清药理学方法相关问题的思考[J].西部中医药,2012,25(11):36-38.
[2]柯玮,朱建华.中药血清药理方法学的研究概况[J].中国医药指南,2011,9(6):24-25.
[3]陈宁,宋冬雪,凌娜等.中药血清药理学方法的研究进展[J].北京联合大学学报,2014,28(1):40-43.
[4]王国佐,葛金文.血清药理学方法在中药研究中的进展[J].湖南中医药大学学报,2007,27(3):78-80.
[5]贺石林,葛金文,贺蓉,等.质疑血清药理学加强对层次半体内实验研究[J].中国药理学通报,2005,21(3):272-279.
[6]Jinwen Ge,Dongsheng Wang,Ronghe,et al.Medicinalherb Research:Serum Pharmacological Method and Plasma Pharmacological Method[J].Biol.Pharm.Bull,2010,33(9):1459-1465.
[7]李彩虹,彭罡,李锦云,等.盐酸小檗碱含药血清与血浆抗鼻咽癌CNE-1细胞作用的比较研究[J].医学研究生学报,2013,26(7): 676-679.
[8]贺龙刚,周丽,黄枚,等.丹参注射液含药血浆及血清对CAM血管生成的影响[J].福建中医学院学报,2008,18(1):28-30.
[9]饶晓,汤轶波,潘彦舒,等.补阳还五汤对大鼠局灶性脑缺血损伤血脑屏障的影响[J].中国中医药信息杂志,2014,21(6):49-52.
[10]宫健伟,叶蕾.补阳还五汤对脑缺血再灌注大鼠脑组织NO及NOS的影响[J].长春中医药大学学报,2010,26(6):819-820.
[11]张振强,张运克.补阳还五汤对脑缺血再灌注大鼠血浆TXB2、6-keto-PGF1a含量的影响[J].河南大学学报:医学版,2004,23 (3):9-11.
[12]Blann AD.Plasma von Willebrand factor,thrombosis,and the endothelium:the first 30 years[J].Thrombhaemost,2006,95:49-55.
[13]刘洪章,马艳春,刘喜梅,等.补阳还五汤治疗心脑血管病ApoE、NO水平变化及保护血管内皮的探讨[J].中国当代医药,2010, 17(6):92-93.
[14]罗焕敏.“血清药理学”与“血浆药理学”[J].中国药理学通报, 2003,19(9):1075-1076.
[15]候小萍,康永.中药及其复方血清药理学研究方法学的分析与评价[J].国际中医中药杂志,2009,31(2):171-173.
(2016-03-24收稿 责任编辑:洪志强)
Comparative Study between Medicated Plasma and Medicated Serum of Yang-Tonifying Five-Returningdecoction in Expression of BMECs NO,vWF,6-keto-PGF1a ofhypoxia Injured Rats and Vivo Experiments
Luo Yinhe1,Ge Jinwen1,Liu Lin2,Wang Guozuo1,Yi Yaqiao1,Liao Jun1,Shi Yongmei1
(1hunan University of Chinese Medicine,Changsha,Changsha 410208;2 The First Affiliatedhospital ofhunan University of Chinese Medicine,Changsha,Changsha 410007,China)
Objective:To compare the approachingdegree of the expression of NO,vWF and 6-keto-PGF1a between Yang-Tonifying Five-Returningdecoction(YFD)contained plasma and serum on brain microvascular endothelial cells(BMECs)injured byhypoxia rats with true value of animals in vivo experiments,and to provide references for selecting plasma or serum in the study of ex vivo experiments.Methods:The model of MCAO was made by Suture Embolization Method in the internal carotid artery of rats. BMECs were made inhypoxia incubator.The method of Enzyme-linked immunosorbent(ELISA)was used to measure the expression of NO,vWF and 6-keto-PGF1a.Results:Both of medicated plasma and medicated serum of YFD could significantly reduce the content of vWF,increase the expression of NO and 6-keto-PGF1a.There were significantdifferences(P<0.05 orP<0.01) compared with blank plasma and blank serum;The correlation coefficients of vWF between medicated plasma and in vivo experiments washigher than those between medicated serum and in vivo experiments.There was significantdifference.The correlation coefficients of NO and 6-keto-PGF1a between medicated plasma and in vivo experiments were in close proximity to those between medicated serum and in vivo experiments.There were no significantdifferences.Conclusion:When studying the expression of vWF in the ex vivo experiment,it is suggested that the plasma pharmacology method should be used.When studying the expression of NO and 6-keto-PGF1a,the methods of plasma pharmacology and serum pharmacology can be both selected.
Serum Pharmacology;Plasma pharmacology;In vivo experiment;Nitric Oxide;Von Willebrand Factor(Vwf);6-keto prostaglandin 1a(6-keto-PGF1a)
R282.7;R289.3
A
10.3969/j.issn.1673-7202.2016.04.009
国家自然科学基金项目(编号:81274008);湖南省科研条件专项课题(编号:2011TT2050);湖南省科技厅一般项目(编号: 2014SK3052)
罗银河(1978.07—),女,医学硕士,副教授,研究方向:中西医结合心脑血管疾病的研究,E-mail:1286313109@qq.com
葛金文(1965.09—),男,医学博士,教授(二级),副校长,研究方向:中西医结合防治心脑血管疾病的研究,E-mail:40831556@ qq.com