化瘀解毒法对MCAO大鼠凝血酶及其受体、脑组织MCP-1、NF-κB的表达及中性粒细胞浸润的影响
2016-09-02邓奕辉覃弘宇刘文华李定祥
邓奕辉 覃弘宇 文 果 刘文华 李定祥
化瘀解毒法对MCAO大鼠凝血酶及其受体、脑组织MCP-1、NF-κB的表达及中性粒细胞浸润的影响
邓奕辉覃弘宇文果刘文华李定祥
(湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,长沙,410208)
目的:观察化瘀解毒法对MCAO大鼠凝血酶及其受体、大鼠脑组织中单核细胞趋化蛋白(MCP-1)、核因子κB(NF-κB)的表达及中性粒细胞浸润的影响,探讨凝血酶与炎性因子之间的关联性及化瘀解毒法的干预作用。方法:MCAO大鼠分手术组、模型组、活血化瘀法组、清热解毒法组、化瘀解毒法组、阿加曲班组、PDTC组等7组,分组给药,检测各组大鼠给药后脑组织凝血酶及其受体、MCP-1和NF-κB的mRNA表达和蛋白表达水平,并观察缺血区脑组织中性粒细胞浸润情况。结果:模型组脑组织凝血酶及其受体、MCP-1、NF-κB的mRNA表达和蛋白表达均增强(P<0.05),各治疗组治疗后上述指标均下降(P<0.05),化瘀解毒法组较明显;各组大鼠脑组织内PAR-1、MCP-1、NF-κB的蛋白含量与凝血酶蛋白含量均呈正向直线相关(P<0.05);模型大鼠缺血脑组织中性粒细胞浸润明显,各治疗组均有明显改善。结论:凝血酶毒性和相关炎症反应之间存在关联性,化瘀解毒法可以抑制MCAO大鼠凝血酶毒性和炎症反应,活血化瘀法和清热解毒法之间存在协同作用。
急性缺血性中风;化瘀解毒法;凝血酶;MCP-1;NF-κB;中性粒细胞浸润
急性缺血性脑卒中(Acute Ischemic Stroke,AIS)又称急性脑梗死,占各类脑卒中的60%~80%,是中老年人致死和致残的主要疾病[1]。AIS的基本病理过程与脑血管阻塞和随之发生的脑细胞损伤有关,近年来凝血酶和炎症损伤在AIS发生发展中的作用受到了学术界的重视[2],两者之间是否存在协同作用呢?我们在前期研究的基础上认为AIS中医病机为瘀血阻滞、毒损脑络,瘀血与热毒在AIS发病中存在相互协同的关系。本研究试图从凝血酶毒性以及炎症反应的角度探讨AIS的瘀毒病机及化瘀解毒法的治疗作用,为中医药防治脑梗死的临床应用提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康的雄性SD大鼠,84只,SPF 级,体重在250~280 g,由湖南中医药大学实验动物中心提供。许可证号:SCXK(湘)2013-0004。
1.1.2药物及试剂 脑泰方(活血化瘀法),黄芪20 g、地龙15 g、僵蚕15 g、川芎10 g;黄连解毒汤(清热解毒法),黄连9 g、黄芩6 g、黄柏6 g、栀子9 g;化瘀解毒方(化瘀解毒法),黄芪20 g、地龙15 g、僵蚕15 g、川芎10 g、黄连9 g、黄芩6 g、栀子9 g、葛根15 g。中药饮片购自湖南中医药大学第一附属医院。以上三方在动物实验前以水煮浓缩方式制成每mL 含2 g生药的药液备用。
阿加曲班注射液(Argatroban),天津药物研究院药业有限公司,批号130713;PDTC(NF-κB抑制剂),碧云天生物技术研究所提供,产品编号S1808;反转录试剂盒,Thermo生产;定量PCR试剂盒,Roche生产。引物,由Invitrogen Biotechnology Co.LTD中国公司合成。
1.2方法
1.2.1分组及给药 雄性SD大鼠84只,适应性喂养3~7d,手术前夜禁食不禁水。将大鼠随机分为7组,假手术组(SG),模型组(MG),活血化瘀法组(HG,7.0 g/kg·d),清热解毒法组(QG,3.5 g/kg·d),化瘀解毒法组(HYJDF,11.55 g/kg·d),阿加曲班组(AG,11.16 mg/kg·d),PDTC组(PG,100 mg/ kg·d),每组12只。分别于术前1h和术后12h给药,中药组为灌胃给药,西药组为腹腔注射给药。假手术组和模型组灌服等量生理盐水,每日给药容量为2 mL/100 g大鼠。
1.2.2模型制备 采用改进的Zea Longa腔内栓线阻断法[3],以直径0.26 mm、顶端烫制成光滑球状(直径0.28~0.30 mm)的尼龙线作为栓子,造模大鼠结扎左侧颈总动脉、颈外动脉,使用线栓从左侧颈内动脉移行至大脑前动脉近端,阻断大脑中动脉(MCAO)的血供来源,结扎线栓,逐层缝合创口。假手术组除不插入栓线外,余操作同模型组。模型制备2h后参照Longa方法[3]进行神经功能评分,评分为1~3分者模型制备成功,余者剔除,不足预定数额者按照随机抽样原则补齐动物并重新造模。
1.2.3标本采集与处理 各组大鼠于造模成功后24h进行取材。取材前将大鼠腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,然后置于冰盒上快速断头取脑,剥开大鼠颅骨骨质,仔细分离暴露并取出完整脑组织,将其置于冰盘上放有Trizol液培养皿上,切取梗死区脑组织,放于冻存管中,于液氮中保存。用于HE的组织浸于4%的多聚甲醛中,4℃的冰箱内固定保存3d,行石蜡包埋。
1.2.4指标检测 1)荧光定量实时PCR检测脑组织凝血酶、PAR-1、MCP-1、NF-κB的mRNA表达;2) Western blot法检测脑组织凝血酶、PAR-1、MCP-1、NF-κB蛋白表达并凝胶图像分析;3)HE法检测大鼠缺血脑组织区中性粒细胞浸润情况。
1.2.5统计学方法 采用SPSS 17.0统计软件进行统计分析。所有数据以均数±标准差(±s))表示,所有资料符合正态性分布。各组间均值的比较采用单因素方差分析,方差齐者用LSD法,方差不齐者用Tambane's T2检验。因素间交互作用采用2 ×2析因设计的方差分析。
2 结果
2.1各组大鼠脑组织形态学及中性粒细胞浸润情况的比较hE染色后,光镜下发现,假手术组大鼠脑组织神经元完整,胞核圆形,核仁明显,染色质分布均匀。细胞未见充血水肿、变性、坏死等形态学改变,未见明显中性粒细胞等炎症细胞浸润。模型组大鼠缺血脑组织呈重度缺血改变,部分神经元破碎、坏死甚至消失,细胞肿胀、变形,细胞核固缩、深染,核仁不明显,染色质呈空网状,核膜增厚,细胞间质水肿明显,细胞排列紊乱,正常细胞数目明显减少,中性粒细胞等炎症细胞浸润明显。各治疗组大鼠缺血脑组织呈轻度缺血改变,细胞轻度水肿,少数细胞核固缩、深染,核仁不明显,细胞间质轻度水肿,细胞排列欠清晰,可见少量炎症细胞浸润。其中化瘀解毒法组和阿加曲班组炎性细胞浸润数最少。结果见图1。
2.2各组大鼠脑组织凝血酶的表达 与假手术组比较,造模大鼠脑组织凝血酶的mRNA表达和蛋白表达显著升高(P<0.05),与模型组比较,各治疗组脑组织凝血酶mRNA表达和蛋白表达减少(P<0.05)。各治疗组之间比较,阿加曲班组、化瘀解毒法组脑组织凝血酶mRNA表达最少(P<0.05),两者之间差异无统计学意义(P>0.05);PDTC组脑组织凝血酶mRNA表达水平居中(P<0.05),活血化瘀组、清热解毒组脑组织凝血酶mRNA表达最多(P <0.05)。各治疗组之间比较,阿加曲班组凝血酶蛋白表达最少(P<0.05),活血化瘀法组与PDTC组较其他各组高(P<0.05),且二者之间无统计学意义(P>0.05),化瘀解毒法组与清热解毒法组之间无统计学意义(P>0.05)。结果见表1、图2。
将模型组、活血化瘀法组、清热解毒法组、化瘀解毒法组的凝血酶mRNA表达和蛋白表达含量进行2×2的析因分析,结果表明活血化瘀法和清热解毒法二者之间存在交互作用(协同作用)。
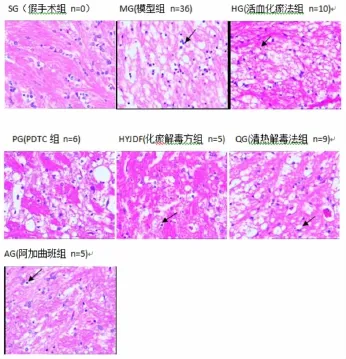
图1 各组大鼠脑组织形态学的变化(尤其是炎症细胞浸润情况)
表1 各组大鼠脑组织凝血酶的表达水平(±s,n=5)
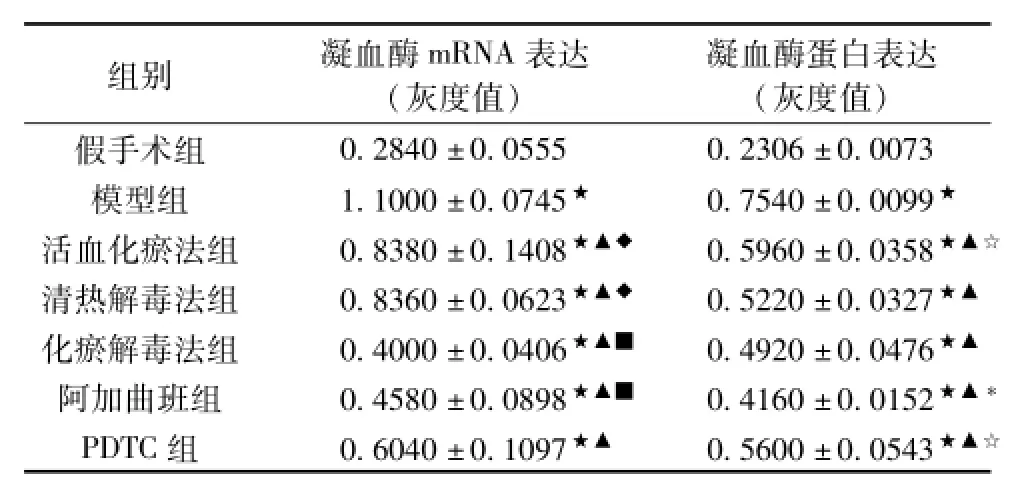
表1 各组大鼠脑组织凝血酶的表达水平(±s,n=5)
注:★与SG比较P<0.05;▲与MG比较P<0.05;*与其他治疗组比较,P<0.05;☆与HYJDF、AG、QG比较,P<0.05;◆P<0.05;与PG、HG、QG比较,■P<0.05。
组别凝血酶mRNA表达(灰度值)凝血酶蛋白表达(灰度值) 0.2840±0.05550.2306±0.0073模型组1.1000±0.0745★0.7540±0.0099★活血化瘀法组0.8380±0.1408★▲◆0.5960±0.0358★▲☆清热解毒法组0.8360±0.0623★▲◆0.5220±0.0327★▲化瘀解毒法组0.4000±0.0406★▲■0.4920±0.0476★▲阿加曲班组0.4580±0.0898★▲■0.4160±0.0152★▲*PDTC组0.6040±0.1097★▲0.5600±0.0543假手术组★▲☆
2.3各组大鼠脑组织PAR1的表达 与假手术组比较,造模大鼠脑组织PAR1 mRNA表达、蛋白表达显著升高(P<0.05);与模型组比较,各治疗组脑组织PAR1 mRNA表达减少(P<0.05)。各治疗组之间比较,活血化瘀法组与PDTC组较其他各组PAR1表达高(P<0.05),而二者无统计学意义(P>0.05)。其他各组之间无统计学意义(P>0.05)。结果见表2、图2。
表2 各组大鼠脑组织PAR1的表达(±s,n=5)
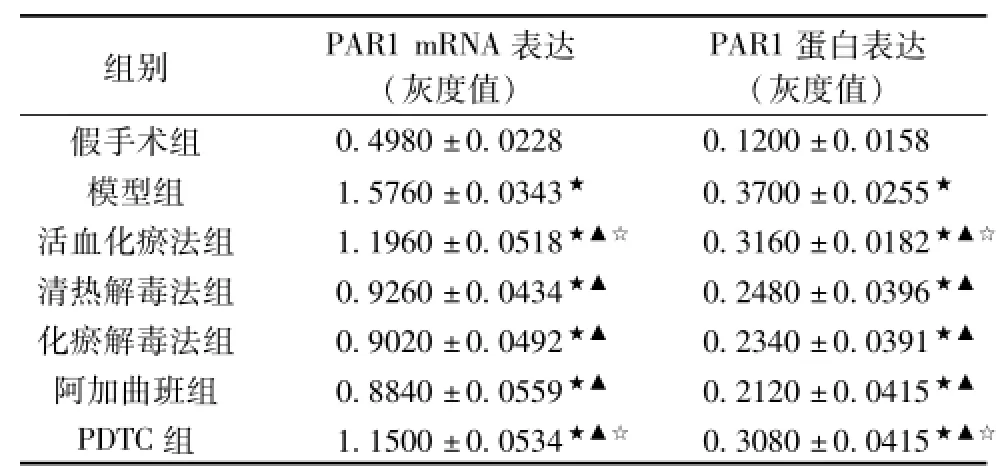
表2 各组大鼠脑组织PAR1的表达(±s,n=5)
注:★与SG比较P<0.05;▲与MG比较P<0.05;*与其他治疗组比较,P<0.05;●与AG、HYJDF、HG比较,P<0.05;☆与HYJDF、AG、QG比较,P<0.05。
组别PAR1 mRNA表达(灰度值) PAR1蛋白表达(灰度值) 0.4980±0.02280.1200±0.0158模型组1.5760±0.0343★0.3700±0.0255★活血化瘀法组1.1960±0.0518★▲☆0.3160±0.0182★▲☆清热解毒法组0.9260±0.0434★▲0.2480±0.0396★▲化瘀解毒法组0.9020±0.0492★▲0.2340±0.0391★▲阿加曲班组0.8840±0.0559★▲0.2120±0.0415★▲PDTC组1.1500±0.0534★▲☆0.3080±0.0415假手术组★▲☆
2.4各组大鼠脑组织MCP-1的表达 与假手术组比较,造模大鼠脑组织MCP-1 mRNA表达、蛋白表达显著升高(P<0.05)。与模型组比较,各治疗组脑组织MCP-1表达减少(P<0.05)。各治疗组之间MCP-1 mRNA表达比较,阿加曲班组表达最少(P<0.05);化瘀解毒法组、清热解毒法组表达依次递增,二者之间差异有统计学意义(P<0.05);活血化瘀法组与PDTC组较其他各组高(P<0.05),二者之间差异无统计学意义(P>0.05)。
各治疗组之间MCP-1蛋白表达比较,阿加曲班组和化瘀解毒法组表达最少(P<0.05),且二者之间无统计学意义(P>0.05);清热解毒法组、PDTC组、活血化瘀法组表达依次增多,三者之间差异有统计学意义(P<0.05)。结果见下表3、图2。
表3 各组大鼠脑组织MCP-1的表达(±s,n=5)
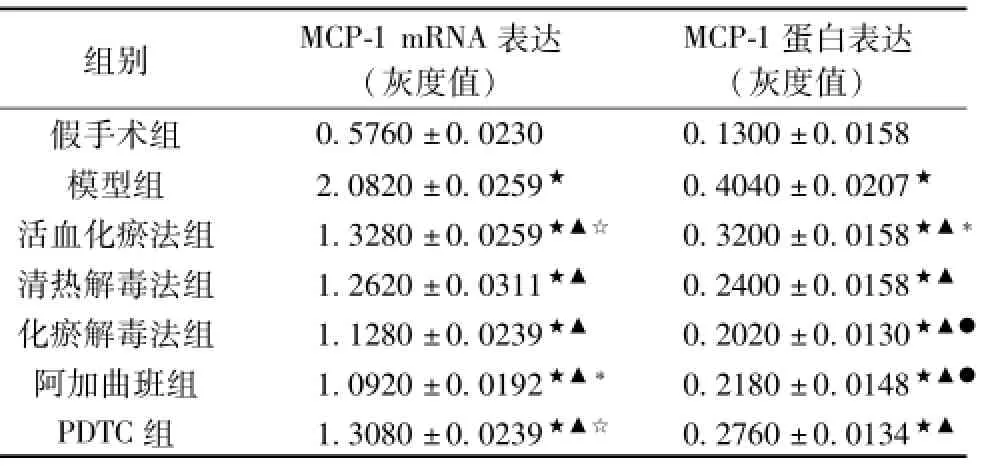
表3 各组大鼠脑组织MCP-1的表达(±s,n=5)
注:★与SG比较P<0.05;▲与MG比较P<0.05;*与其他治疗组比较,P<0.05;☆与HG、PG比较,P<0.05;☆与HYJDF、AG、QG比较,P<0.05;●与PG、HG、QG比较,P<0.05。
组别MCP-1 mRNA表达(灰度值) MCP-1蛋白表达(灰度值) 0.5760±0.02300.1300±0.0158模型组2.0820±0.0259★0.4040±0.0207★活血化瘀法组1.3280±0.0259★▲☆0.3200±0.0158★▲*清热解毒法组1.2620±0.0311★▲0.2400±0.0158★▲化瘀解毒法组1.1280±0.0239★▲0.2020±0.0130★▲●阿加曲班组1.0920±0.0192★▲*0.2180±0.0148★▲●PDTC组1.3080±0.0239★▲☆0.2760±0.0134假手术组★▲
2.5各组大鼠脑组织NF-κB的表达 与假手术组比较,模型组及各治疗组大鼠脑组织MCP-1 mRNA表达、蛋白表达显著升高,差异具有统计学意义(P <0.05)。与模型组比较,各治疗组脑组织MCP-1表达减少(P<0.05)。各治疗组之间MCP-1 mRNA表达比较,阿加曲班组表达最少(P<0.05);化瘀解毒法组、清热解毒法组表达依次递增,二者之间差异有统计学意义(P<0.05);活血化瘀法组与PDTC组较其他各组高(P<0.05),二者之间差异无统计学意义(P>0.05)。
各治疗组之间MCP-1蛋白表达比较,阿加曲班组和化瘀解毒法组表达最少(P<0.05),且二者之间无统计学意义(P>0.05);清热解毒法组、PDTC组、活血化瘀法组表达依次增多,三者之间差异有统计学意义(P<0.05)。结果见表4、图2。
表4 各组大鼠脑组织NF-κB的表达(±s,n=5)
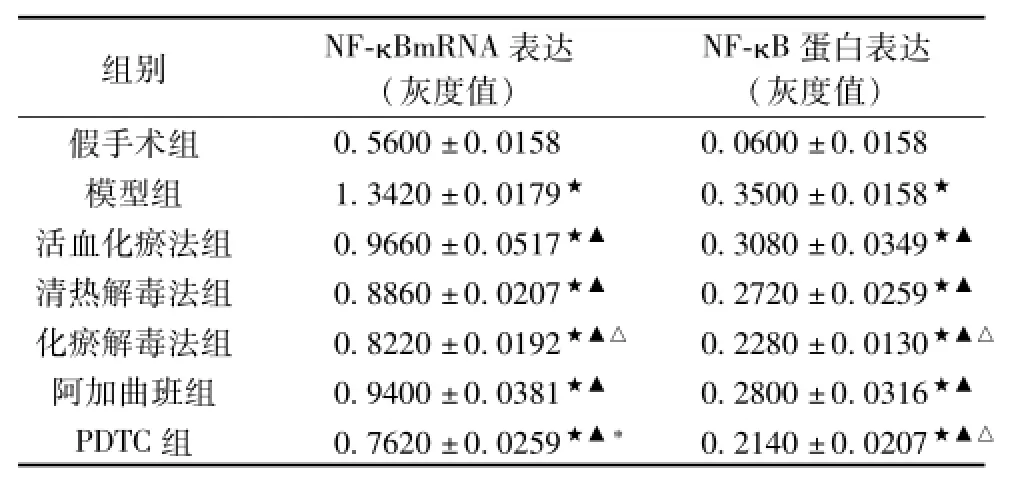
表4 各组大鼠脑组织NF-κB的表达(±s,n=5)
注:★与SG比较P<0.05;▲与MG比较P<0.05;*与其他治疗组比较,P<0.05;△与QG、AG、HG比较,P<0.05。
组别NF-κBmRNA表达(灰度值) NF-κB蛋白表达(灰度值) 0.5600±0.01580.0600±0.0158模型组1.3420±0.0179★0.3500±0.0158★活血化瘀法组0.9660±0.0517★▲0.3080±0.0349★▲清热解毒法组0.8860±0.0207★▲0.2720±0.0259★▲化瘀解毒法组0.8220±0.0192★▲△0.2280±0.0130★▲△阿加曲班组0.9400±0.0381★▲0.2800±0.0316★▲PDTC组0.7620±0.0259★▲*0.2140±0.0207假手术组★▲△
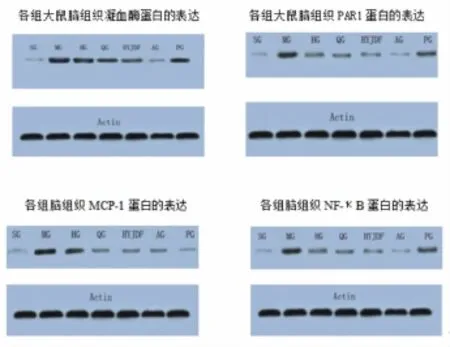
图2 大鼠脑组织凝血酶、PAR1、MCP-1、NF-κB蛋白表达情况
2.6各组大鼠脑组织内PAR-1、MCP-1、NF-κB的蛋白表达与凝血酶蛋白表达的相关性 各组大鼠脑组织内PAR-1、MCP-1、NF-κB的蛋白表达与凝血酶蛋白表达均呈正向直线相关(P<0.05)。结果见图3。
3 讨论
急性缺血性脑卒中(AIS)的病理生理机制非常复杂,除了较公认的病机外,同时凝血酶[4-5]的损伤以及炎症反应也都参与了缺血性脑卒中的发生、发展过程,我们前期的实验初步印证了这个机制[6]。
小剂量凝血酶具有神经保护作用,而大剂量凝血酶具有神经毒性作用,而大剂量凝血酶的毒性作用通过2个途径实现,一是通过与蛋白酶活化受体(PAR)结合介导脑梗死后脑水肿、细胞凋亡[7]等,如脑缺血早期,可见神经细胞内凝血酶基因表达上调,凝血酶产生增加[8],提示凝血酶神经毒性作用引起了细胞水肿;二是作为一种重要的前炎性因子,能与PAR结合诱导炎性细胞表达和产生MCP-1和白介素-6、白介素-8、肿瘤坏死因子-α、干扰素、NF-κB等炎性因子[9-10],促发炎性反应。凝血酶抑制剂阿加曲班不仅能直接抑制游离凝血酶活性,同时能抑制与纤维蛋白原结合的凝血酶活性[11]。NF-κB抑制剂PDTC,可以在多种细胞中抑制NF-κB的激活,减少炎性因子产生而达到控制炎性反应和减轻组织损伤[12]的作用。
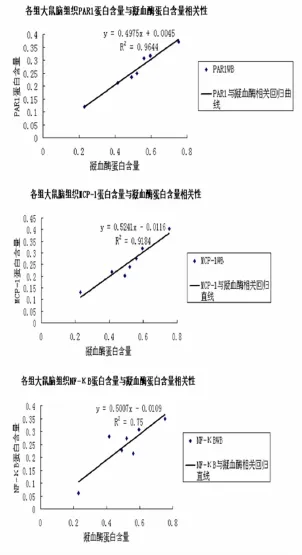
图3 各组大鼠脑组织PAR-1、MCP-1、NF-κB的蛋白含量与凝血酶含量相关性分析散点图
基于前期研究基础,课题组认为AIS基本病机为瘀血阻滞、毒损脑络,临床治疗上我们不仅要活血化瘀以疏通血脉,同时还要清热解毒以清除病理产物。本研究中所用化瘀解毒方由前期有效方剂脑泰方与黄连解毒方复方减黄柏加葛根而成,既有脑泰方的活血化瘀功效,又有黄连解毒汤的清热解毒功效,去黄柏之引药下行及苦寒,加葛根领诸药上达头部,并生津润燥。本实验研究结果显示MCAO模型大鼠与假手术组大鼠比较,脑组织内凝血酶蛋白及其受体PAR1、MCP-1、NF-κB表达明显增加,表明凝血酶及其受体、炎性因子参与了缺血缺氧后的脑损伤;同时经过相关性分析我们发现PAR-1、MCP-1、NF-κB、的蛋白表达与凝血酶蛋白表达呈正向直线相关,这提示了凝血酶在急性脑缺血中风后主要通过与其受体结合介导了脑缺血后的炎性反应,发挥了其毒性作用;凝血酶与其受体PAR1在各治疗组之间的比较结果相似,阿加曲班组、化瘀解毒法组、清热解毒法组、PDTC组、活血化瘀法组下调二者表达的作用依次递减,提示了各治疗组均能通过下调凝血酶的表达而降低其受体表达,且各自的作用依次递减;各治疗组对MCP-1的表达的比较结果与对凝血酶及其受体相同,各治疗组可能主要是通过下调凝血酶的表达而实现对MCP-1的下调作用。而在对NF-κB的表达的影响中,PDTC组作用最强,化瘀解毒法组、清热解毒法组、阿加曲班组、活血化瘀法组下调NF-κB的表达作用依次减弱。这可能与PDTC不仅能直接抑制NF-κB的表达,还能通过下调凝血酶的表达而降低NF-κB有关,而化瘀解毒法组和清热解毒法组较阿加曲班组作用强,说明两者可能既通过下调凝血酶的表达而降低NF-κB,可能还有直接抑制NF-κB的作用。从各治疗组对各指标表达的影响表明,活血化瘀法、清热解毒法均能下调凝血酶及其受体和炎性因子的表达,且清热解毒法作用较活血化瘀法效果好,而以二法为基础的化瘀解毒法组同样能下调凝血酶及其受体和炎性因子的表达,且作用强于二法单独作用效果。因此,我们又采用析因分析的统计学方法将模型组、活血化瘀法组、清热解毒法组、化瘀解毒法组的凝血酶蛋白含量进行了分析,结果发现活血化瘀法和清热解毒法单独作用对缺血脑组织凝血酶蛋白表达都有统计学意义,化瘀解毒法对缺血脑组织凝血酶蛋白表达也有统计学意义,且具有活血化瘀法和清热解毒法二者的交互作用(协同作用)。结果证实了化瘀解毒方不是活血化瘀法和清热解毒法的简单相加,化瘀解毒方治疗急性缺血性中风有效,同时也印证了我们提出的瘀毒病机假说有一定的科学性。
[1]中华医学会神经病学分会,脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南.2014[S].中华神经科杂志,2015,48(4):246-257.
[2]Ma L,Dorling A.The roles of thrombin and protease-activated Receptors in inflammation[J].Semin Immunopathol,2012,34:63-72.
[3]Zea Longa Z,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20: (1):84-91.
[4]Bushid,Ben Shimon M,Shavit Stein E,et al.Increased thrombin activity following reperfusion after ischemic stroke alters synaptic transmission in thehippocampus[J].J Neurochem,2015:22.doi:10. 1111/jnc.13372.
[5]Bo C.Thrombin in Ischemic Stroke Targeting.Translational Stroke Research[M].Springer New York,2012:189-204.
[6]邓奕辉,葛金文,易亚乔,等,滋阴活血解毒方对脑缺血性脑损伤大鼠炎性因子的影响[J],中华中医药学刊,2011,29(12):2777-2778.
[7]Hacke W,Kaste M,Bluhmki E,et al.Thrombolysis with alteplase 3 to 4.5hours after acute ischemic stroke[J].N Engl J Med,2008,359: 1317-1329.
[8]Bo C,Beth F,Michael AW,et al.Thrombin Activity Associated with Neuronaldamageduring Acute Focal Ischemia[J].Neuroscience, 2012,32(22):7622-7631.
[9]AndrewdB,Andrew va,Pat L,et al.The Argatroban and Tissue-Type Plasminogen Activator Stroke Study-Final Results of a Pilot Safety Study[J].Stroke,2012,43:770-775.
[10]Alabanza LM,Bynoe MS.Thrombin induces an inflammatory phenotype in ahuman brain endothelial cell line[J].J Neuroimmuno, 2012,245(1-2):48-55.
[11]Lyden P,Pereira B,Chen B,et al.Direct thrombin inhibitor argatroban reduces strokedamage in 2different models[J].Stroke,2014,45 (3):896-899.
[12]Mahali SK,Verma N,Manna SK.Advanced glycation end products induce lipogenesis:regulation by natural xanthone through inhibition of ERK and NF-κB[J].J Cell Physiol,2014,229(12):1972-1980.doi:10.1002/jcp.24647.
(2016-03-24收稿 责任编辑:洪志强)
Effects of Stasis-resolving anddetoxificating Method on Expression of Thrombin and its Receptor,Monocyte Chemoat -tractant Protein(MCP-1),Nuclear Factor κB(NF-κB),and Infiltration of Neutrophil in MCAO Rats
Deng Yihui,Tanhongyu,Wen Guo,Liu Wenhua,Lidingxiang
(Hunan University of Chinese Medicine,Key Laboratory ofhunan Province for Prevention and Treatment of Integrated Traditional Chinese and Western Medicine on cardio-cerebraldiseases,Key Laboratory ofhunan Universities for Cell Biology and Molecular Techniques,Changsha 410208,China)
Objective:To observe the effects of stasis-resolving anddetoxificating method on the expression of thrombin and its receptor(PAR-1),monocyte chemoattractant protein(MCP-1),nuclear factor κB(NF-κB)and infiltration of neutrophil in brain tissue of MCAO rats,and todiscuss the association between thrombin and inflammatory factors and the intervention effects of stasis-resolving anddetoxificating method.Methods:The MCAO rats were randomlydivided into 7 groups:the sham-operated group, the model group,the blood-activating and stasis-resolving method group,theheat-clearing anddetoxificating method group,the stasis-resolving anddetoxificating method group,the Argatroban group and the PDTC group.And were given thedrugs respectively,then the levels of thrombin and its receptor,MCP-1,NF-κB weredetected after being givendrugs in brain tissue of MCAO rats,and the infiltration of neutrophil in ischemic area was observed.Results:The mRNA and protein expressions of thrombin and its receptor,MCP-1,NF-κB in brain tissue of the model group increased obviously(P<0.05),while all of thosedecreased(P<0.05)in each treated groups after treatment,and it also present a markedly reduction in the stasis-resolving anddetoxificating group.A positive linear correlation was shown in contents of protein of PAR-1,MCP-1,NF-κB and thrombin in brain tissue of each group(P<0.05).The infiltration of neutrophil in ischemic brain tissue of the model rats was visible,and there were obvious improvements in each treated groups.Conclusion:It is found that there was a correlation between thrombin toxicity and inflammation responses,and both of them were inhibited by stasis-resolving anddetoxificating in MCAO rats.Furthermore,there was an obvious synergistic effect in stasis-resolving anddetoxificating andheat-clearing anddetoxicating method group.
Acute ischemic stroke;Stasis-resolving anddetoxificating method;MCP-1;NF-κB;Infiltration of neutrophil
R285.5
A
10.3969/j.issn.1673-7202.2016.04.003
湖南省自然科学基金项目(编号:14JJ2113);湖南省中医药科研计划项目(编号:201319;201606);湖南省教育厅资助项目(编号: 12A105)
邓奕辉(1970.06—),女,博士,教授,主要从事中西医结合防治心脑血管疾病的临床与基础研究,E-mail:64413830@qq.com
李定祥(1968.12—),男,博士,副教授,主要从事血瘀证的证治研究,E-mail:ldxlzy@hotmail.com
