肾脑复元汤对MCAO大鼠HGF及TGF-β表达的影响
2016-09-02胡国恒刘侃王瑾茜李映辰曾勇刘旺华
胡国恒刘 侃王瑾茜李映辰曾 勇刘旺华
肾脑复元汤对MCAO大鼠HGF及TGF-β表达的影响
胡国恒1刘 侃2王瑾茜2李映辰2曾 勇2刘旺华3
(1湖南中医药大学第一附属医院,长沙,410007;2湖南中医药大学研究生院,长沙,410208;3湖南中医药大学中医诊断研究所,长沙,410007)
目的:探究肾脑复元汤对MCAO大鼠脑保护作用及其机制。方法:72只SD大鼠随机分为假手术组、模型组、肾脑复元汤组,根据处死时间每组再随机分为3d、7d、14d 3个亚组。比较各组大鼠神经功能缺损评分、脑梗死体积、神经营养因子HGF及TGF-β表达。结果:与模型组比较,肾脑复元汤组大鼠神经功能缺损评分明显下降(P<0.01),脑梗死体积明显缩小(P<0.01),缺血侧脑组织HGF及TGF-β表达明显增加(P<0.01)。结论:肾脑复元汤可以明显改善MCAO大鼠神经功能缺损症状,并促进脑梗死组织修复,其机制可能是通过促进HGF、TGF-β的表达。
肾脑复元汤;缺血性中风;肝细胞生长因子;转化生长因子-β
缺血性中风又称脑梗死,是指各种原因所致脑部血液供应障碍,导致局部脑组织缺血、缺氧性坏死,而出现相应神经功能缺损的一类临床综合征[1]。目前,临床上尚缺乏有效的脑保护制剂,而以“肾脑同病、肾脑同治”理论为指导的研究发现中医药能有效促进中风后神经功能恢复,提高神经营养因子的表达,抑制炎性反应[2-3]。本研究以上述理论为指导,从神经功能评分、脑梗死体积、肝细胞生长因子(Hepatocyte Growth Factor,HGF)及转化生长因子-β(Transforming Growth Factor-β,TGF-β)的表达等方面探讨肾脑复元汤对大脑中动脉缺血(Middle Cerebral Artery Occlusion,MCAO)大鼠模型神经保护作用及其机制。
1 材料与方法
1.1实验材料
1.1.1实验动物 健康SPF级雄性SpragueDawley (SD)大鼠,体重(280±20)g,购于湖南省斯莱克景达实验动物有限公司(实验动物生产许可证号SYXK(湘)2011-0003);动物饲养于湖南中医药大学SPF级实验动物中心(许可证号SYXK(湘)2009-0001)。
1.1.2药品试剂 兔抗大鼠HGF试剂盒与兔抗大鼠TGF-β试剂盒(武汉博士德生物公司);2,3,5-氯化三苯基四氮唑(Sigma);通用pv9000试剂盒(上海瑞齐生物科技有限公司);水合氯醛(武汉市法迪斯公司)。
1.1.3主要仪器 精密电子天平(OHAUS),石蜡切片机(ReicherthistoSTAT),光学显微镜(Olympus),电子体温计。
1.1.4药物制备 肾脑复元汤组成:熟地黄10 g、黄芪30 g、山茱萸10 g、山药15 g、川芎10 g、红景天20 g、丹参10 g、牡丹皮10 g、赤芍10 g、当归尾10 g、地龙10 g。所用均为道地药材,购于湖南省中医药大学第一附属医院。采用自动煎药壶煎煮,煎煮方法:第一煎加水500 mL,煎取200 mL汤汁;第二煎加水300 mL,煎取150 mL汤汁;2次汤药混合后置于60℃水浴锅内蒸发浓缩至含生药2 g/mL,待冷却后置于4℃冰箱冷藏备用。
1.2实验方法
1.2.1分组与给药 所有SD大鼠参照随机数字表法分为假手术组、MCAO模型组、肾脑复元汤组,各组再根据处死时间分为7、14、21d 3个亚组,每个亚组8只大鼠。造模24h后,肾脑复元汤组予中药汤剂灌胃,假手术组及MCAO模型组予等量蒸馏水灌胃。大鼠灌胃中药剂量根据成人每日服用145 g生药剂量进行体表面积比值换算[4],灌药体积均为20 mL/kg,每组每日灌胃1次。经过预实验已证明本方中药剂量因素对药效的影响无统计学意义,因此实验中只选用临床常规使用的中药剂量。
1.2.2动物造模 采用改良Zea Longa线栓法制作大鼠MACO模型[5]。大脑中动脉阻断成功2h后拔除线栓,造成脑缺血再灌注模型。实验中使用恒温垫加温,电子体温计监测,使大鼠体温维持在(37.0 ±0.5)℃。再灌注后2h后采用Zea Longa5分制进行神经功能评分,分值在1~3分者为造模成功。
1.2.3神经功能缺损评分 选取造模前24h、造模成功后24h、处死前等3个时间点,采用改良大鼠神经功能缺损严重程度评分量表(m-NSS)[6]进行神经功能缺损评分,各指标评分3次取均值纳入结果。
1.2.4脑梗死体积计算 大鼠处死后用生理盐水从心尖处灌注2min,取出脑组织,从前囱前2 mm 处,每隔2 mm做一冠状切片,厚10 m,共选取5个层面。将2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyltetrazolium Chloride,TTC)用蒸馏水配成2%溶液,将切片在37℃下浸泡15min,每5min轻轻震荡数次。采用ImageJ图像分析软件计算脑梗死面积(红色区域为正常区域,白色区域为梗死区),各脑片梗死面积乘以厚度(2 mm)为梗死体积。
1.2.5HGF及TGF-β表达检测 取前囱后1.0~1.5 mm区域做冠状切片,厚5 m,常规脱蜡,水化组织,1∶100稀释一抗、37℃孵育2h后,滴加聚合物辅助剂和辣根酶标记二抗,37℃孵育30min,DAB显色,常规脱水,透明及封片。阴性对照滴加PBS代替一抗。采用Olympus光学显微镜下观察,每组每个指标检测5张切片,每张切片选取缺血海马区3个互不重叠的视野,观察棕黄色样阳性细胞数目。
1.2.6统计学处理 采用SPSS 19.0进行统计学分析。实验数据以(±s))表示,组间均数采用t检验进行2组间比较,多组比较采用单因素方差分析比较,P<0.05认为差异有统计学意义。
2 结果
2.1大鼠神经功能缺损评分 脑缺血造模后,模型组及肾脑复元汤组大鼠神经功能均明显下降,而肾脑复元汤组在缺血再灌注后3d、7d及14d神经功能评分明显低于模型组,2组相比具有显著统计学意义(P<0.01),说明肾脑复元汤能促进脑缺血再灌注后神经功能恢复。见表1。
2.2大鼠脑梗死体积比较 肾脑复元汤组大鼠脑梗死体积较模型组明显减小,差异有显著统计学意义(P<0.01),说明肾脑复元汤能有效减小缺血灶体积,保护脑组织。见表2、图1。
表1 不同时间点各组神经功能缺损分值比较(±s,n=8)
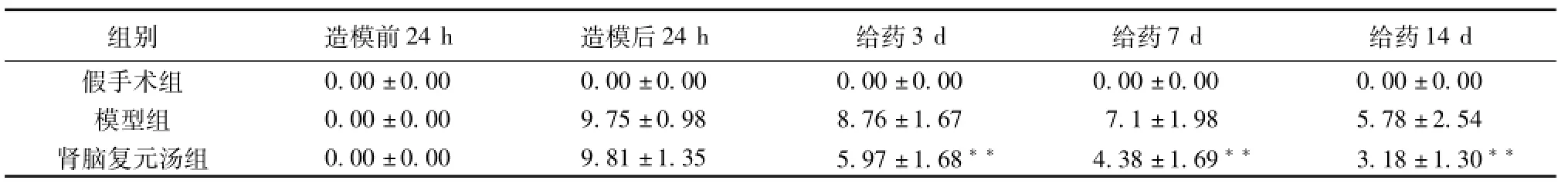
表1 不同时间点各组神经功能缺损分值比较(±s,n=8)
注:与模型组比较,**P<0.01。
0±0.00模型组0.00±0.009.75±0.988.76±1.677.1±1.985.78±2.54肾脑复元汤组0.00±0.009.81±1.355.97±1.68**4.38±1.69**3.18±1.30 14d假手术组0.00±0.000.00±0.000.00±0.000.00±0.000.0组别造模前24h造模后24h给药3d给药7d给药**
表2 大鼠脑梗死体积比较(mm3,±s)
注:与模型组相比,**P<0.01。
80.00±0.000.00±0.000.00±0.00模型组8 90.52±12.5461.35±12.3532.67±8.55肾脑复元汤组8 71.24±10.15**40.58±9.24**20.03±6.43 3d7d14d假手术组组别例数梗死体积**
2.3缺血侧脑组织HGF及TGF-β阳性细胞数比较
模型组及肾脑复元汤组脑缺血侧脑组织HGF及TGF-β阳性细胞数明显升高,且肾脑复元汤组阳性细胞数明显高于模型组,差异有显著统计学意义(P <0.01)。见表3、图2。

表3 各组大鼠HGF及TGF-β表达比较
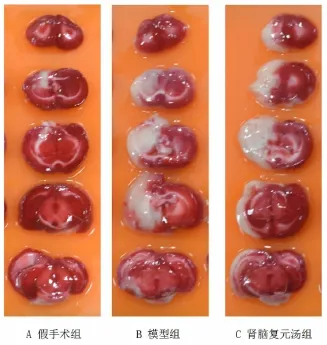
图1 第7天时各组脑梗死情况比较
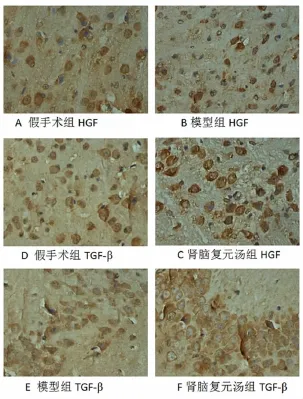
图2 HGF及TGF-β第7天各组表达情况(×400)
3 讨论
肝细胞生长因子(Hepatocyte Growth Factor,hGF)最先通过肝切除手术大鼠的血浆离心提纯后得到,具有广泛的生物学效应,对于肝细胞的DNA合成起到促进作用。研究表明,肝细胞生长因子对于短暂性脑缺血后中枢神经系统神经元的生长、分化、修复和再生起到强大的刺激作用[7]。作为一种新发现的重要神经营养因子,HGF的表达在脑缺血性损伤后反应性升高,能有效营养神经,保护中枢神经元[8]。在体和离体实验均证实,HGF可以减少一氧化氮合酶(iNOS)、白细胞介素-1β(IL-1β)、TNF-α的表达,降低一氧化氮(NO)含量,同时促进抗炎性因子IL-10的表达,从而起到脑保护作用[9]。HGF还能通过抑制细胞凋亡和细胞自噬以减少死亡细胞数,显著降低脑缺血梗死面积[10]。亦有研究显示,缺血性中风后轻偏瘫患者接受康复训练能明显提高HGF的表达,且HGF的血清浓度与的恢复能力密切相关[11]。
转化生长因子-β(Transforming Growth Factor-β, TGF-β)属于TGF超家族成员,对细胞的生长、分化和免疫功能都有重要的调节作用。Kana Sugimoto研究发现,TGF-β在脑缺血核心区域表达最明显,它的受体mRNA的表达则在缺血再灌注后3d达到顶峰,与此同时,作为对TGF-β升高的回应,缺血灶内NG2+小胶质细胞的数量明显上升,而后者则能有效清除退化和凋亡的神经元[12]。TGF-β信号通路是胶质细胞限制神经炎性反应的分子机制,在中风后亚急性期梗死皮层周围组织上调TGF-β的蛋白表达,降低炎性反应以保护脑功能[13]。有研究报告指出间充质干细胞通过分泌TGF-β,降低单核细胞趋化蛋白1(MCP-1)的水平,阻止CD68+免疫细胞通过受损的血脑屏障渗透进入脑组织,从而抑制缺血后免疫炎性反应,促进缺血后大脑功能恢复[14]。研究也发现活化TGF-β-MEK/ERK信号通路能够上调紧密连接蛋白的表达,减少基底膜降解,以此增加血脑屏障的紧密性,降低血脑屏障被破坏和脑梗死后出血转化概率[15-16]。
肾脑复元汤的组方原则基于“肾脑同病、肾脑同治”理论,药物组成主要有熟地黄、山茱萸、山药、黄芪、红景天、牡丹皮、当归尾、赤芍、地龙、丹参、川芎。方中以熟地黄、黄芪为君药,熟地黄能养阴填精益髓,黄芪能大补元气,两者合用,精聚而生髓,气行则瘀去。山药,补脾胃而养气阴,山茱萸益肝肾而填精髓,共为臣药;山茱萸与熟地合用助其补养肝肾,取“肝肾同源”之意。牡丹皮、赤芍、红景天、当归尾皆为活血之药,且以牡丹皮、赤芍之凉血活血制山茱萸之性温,以当归尾养血活血之力助黄芪补气行血之功,红景天既能健脾益气,又可活血化瘀,以上四味皆为佐药。地龙入经络能搜风邪,入血脉能行气血,帅诸药通行全身,活血通络。全方诸药合用,共奏填精益髓、益气活血之效。
本研究结果显示,肾脑复元汤可以降低脑缺血后大鼠神经功能评分,改善其运动、感觉及平衡功能,对于肢体功能的恢复起到积极的促进作用。同时,肾脑复元汤能明显缩小脑梗死体积,说明肾脑复元汤能够减少梗死后脑组织损伤、促进损伤后组织修复。在相关神经营养因子的表达方面,肾脑复元汤可以显著增加HGF及TGF-β阳性细胞数,促进相关蛋白的表达。因此,本实验从动物实验的角度证明肾脑复元汤能够在缺血性中风后有效地起到脑保护的作用,其作用机制可能与促进神经营养因子HGF及TGF-β的表达有关。
[1]贾建平,陈生弟.神经病学[M].北京:人民卫生出版社,2013, 175.
[2]胡国恒,李映辰,程齐来,等.肾脑复元汤对脑缺血大鼠BDNF及bFGF表达的影响[J].中成药,2015,10(10):2275-2279.
[3]胡国恒,李映辰,邹婷,等.肾脑复元汤对MCAO大鼠炎症因子及神经营养因子表达的影响[J].中药药理与临床,2015,31(2):81-84.
[4]翁维良.中药临床药理学[M].北京:人民卫生出版社,2002. 256.
[5]Lin YC,Ko TL,Shih YH,et al.Human umbilical mesenchymal stem cells promote recovery after ischemic stroke[J].Stroke,2011,42 (7):2045-53.
[6]Zhang L,Li Y,Zhang C,et al.Delayed administration ofhuman umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia[J].Stroke,2011,42(5):1437-1444.
[7]Shang J,Deguchi K,Ohta Y,et al.Strong neurogenesis,angiogenesis, synaptogenesis,and antifibrosis ofhepatocyte growth factor in rats brain after transient middle cerebral artery occlusion[J].J Neurosci Res,2011,89(1):86-95.
[8]李国前,王杰华,杨小霞,等.骨髓间充质干细胞移植大鼠脑缺血区微血管密度和肝细胞生长因子的表达[J].中国组织工程研究与临床康复,2011,15:6007-6011.
[9]贺芳,叶蓓,陈建珍,等.HGF对脑缺血/再灌注大鼠脑iNOS,NO 及IL-1β的影响[J].中南大学学报:医学版,2014,39(1):23-29.
[10]Shang J,Deguchi K,Yamashita T,et al.Antiapoptotic and antiautophagic effects of glial cell line-derived neurotrophic factor andhepatocyte growth factor after transient middle cerebral artery occlusion in rats[J].J Neurosci Res,2010,88(10):2197-206.
[11]Okazakih,Beppuh,Mizutani K,et al.Changes in serum growth factors in stroke rehabilitation patients and their relation tohemiparesis improvement[J].J Stroke Cerebrovascdis,2014,23(6):1703-1708.
[12]Sugimoto k,Nishioka R,Lkeda A,et al.Activated Microglia in a Rat Stroke Model Express NG2 Proteoglycan in Peri-Infarct Tissue Through the Involvement of TGF-β1[J].GLIA,2014,62:185-198.
[13]Cekanaviciute E,Fathali N,Doyle KP,et al.Astrocytic transforming growth factor-beta signaling reduces subacute neuroinflammation after stroke in mice[J].Glia,2014,62(8):1227-1240.
[14]Yoo SW,ChangdY,LeehS,et al.Immune following suppression mesenchymal stem cell transplantation in the ischemic brain is mediated by TGF-β[J].Neurobiology ofdisease,2013,58:249-257.
[15]Seo JH,Maki T,Maeda M,et al.Oligodendrocyte Precursor Cells Support Blood-Brain Barrier Integrity via TGF-β Signaling[J].PloS ONE,2014,9(7):e103174.
[16]Cai YY,Liu XF,Chen WX,et al.TGF-β1 prevents blood-brain barrierdamage and emorrhagic transformation after thrombolysis in rats [J].Experimental Neurology,2015,266:120-126.
(2016-03-24收稿 责任编辑:洪志强)
The Effects of Shennao Fuyuandecoction on Expression ofhGF and TGF-β in Middle Cerebral Artery Occlusion Rats
Hu Guoheng1,Liu Kan2,Wang Jinxi2,Li Yingchen2,Zeng Yong2,Liu Wanghua3
(1 Neurologydepartment of the Firsthospital ofhunan University of Chinese Medicine,Changsha 410007,China;2 Graduate School ofhunan University of Chinese Medicine,Changsha 410208,China;3 Institute ofdiagnostics of Traditional Chinese Medicine,Changsha 410007,China)
Objective:To investigate the neuroprotective mechanisms of Shennao Fuyuandecoction.Methods:Total 72 SD rat were randomly assigned into three groups:sham operation group(sham group),middle cerebral artery occlusion model group(model group),Shennao Fuyuandecoction group(SFD group).According to the executing time of 3,7,14days,rats in every group weredivided into three sub groups.Comparison of all groups were performed based on Neurological Severity Scores(NSS),the volume of cerebral infarction,the expression ofhGF and TGF-β.Results:NSS and the volume of cerebral infarction of SFD group were significantly lower(P<0.01),the expression ofhGF and TGF-β were obviouslyhigher(P<0.01).Conclusion:Shennao Fuyuandecoction can alleviate the neurologicaldefects and improve the reparation of injured brain,this neuroprotective effect is probablydue to the suppression of inflammatory and promotion ofhGF and TGF-β expression.
Shennao Fuyuandecoction;Ischemia stroke;HGF;TGF-β
R255.2;R285.5
A
10.3969/j.issn.1673-7202.2016.04.005
国家自然科学基金项目(编号:81273751;81573941;81373702;81473567);湖南省研究生科研创新项目(编号:CX2015B315; CX2015B326)
胡国恒(1961.09—),男,博士,二级教授,博士生导师,心脑血管疾病的中医药防治研究,E-mail:hugh9198@163.com
刘侃(1988.07—),男,博士,在读,从事脑血管疾病的中医药防治研究,E-mail:375476814@qq.com
