益气活血中药脑泰方对脑缺血后海马CA2区铁跨膜转运蛋白表达的调节作用
2016-09-02石咏梅余清平葛金文
廖 君 杨 梅 石咏梅 余清平 黄 娟 葛金文
益气活血中药脑泰方对脑缺血后海马CA2区铁跨膜转运蛋白表达的调节作用
廖君杨梅石咏梅余清平黄娟葛金文
(湖南中医药大学,长沙,410208)
目的:研究脑缺血后铁跨膜转运蛋白:转铁蛋白受体(Transferrin Receptor,TFR)、膜铁转运蛋白(Ferroportin,Fpn)、二价金属离子转运体(Divalent Metal Ion Transporter 1,DMT1)、人类猫白血病C亚类病毒受体(Feline Leukemia Virus Subgroup C Receptor,FLVCR)、胸腺癌抵抗蛋白(Breast Cancer Resistance Protein,BCRP)在益气活血法脑泰方(黄芪、川芎、地龙、僵蚕)干预后的表达变化。方法:随机将SD大鼠分为假手术组、模型组、脑泰方低、中、高剂量组(3、9、27 g/kg)。各组大鼠预处理灌胃给药连续3d,大脑中动脉栓塞法(Middle Cerebral Artery Occlusion,MCAO)模型制备术后连续灌胃给药3d,1次/d。术后3d取材,免疫组织化学及Western-blot检测TFR、Fpn、DMT1、FLVCR、BCRP的表达。结果:脑泰方高剂量组缺血海马CA2区TFR表达明显降低(P<0.05),DMT1量的表达减少(P<0.05),Fpn表达明显增高(P<0.05)。脑泰方各剂量组FLVCR表达明显增高(P<0.05),各脑泰方治疗组BCRP表达与模型组无差异。结论:脑泰方通过减少TFR、DMT1的表达,抑制铁的细胞内转运,增加Fpn、FLVCR的表达,促进胞内铁的外排,调节铁代谢,起到神经元的保护作用。
脑泰方提取物;铁跨膜转运蛋白;脑缺血
铁是神经元功能和生存的一个重要微量元素。铁在DNA和蛋白质合成中,及神经递质和电子传递链中起重要作用。铁离子也是一种催化剂,显著增加活性氧(Reactive Oxygen Species,ROS)的浓度。已有研究表明脑缺血后铁聚集导致神经元氧化应激损伤[1-3]。关于细胞内外铁离子转运,我们提出“两个中心,3个体系,网络调控”的工作模式[4]。非血红素铁跨膜转运蛋白有:转铁蛋白受体(TransferrinReceptor,TFR)、二价金属离子转运体(Divalent Metal Ion Transporter,DMT1)、膜铁转运蛋白(ferroportin,Fpn)。血红素铁转运蛋白包括:人类猫白血病C亚类病毒受体(Feline Leukemia Virus Subgroup C Receptor,FLVCR)和胸腺癌抵抗蛋白(Breast Cancer Resistance Protein,BCRP)。铁的吸收和外排是通过各种铁跨膜转运蛋白来实现的,前期研究表明益气活血中药脑泰方提取物具有良好的脑缺血治疗的临床效果[5],本实验通过观察脑泰方干预脑缺血后铁跨膜转运蛋白TFR、DMT1、Fpn、FLVCR、BCRP的表达,研究益气活血中药脑泰方干预治疗脑缺血的新机制。
1 材料
1.1实验动物 150只Sprague-Dawley(SD)雄性大鼠,体重250~280 g,清洁级,8周龄。由湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘) 2009-0004,符合清洁级实验动物标准。
1.2药物 脑泰方提取物分别为黄芪、川芎、地龙、僵蚕4味药,按照8∶2∶3∶3比例组成,经水煎、醇提后制成浸膏粉(由湖南中医学院药学院制剂教研室提取),1 g浸膏粉含4 g生药粉。临用时以生理盐水调成所需浓度。
1.3试剂与仪器 TFR多克隆抗体(SANTA CLUZ),Fpn多克隆抗体(Proteintech),DMT1(博奥森),FLVCR多克隆抗体(SANTA CLUZ),BCRP (Proteintech),三羟甲基乙二胺(Tris,Genview),甘氨酸(北京鼎国),丙烯酰胺(Sigma),N,N-亚甲基双丙烯酰胺(Genview),AP(过硫酸胺,Sigma),TEMED (N,N,N',N'-四甲基乙二胺,Sigma),蛋白预染Marker(105KD-2KD,Genview),ECL发光液(Amersham),电泳仪(北京百晶生物技术),垂直电泳槽(BIORad),转移电泳槽(BIO-Rad),转移脱色摇床(海门其林贝尔仪器),制冰机(AF10 SCOTSMAN),日本Olympus公司BX51光学显微镜,彩色图像分析系统(Optimas,美国)
1.4分组及给药方法 SD大鼠150只,随机分5 组,每组30只,分别为脑泰方提取物(NTE)低、中、高剂量组(灌胃剂量分别是3 g/kg,9 g/kg,27 g/kg)和假手术组(灌胃生理盐水)、模型组(灌胃生理盐水)。药物剂量按人鼠体表面积折算等效比率计量表,计算出大鼠的等效剂量。每次灌胃容量为1 mL/100 g大鼠,1次/d,术前灌胃3d,术后灌胃3d。于最后1次给药后1h麻醉,取标本。
1.5大鼠局部性脑缺血模型的建立 大脑中动脉
栓塞法(Middle Cerebral Artery Occlusion,MCAO) MCAO大鼠模型参照Garcia TH建立的方法[6]改进。实验选择250~280 g SD大鼠,线栓用直径为0.28 mm的鱼线,前端蘸蜡成光滑的球形。动物麻醉用10%水合氯醛(35 mg/kg)腹腔注射。仰卧位固定,于颈正中线切口,沿胸锁乳突肌内侧缘分离肌肉和筋膜,分离右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),在CCA的远心端和近心端及ECA处挂线备用。微动脉夹暂时夹闭ICA,近心端结扎CCA、ECA。然后在距CCA分叉4 mm处剪一小口,将拴线插入ICA,用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度18 mm时,紧紧系牢CCA远心端的细线。血管外的栓线不要留得过长,不需缝在皮外,以防大鼠醒来后自行拔出。缝合伤口,单笼饲养观察。
1.6免疫组化 石蜡切片烘烤,脱蜡,蒸馏水冲洗3min×2次,3%H2O2孵育10min,蒸馏水冲洗3min×2次,完成微波修复,PBS冲洗5min×3次,分别加入稀释100倍的兔抗鼠TFR、Fpn、FLVCR、BCRP 37℃2h,PBS冲洗5min×3次,加入二抗PV-600/山羊抗兔IgG,37℃孵育30min,PBS冲洗5min×3次,然后DAB显色。阳性细胞浆或细胞核着棕黄色,切片于光镜下放大400倍,经图像分析仪对每个切片随机选择5个视野。采用Image-Pro Plus 6.0软件进行检测,得出每张图片积分光密度(IOD)值。
1.7Western blot 1)SDS-PAGE凝胶配制。2)样品变性及电泳:加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液,95℃变性10min,将样品轻轻加入凝胶孔中,接通电源,电泳仪设置成稳压状态,将电压调至80 V使样品通过浓缩胶与分离胶(电压约8 V/cm)。110KD左右的Marker跑至凝胶中间位置,停止电泳。3)凝胶转膜及检测:凝胶电泳结束,将凝胶上分离到的蛋白条带通过转移电泳方式转印至固相支持物上,一抗反应:将一抗用封闭液稀释1 000倍;将封闭后的膜直接置入一抗工作液中,4℃反应过夜。二抗反应:将二抗用1×TBST稀释3 000倍;将洗涤后的一抗反应膜放入二抗工作液中(室温、避光缓慢摇动)60min。曝光及洗片:曝光完成后将膜用PBST洗10min,用膜再生液洗涤30min,再用PBST洗10min×3,将膜封闭后再加一抗进行下一个抗体的检测。
2 结果
2.1各治疗组血红素铁及非血红素铁转运蛋白免疫组化结果 与模型组比较,假手术组及各NTE组TFR的积分光密度值(IOD)较低(P<0.05);与假手术组比较,NTE高剂量组Fpn的积分光密度值(IOD)明显增高(P<0.05),模型组和NTE低、中剂量组IOD值无统计学意义;与模型组比较,假手术组及NTE高剂量组FLVCR的积分光密度值(IOD)较高(P <0.05),与假手术组比较,模型组和NTE低、中剂量组IOD值明显降低(P<0.05);与模型组比较,假手术组BCRP积分光密度值(IOD)增高(P<0.05),与假手术组比较,其他各组BCRP表达的IOD均降低(P<0.05),NTE各剂量组与模型组IOD无统计学意义(见表1,图1)。
表1 免疫组化检测脑缺血后各治疗组TFR、Fpn、FLVCR、BCRP的IOD值(±s)
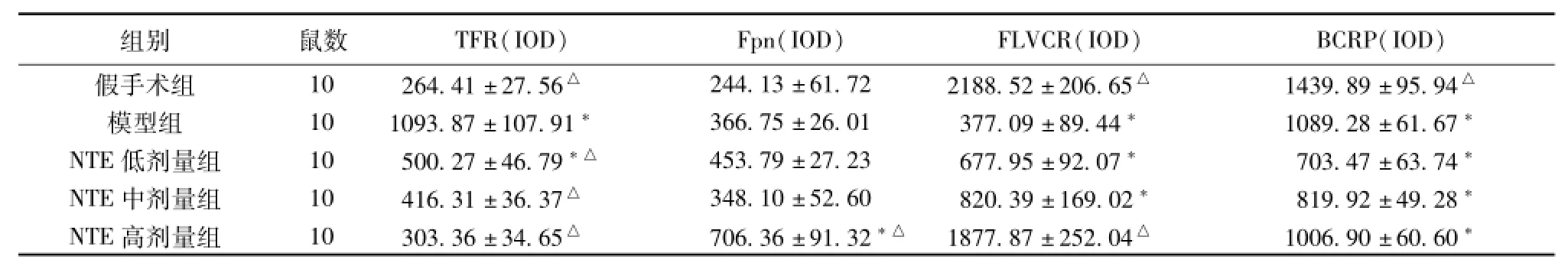
表1 免疫组化检测脑缺血后各治疗组TFR、Fpn、FLVCR、BCRP的IOD值(±s)
注:与假手术组比较:*P<0.05;与模型组比较:△P<0.05。
组别鼠数TFR(IOD)Fpn(IOD)FLVCR(IOD)BCRP(IOD)假手术组10264.41±27.56△244.13±61.722188.52±206.65△1439.89±95.94△模型组101093.87±107.91*366.75±26.01377.09±89.44*1089.28±61.67*NTE低剂量组10500.27±46.79*△453.79±27.23677.95±92.07*703.47±63.74*NTE中剂量组10416.31±36.37△348.10±52.60820.39±169.02*819.92±49.28*NTE高剂量组10303.36±34.65△706.36±91.32*△1877.87±252.04△1006.90±60.60*
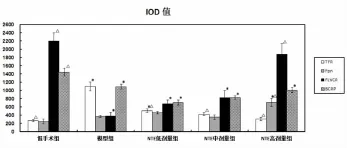
图1 免疫组化检测脑缺血后各治疗组海马CA2区TFR、Fpn、FLVCR、BCRP表达的IOD值
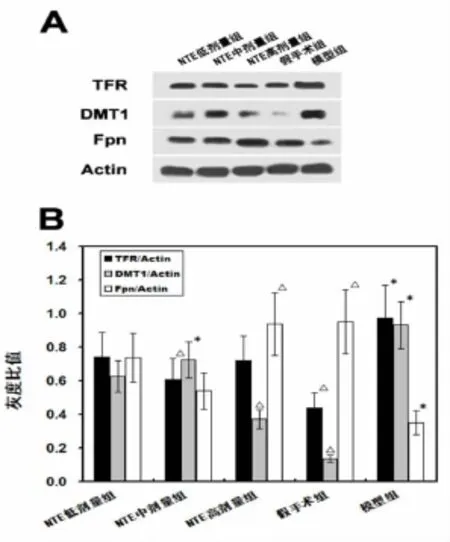
图2 Western-blot检测脑缺血后不同治疗组TFR、DMT1和Fpn的表达
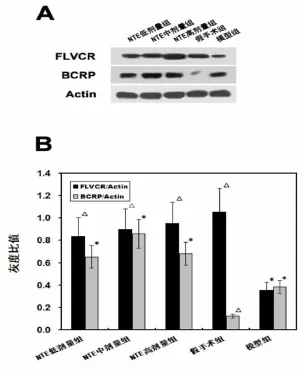
图3 Western-blot检测脑缺血后不同治疗组FLVCR 和BCRP的表达
2.2非血红素铁转运蛋白Western blot结果 脑缺血后NTE干预海马CA2区:与模型组比较,假手术组及NTE中剂量组的TFR表达降低(P<0.05);假手术组和NTE高剂量组较模型组的DMT1表达明显减少(P <0.05);与假手术组比较,模型组的Fpn的表达降低(P <0.05),与模型组比较,假手术组和NTE高剂量组Fpn表达明显增加(P<0.05)。见图2。
2.3血红素铁转运蛋白Western blot结果 脑缺血后NTE干预海马CA2区:与模型组比较,假手术组及NTE各剂量组的FLVCR表达明显增加(P<0.05);与假手术组比较,NTE低、中、高剂量组及模型组BCRP表达均明显增加(P<0.05),NTE低、中、高剂量组与模型组BCRP表达无统计学意义。见图3。
3 讨论
急性脑血管病归属于中医学中风病的范畴,中风病又名“卒中”。是以猝然昏仆,不省人事,半身不遂,口眼歪斜,语言不利为主的病症。因起病急骤,变化迅速,症见多端,与自然界善行数变之风邪特征相似,故名为“中风”。按病位深浅分为中脏腑和中经络,按病性分为缺血中风和出血中风。临床证明中药治疗脑缺血中风具有肯定效果。随着中药治疗脑缺血损伤机制的研究,提出“多途径、多靶点”[7-9],为中药治疗脑缺血的基础研究及临床合理用药提供了依据。
方中选用黄芪为君药,黄芪借其力专、性走,周行全身,大补脾胃元气,令气旺则血活,血活则瘀除,以治其本;川芎活血行气,气行则血行,是为臣药;地龙、僵蚕具有通经活络,化痰熄风的功效,两者均为佐药,诸味配合,共奏益气活血通络,祛风化痰之效。实验组获得脑泰方提取物,是采用正交设计的方法,有效的优选乙醇提取黄芪、川芎,水提地龙和僵蚕。通过对黄芪、川芎、地龙和僵蚕的定性鉴别以及对有效成分黄芪多糖、川芎嗪、阿魏酸含量测定研究,建立有效和稳定的控制制剂的质量标准,从而更好的保证药品的疗效及安全。有研究表明黄芪和三七治疗脑缺血可能是通过JAK1/STAT1[10]途径抑制NF-κB表达、调节内质网应激及抗炎、通过JNK[11-12]达到抗凋亡的作用。川芎降低脑缺血后血脑屏障渗透性保护神经元[13],川芎嗪通过抑制氧化应激和Bcl-2、Bax蛋白减少脑缺后细胞凋亡,通过抑制炎性因子TNF-α、IL-8减少炎性反应发生[14]。僵蚕可以抑制脑缺血后兴奋性谷氨酸导致的神经元损伤[15]。前期研究表明益气活血中药脑泰方通过HIF-1α/ VEGF通路[16]及上调VEGF-Notch1信号通路[17]促进脑缺血再灌注后血管新生。通过抑制MMP-9、PA及增加TIMP-1的表达脑泰方保护血脑屏障,以此减少脑水肿的发生[18-19]。
铁广泛存在于脑组织中,铁跨膜转运蛋白在维持铁平衡过程中具有重要作用。脑微血管内皮细胞浆膜的TFR通过结合TF能完成约50%以上的铁吸收[20]。除TFR外,DMT1也是跨膜铁离子转运体。在周围神经系统中雪旺细胞摄取非TF结合铁是通过DMT1完成[21]。研究发现在大脑皮质、海马、丘脑、脑干和小脑的神经元胞体,少突胶质细胞及脉络丛均有Fpn的表达[22]。神经元轴突损伤后,星形胶质细胞可通过Fpn分泌铁离子来促进髓鞘再生[23]。BCRP作为血红素铁输出蛋白,在血脑屏障内皮细胞及脑实质细胞上均有表达,临床研究中常作为药物通过血脑屏障的载体[24]。近年来,研究发现BCRP与阿尔茨海默病(Alzheimer’sdisease,AD)中Aβ肽沉积的发病机理具有关联[25-26]。脑缺血后铁聚集导致大量羟自由基生成,促进膜脂质和活性氧生成,细胞毒性损伤[1]。本课题组研究脑泰方提取物干预脑缺血后非血红素铁转运蛋白TFR、Fpn、DMT1及血红素铁转运蛋白FLVCR、BCRP的表达。实验表明与模型组比较,NTE高剂量组缺血海马CA2区TFR表达明显降低(P<0.05),DMT1量的表达减少(P<0.05),Fpn表达明显增高(P<0.05)。NTE各剂量组FLVCR表达较模型组明显增高(P<0.05),各NTE治疗组BCRP的表达与模型组无差异。本课题组提出,益气活血中药脑泰方可能是通过减少TFR、DMT1的表达,抑制铁的细胞内转运,增加Fpn、FLVCR的表达,促进胞内铁的外排,调节铁代谢,起到神经元的保护作用。
[1]Lu Q,Harris VA,Rafikov R,et al.Nitric oxide induceshypoxia ischemic injury in the neonatal brain via thedisruption of neuronal iron metabolism[J].Redox Biol,2015,23(6):112-121.
[2]van Etten ES,vander Grond J,Dumas EM,et al.MRI Susceptibility Changes Suggestive of Irondeposition in the Thalamus after Ischemic Stroke[J].Cerebrovascdis,2015,40(1-2):67-72.
[3]Minhas G,Modgil S,Anand A.Role of iron in ischemia-induced neurodegeneration:mechanisms and insights[J].Metab Braindis,2014, 29(3):583-91.
[4]廖君,葛金文.铁跨膜转运蛋白与脑神经疾病的相关性研究进展[J].湖南中医药大学学报,2011,31(11):76-78,81.
[5]贺运河,郝晓元,葛金文.脑泰方治疗气虚血瘀证脑梗塞临床研究[J].中国中医急症,2001,10(6):319-321.
[6]Garcia TH.A reliable method to occlude a middle cerebral in wistar rats[J].Stroke,1993,24(9):1423.
[7]刘丽宁.传统中药临床用药优势之一多靶点探讨[J].时珍国医国药,2010,21(3):745-746.
[8]刘志华,孙晓波.网络药理学:中医药现代化的新机遇[J].药学学报,2012,47(6):696-703.
[9]陈娟,顾俊菲,汪春飞,等.组分结构中药与网络药理学:病理机制网络的系统整体调控[J].中国中药杂志,2015,40(4):758-764.
[10]Huang XP,Dingh,Lu JD,et al.Effects of the Combination of the Main Active Components of Astragalus and Panax notoginseng on Inflammation and Apoptosis of Nerve Cell after Cerebral Ischemia-Reperfusion[J].Am J Chin Med,2015,18:1-20.
[11]Huang XP,Tanh,Chen BY,et al.Combination of total astragalus extract and total Panax notoginseng saponins strengthened the protective effects on braindamage through improving energy metabolism and inhibiting apoptosis after cerebral ischemia-reperfusion in mice [J].Chin J Integr Med,2015:24.
[12]Liu G,Song J,Guo Y,et al.Astragalus injection protects cerebral ischemic injury by inhibiting neuronal apoptosis and the expression of JNK3 after cerebral ischemia reperfusion in rats[J].Behav Brain Funct,2013,9:36.doi:10.1186/1744-9081-9-36.
[13]Tan F,Fu W,Cheng N,et al.Ligustrazine reduces blood-brain barrier permeability in a rat model of focal cerebral ischemia and reperfusion[J].Exp Ther Med,2015,9(5):1757-1762.
[14]Zhang C,Teng F,Tu J,et al.Ultrasound-enhanced protective effect of tetramethylpyrazine against cerebral ischemia/reperfusion injury [J].PLoS One,2014,9(11):e113673.
[15]Koo BS,AnhG,Moon SK,et al.Bombycis corpus extract(BCE) protectshippocampal neurons against excitatory amino acid-induced neurotoxicity[J].Immunopharmacol Immunotoxicol,2003,25(2): 191-201.
[16]陈懿,朱惠斌,廖君,等.脑泰方对脑缺血再灌注大鼠HIF-1α/ VEGF的调节作用[J].中国中西医结合杂志,2014,34(10): 1205-1230.
[17]陈懿,葛金文,廖君,等.局灶性脑缺血大鼠VEGF/Notch1信号分子的表达及脑泰方的调节作用[J].中国老年学杂志,2014,10 (34):5784-5786.
[18]廖君,张薇,夏兴,等.脑泰方对局灶性脑缺血大鼠脑组织核因子-κB、基质金属蛋白酶9及其抑制剂表达的影响[J].中国中医药信息杂志,2013,20(9):28-30.
[19]廖君,葛金文,陈懿,等.脑泰方对局灶性脑缺血大鼠血清MMP-9、PA及TIMP-1表达的影响[J].中国中医药现代远程教育杂志,2013,11(3):150-152.
[20]McCarthy RC,KosmandJ.Mechanistic analysis of iron accumulation by endothelial cells of the BBB[J].Biometals,2012,25(4):665-675.
[21]Vivot RM,Goitia B,Usach V,et al.DMT1 as a candidate for nontransferrin-bound iron uptake in the peripheral nervous system[J]. Biofactors,2013,39(4):476-484.
[22]Boserup MW,Lichota J,Hailed.Heterogenousdistribution of ferroportin-containing neurons in mouse brain[J].Biometals,2011,24 (2):357-375.
[23]Schulz K,Kroner A,David S.Iron efflux from astrocytes plays a role in remyelination[J].J Neurosci,2012,32(14):4841-4847.
[24]Yasuda K,Cline CB,Vogel P,et al.Drug Transporters on Arachnoid Barrier Cells Contribute to the Blood-cerebrospinal Fluid Barrier [J].Drug Metabdispos,2013,41(4):923-931.
[25]Abuznait AH,Kaddoumi A.Role of ABC Transporters in the Pathogenesis of Alzheimer'sdisease[J].ACS Chem Neurosci,2012,3 (11):820-831.
[26]Wolf A,Bauer B,Hartz AM.ABC Transporters and the Alzheimer'sdisease Enigma[J].Front Psychiatry,2012,3:54.
(2016-03-24收稿 责任编辑:洪志强)
Naotai Formula's Regulation Effects on Expression of Iron Transmembrane Protein inhippocampus CA2 of Cerebral Ischemia Rats
Liao Jun,Yang Mei,Shi Yongmei,Yu Qingping,Huang Juan,Ge Jinwen
(Hunan University of Traditional Chinese Medicine,Changsha 410208,China)
Objective:To observe the effects of Naotai Formula,a qi-replenishing and blood-activating formula made up by Milkvetch Root,Sichuan Lovage Rhizome,Earthworm,Stiff Silkworm on TFR,Fpn,DMT1,FLVCR and BCRP of rats with focal cerebral ischemia.Methods:The rats were randomlydivided into five groups as following:sham operation group,model group,lowdose group of NTE(3 g/kg),medialdose group of NTE(9 g/kg),and largedose group of NTE(27 g/kg).After threedays of corresponding therapy by intragastric administration once aday,the regional cerebral ischemia model was reproduced by middle cerebral artery occlusion(MCAO)with suture method.After threedays,the rats were treated with previous therapy.On the thirdday,TFR,Fpn,DMT1,FLVCR and BCRP of rats were observed by immunohistochemical method and Western-blot.Results:The expression of the TFR anddMT1decreased in largedose group of NTE(P<0.05);the expression of the Fpn increased in largedose group of NTE(P<0.05);the expression of the FLVCR increased in each NTEdose group(P<0.05);the expression of BCRPhad no obvious change.Conclusion:Naotai formula increased expression of Fpn and FLVCR,promoted the efflux of intracellular iron,decreased expression of TFR,DMT1,and inhibited the influx of iron,regulated the iron metabolism and played a role in the protection of neurons.
Naotai Formula extract(NTE);Iron transmembrane proteins;Cerebral ischemia
R2-031
A
10.3969/j.issn.1673-7202.2016.04.007
国家自然科学基金青年项目(编号:81303078)——基于铁代谢失调探讨脑缺血及缺血再灌注损伤新机制及益气活血法的干预作用;湖南省科技厅一般项目(编号:2014SK3052)——PI3-K/Akt通路对骨髓间充质干细胞移植的调控及机制研究;湖南省中医药管理局一般项目(编号:201593)——从亚细胞应激反应的角度探讨益气活血法治疗脑缺血的分子机制
廖君(1978.11—),女,博士,副教授,教研室副主任,脑缺血的中医药防治,E-mail:84085006@qq.com
葛金文(1964.09—),男,博士,教授,副校长,脑缺血的中医药防治,E-mail:40831556@qq.com
